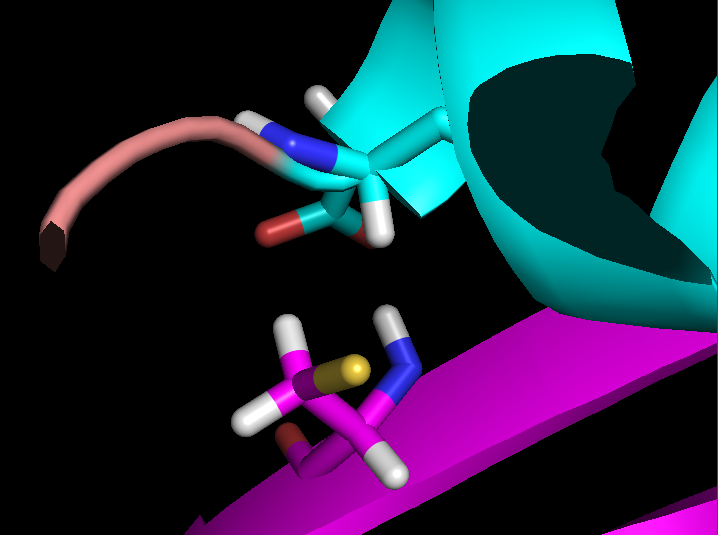Сравнение расшифровки структуры методами РСА и ЯМР
В качестве примера белка, структура которого была расшифрована обоими методами (РСА и ЯМР), был выбран токсин из яда желтого скорпиона (Leiurus quinquestriatus hebraeus) LQH-alpha-IT (альфа-токсин).
Этот токсин представляет собой короткий белок длиной 65 аминокислотных остатков, который может связывать натриевые каналы и блокировать передачу сигнала.
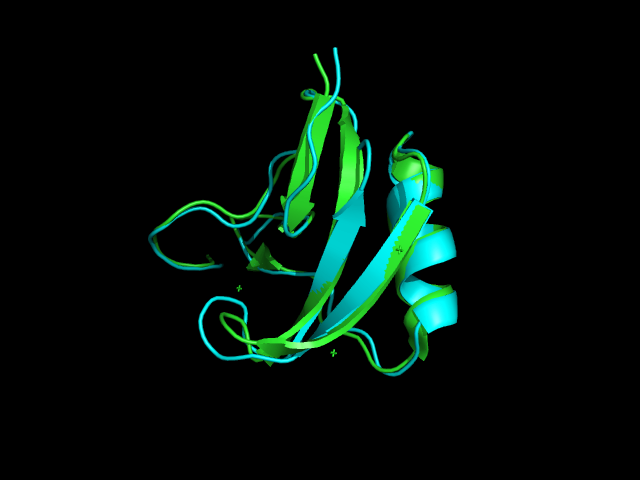
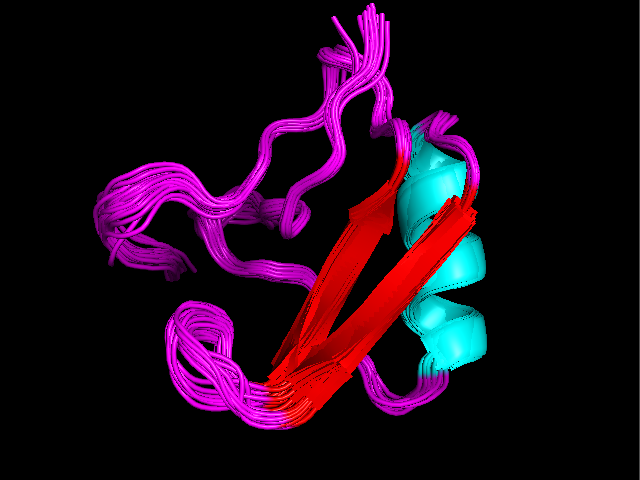
Структура альфа-токсина полученная с помощью РСА имеет PDBid 2ASC (разрешение 1,1 Å), с помощью ЯМР - 1LQI. В 1LQI записано 29 моделей. Структуры, визуализированные в PyMOL, представлены на рисунке 1.
Рисунок 1. Наложение консенсусной структуры 1LQI (голубая) на 2ASC (зеленая) (слева) и наложение всех моделей из 1LQI (справа) (раскраска по элементам вторияной структуры).
Из рисунка видно, что структуры, полученные двумя, методами в большой степени похожи. Отличается разметка β-тяжей - в ЯМР-структуре они короче и их меньше. Такая разметка кажется
обоснованной, потому что видно, что части тяжей РСА-структуры, несовпадающие с ЯМР-структурой, довольно подвижны. Кроме того можно сказать, что все модели в ЯМР достаточно похожи, и в них нет явно выбивающихся элементов.
Судя по всему, белок было очень трудно закристаллизовать. Об этом говорит наличие целых 8и разных лигандов в РСА-структуре. Кроме того, некоторые боковые группы в этой структуре не
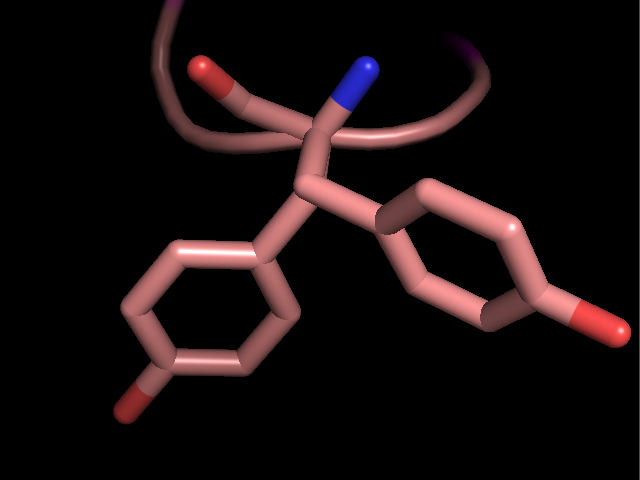
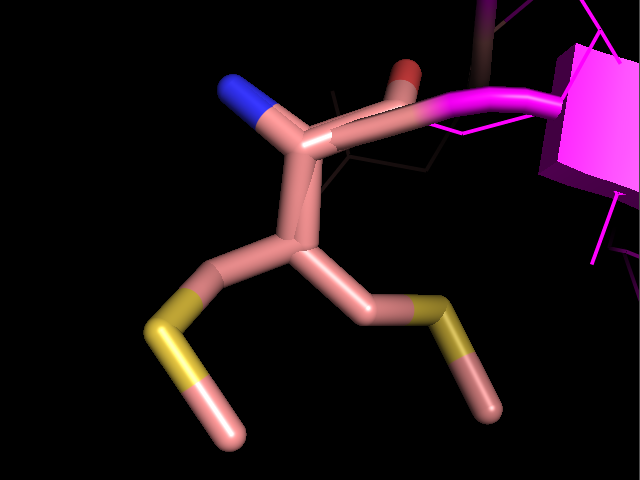
имеют однозначного положения, видимо, в кристалле они далеко не везде присутсвтовали в одинаковой конформации. Неоднозначно определенные боковые группы показаны на рисунке 2.
Рисунок 2. Неоднозначно решенные боковые группы в структуре 2ASC. Слева напрво: Tyr11, Lys29, Met1.
Рассмотрим некоторые водородные связи в альфа-токсине. Стоит сразу отметить, что помимо водородных связей, удерживающих альфа-спираль,
водородных связей в белке не так много. Его структура удерживается восновном засчет нескольких S-S мостиков (рис. 3). Для рассмотрения было выбрано 3 водородных связи в разных частях белка:
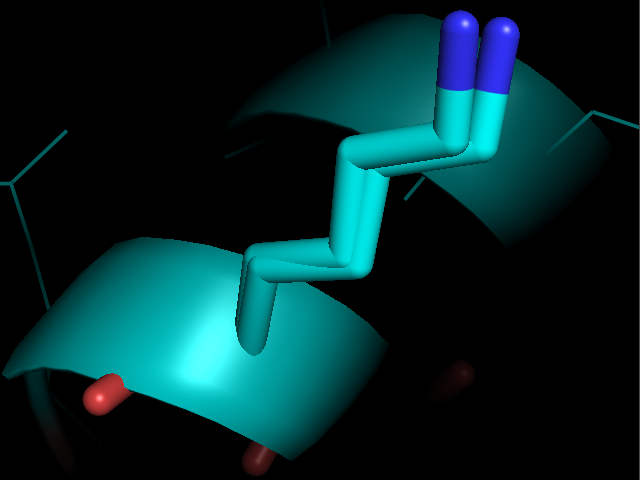
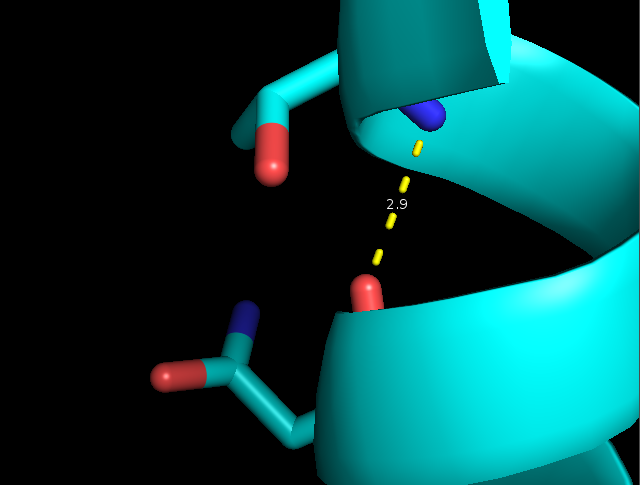
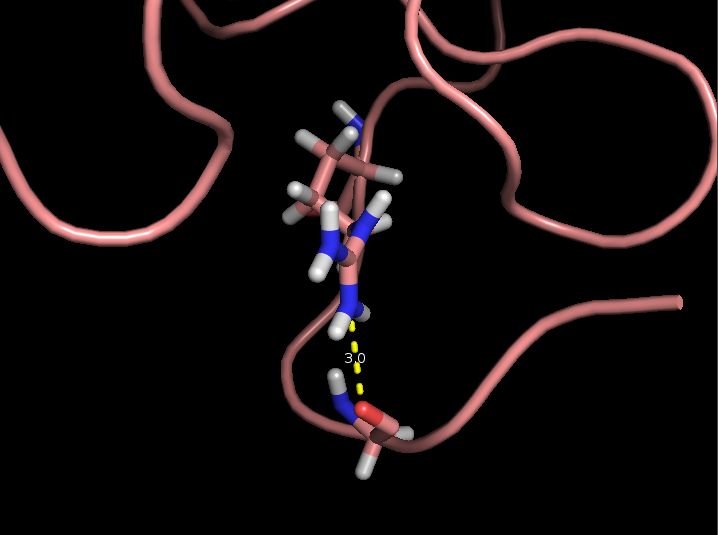
- Остовная связь в альфа-спирали между NH группой Thr28 и CO группой Asn24 (2,9 Å)
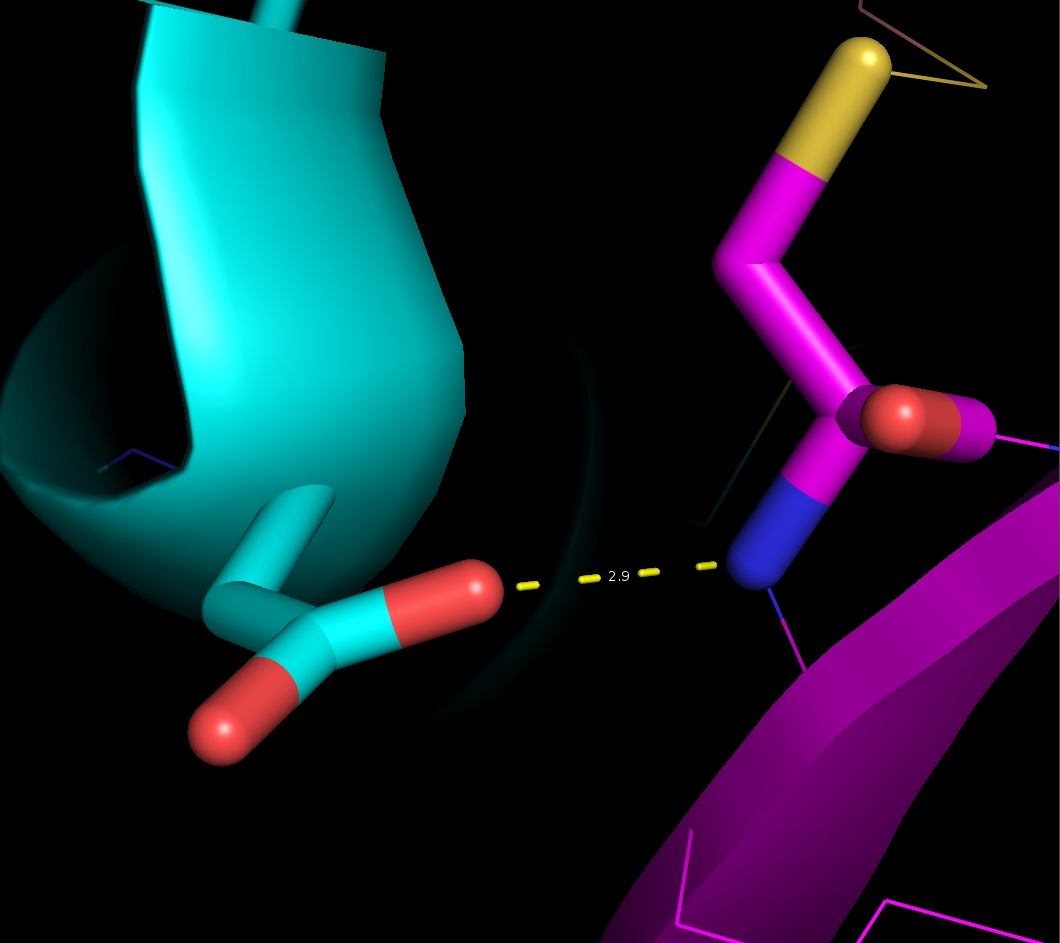
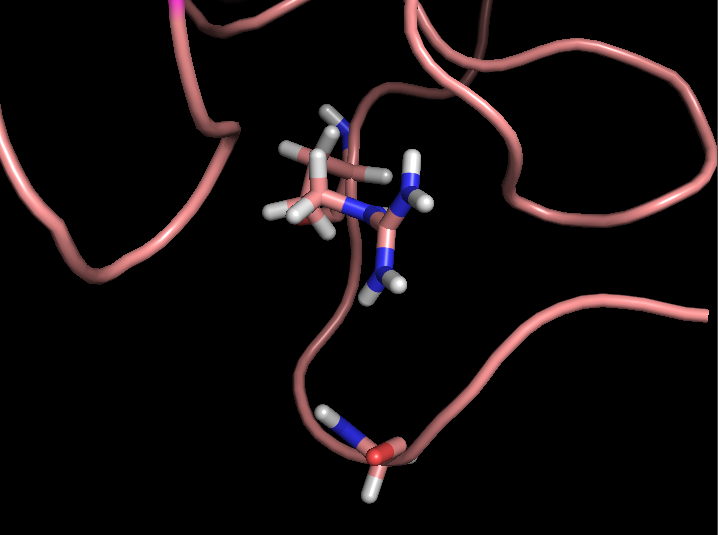
- Связь с участием боковой цепи в ядре белка между OD1 атомом Asp20 и NH группой Cys37 (2,9 Å)
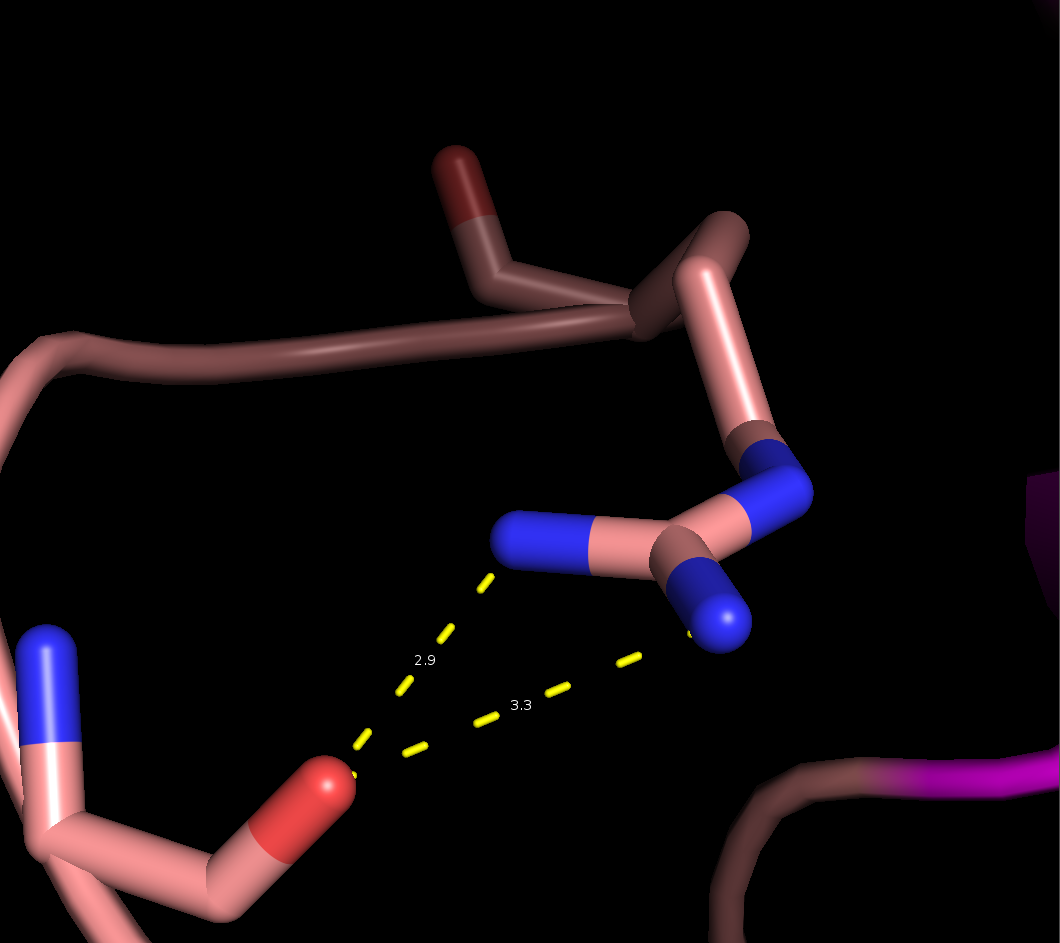
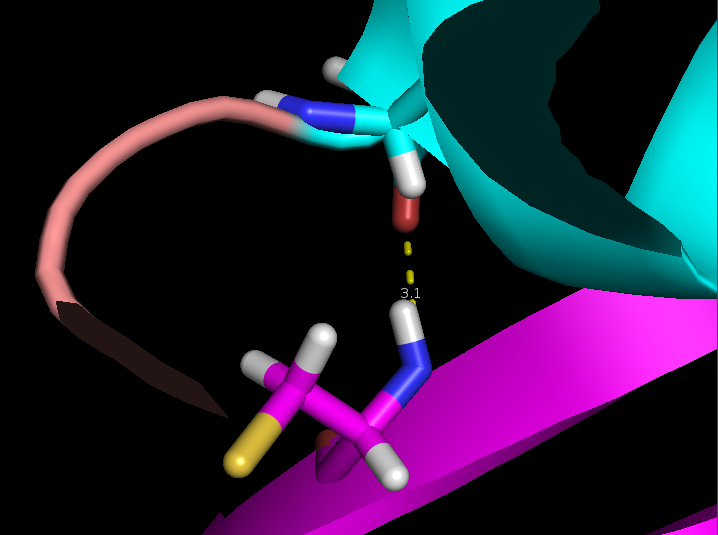
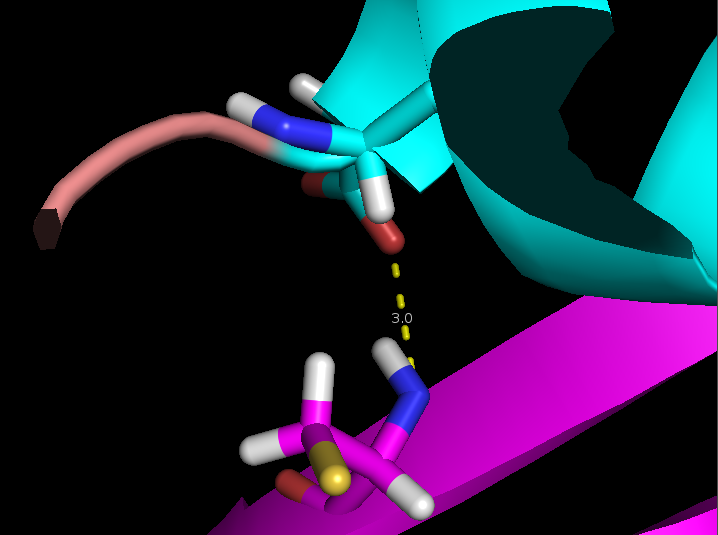
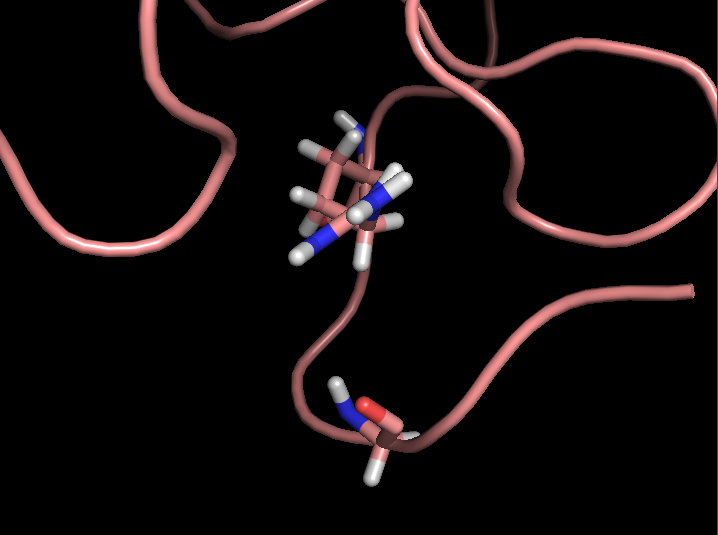
- Связь в неструктурированной петле, выходящей на поверхность глобулы, между NH1 и NH2 группами Arg59 и CO группой Gly62 (2,9 и 3,3 Å)
В качестве критерия отбора связи использовалась максимальная длина в 3,5 Å. Не использовались неоднозначно решенные остатки.
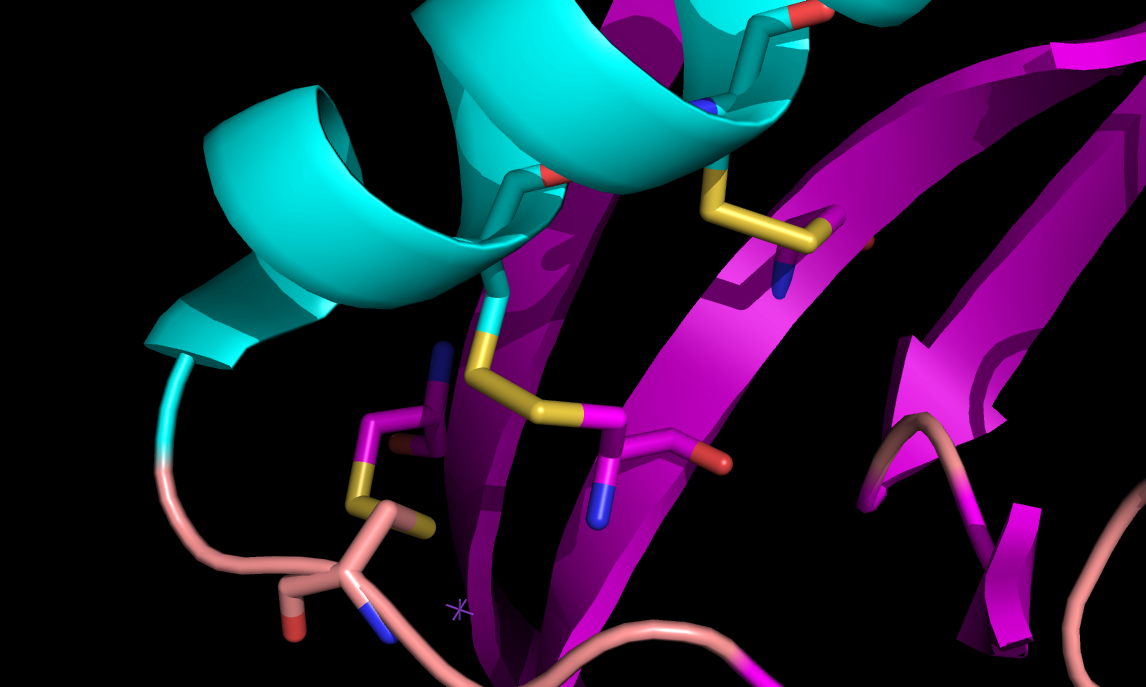
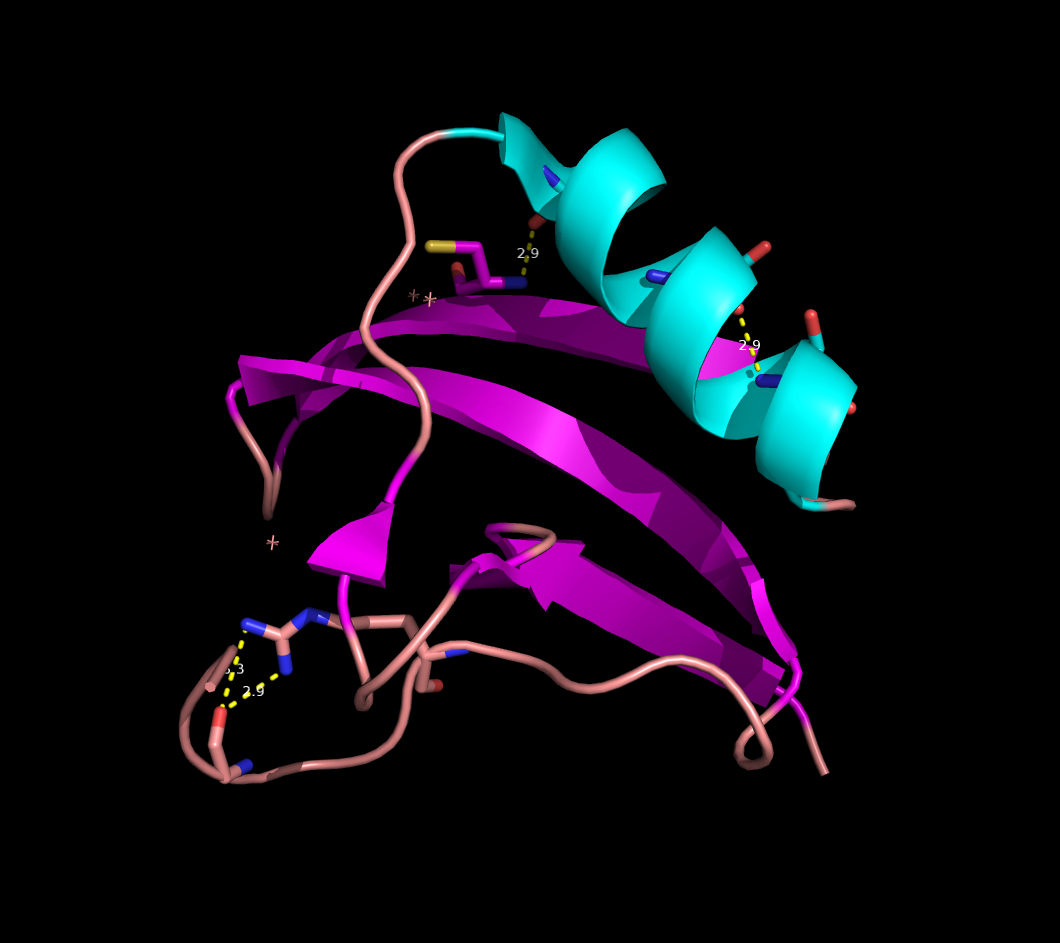
Выбранные связи в структуре 2ASC показаны на рисунке 3 (справа) и более детально на рисунке 4.
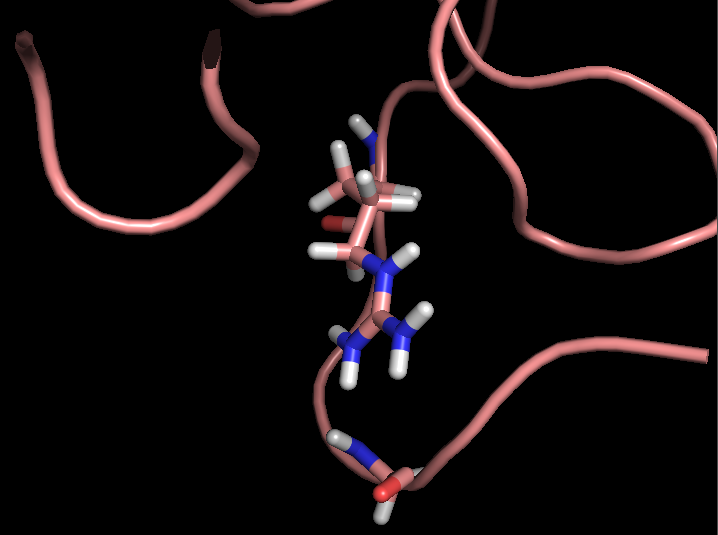
Рисунок 3. S-S связи в структуре 2ASC (слева) и расположение выбранных водородных связей в структуре 2ASC (справа).
Рисунок 4. Водородные связи разных типов в структуре 2ASC. Слева направо: Thr28-Asn24, Asp20-Cys37, Arg59-Gly62.
Прооверим, сохраняются ли эти водородные связи (в преедлах 3,5 Å) в разных моделях ЯМР. Проверка велась простым переключением между моделями с визуализированной связью.
Результаты проверки оказалсиь вполне предсказуемы:
- Связь в альфа-спирали сохраняется во всех 29 моделях и почти не вариьируется по длине, хотя и длинее, чем связь в РСА
- Связь боковой группы в ядре белке сохраняется почти во всех моделях, но довольно сильно варьируется по длине
- Связь в неструктурированной сохраняется только в 2 моделях из 29
В таблице ниже приведена информация о наличии и длине целевых связей в разных моделях, эту же информацию более детально можно посмотреть в файле.
| Расположение |
Донор |
Акцептор |
Расстояние в РСА |
% наличия в ЯМР |
max длина в ЯМР (Å) |
min длина в ЯМР (Å) |
Медианная длина в ЯМР(Å) |
| В спирали |
Thr28 (NH) |
Asn24 (CO) |
2,9 |
100 |
3,3 |
3,1 |
3,2 |
| В ядре |
Cys37 (NH) |
Asp20 (OD1) |
2,9 |
97 |
3,3 |
2,9 |
3,2 |
| В петле |
Arg59 (NH1) |
Gly62 (CO) |
2,9 |
7 |
3,4 |
3,0 |
3,1 |
Эти данные вполне объяснимы, потому что врастворе белок имеет досточно большую подвижность, в отличии от кристалла. Альфа-спираль - устойчивый элемент вториной структуры,
поэтому в ней выбранная связь почти не меняется врастворе. В то же время связь боковой группы в ядре белка сильно изменяется по длине из-за колебаний элементов вторичной структуры.
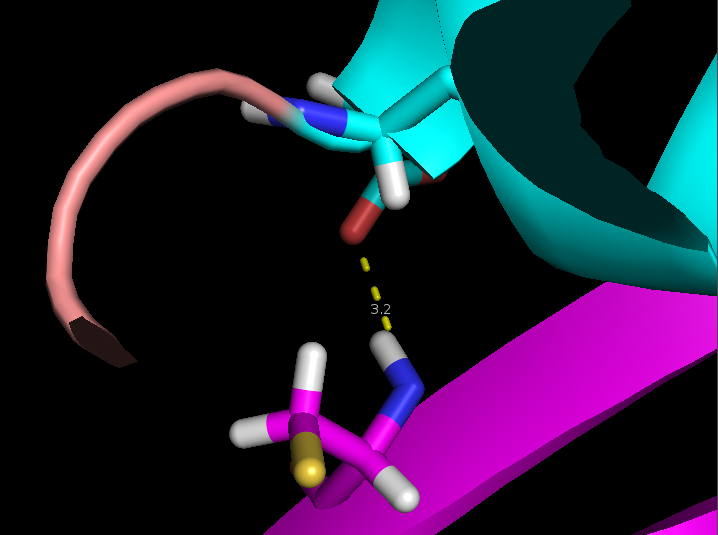
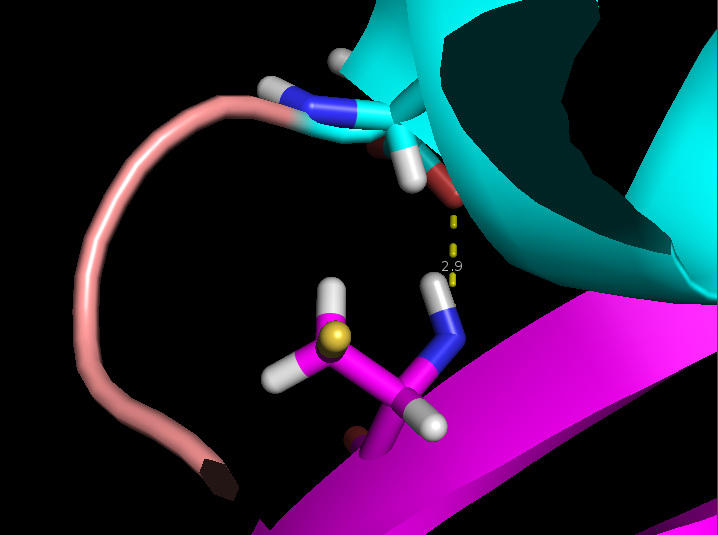
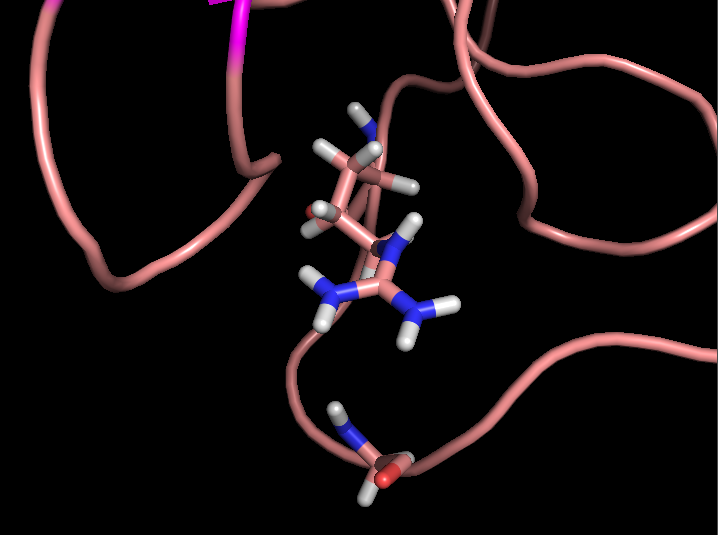
Связь в петле в растворе вообще почти не присутствует, петля очень лабильна и находится на поверхности, зачастую полярные остатки петли оказываются слишком далеко друг от друга (рис. 5), и им выгоднее образовать водородные связи с растворителем.
Рисунок 5. Измнение взаимного расположения остатков в разных моделях ЯМР Cys37 и Asp20 (сверху) и Arg59 и Gly62 (снизу).
Сессия PyMOL для визуализации выбранных связей в 2ASC (РСА)
Сессия PyMOL для визуализации выбранных связей в 1LQI (ЯМР)
© Марк Меерсон, 2015
Последнее обновление 16.12.2015