Практикум 2. Внутренности белков и макромолекулярных компексов
Скрипты:
Скрипт 1 Скрипт 2 Скрипт 3
1. Общие сведения о гидрофобных ядрах белквого комплекса
Прграмма CluD обнаружила в исследуемом белке около 40 гидрофобных ядер, однако проблем с выделением главного не возникло:
если размер большинства ядер не превышает 40 атомов, то первое ядро, которое будет рассматриваться, как основное, состоит из 7274 атомов. Процентное отношение количества атомов самого крупного
гидрофобного ядра к общему числу атомов составляет 23,4%. Ядро занимает центральное положение в белке, с его визуализацией Вы можете ознакомиться, нажав кнопку "Start script 1".
Таким образом, моно сделать вывод, что для перехода рассматриваемого белка в форму, характеризующуюся минимальной энергией,большинство аминокислот концентрируются
в одном большом гидрофобном ядре.
2. Плотность упаковки гидрофобного ядра
Плотность упаковки гидрофобного ядра исследовалась на примере аминокислотного остатка фенилаланина ([PHE]1:А), так
как его радикал относится к числу крупных. Скрипт 2 - визуализация исследуемого аминокислотного остатка и его окружения. Можно заметить, что при увеличении радиуса окружения количество атомов увеличивается,
причем постепенно атомы покрывают исследуемый аминокислотный остаток. В моём случае аминокислотный остаток почти полностью покрывается атомами на минимальном расстоянии 7А.
Количество атомов на разных расстояниях:
| Расстояние, A | Количество атомов |
| 1 | 0 |
| 2 | 1 |
| 3 | 5 |
| 4 | 25 |
| 5 | 44 |
| 6 | 63 |
| 7 | 96 |
Из таблицы можно сделать вывод, что минимальное растояние между ковалентно несвязанными между собой атомами в нашем примере - 1-2 A. При этом количесвто атомов начинает существенно увеличиваться на расстоянии 3-4 А.
Так как мой аминокислотный остаток экспонирован наружу, в промежуток между ним и соседними атомами могут поместиться молекулы воды.
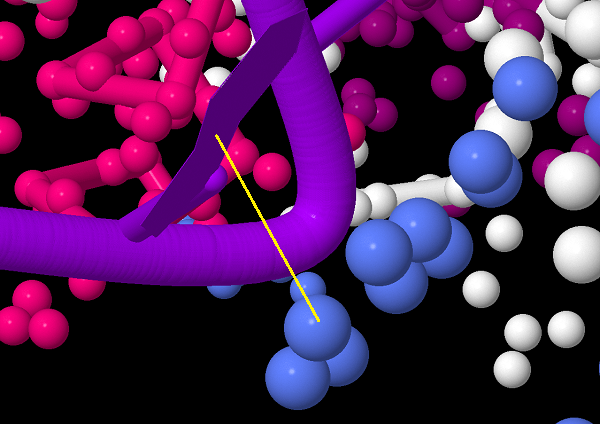
3. Комплекс белка с ДНК
Исследуется комплекс ДНК-полимеразы человека с ДНК. ДнК может по-разному взаимодействовать с белками,
при этом белки могут присоединяться к различным частям ДНК (например, к сахаро-фосфатоному остову). Скрипт 3 отображает взаимодействие мего белка с ДНК.
ДНК и белки могут находиться во взаимодействии в следующих случаях (самые распростанённые): если речь идёт о ферментах, которые работают с ДНК (полимеразы, лигазы, хеликазы, нуклеазы и тд), если белки участвуют в упаковке ДНК (например, гистоны).
Взаимодействия:
1. Стэкинг-взаимодействие между аденином ([DA]2) и триптофаном ([TRP]42) отмечено жёлтым:
|