На главную страницу четвертого семестра
Пептиддеформилаза (def_ecoli).
Пептиддеформилаза — это важнейший металлофермент (фермент, содержащий в качетсве кофактора металл [кобальт, железо]),
необходимый для удаления формиловых групп на N-концах зарождающихся полипептидных цепей у эубактерий.
Фермент функционирует как мономер (является мономерным) и присоединяет один ион цинка, катализируя реакцию:
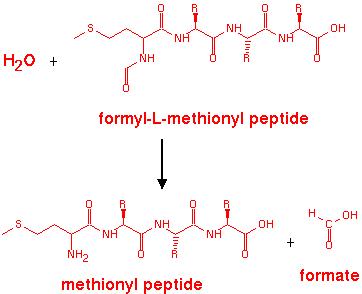
N-формил-L-метионин + H2O = формиат (соль муравьиной кислоты) + L-метионин.
Каталитическая эффективность сильно зависит от "присоединённости" металла (то есть если концентрация ионов цинка —
недостаточная, то — эффект другой).
Структура этих ферментов известна. Пептиддеформилаза, член семейства цинковых металлопротеаз, содержит активный
внутренний домен из 147 аминокислотных остатков и C-концевой хвост из 21 остатка. Трёхмерная структура
каталитического центра определена с помощью рентгеноструктурного анализа и спектроскопии ядерно-магнитного резонанса.
Структура содержит несколько антипараллельных цепей, которые окружают две перпендикулярные спирали (спирали окружены цепями!).
С-концевая спираль содержит характерный для металлоферментов HEXXH-мотив , который является ключевым для активности фермента.
Расположение спиралей и путь, по которому гистидиновы остатки присоединяют ион цинка, похожи на таковые у других металлопротеаз,
таких как термолизин или metzincins. Однако, окружение вторичной и третичной структур пептиддеформилазы, и расположение
третьего лиганда (третьего иона цинка) на остатке цистеина, отличают её от других металлопротеаз.
Эти различия, вместе с заметными биохимическими отличиями, дают основание полагать, что пептиддеформилаза
представляет собой новый класс цинковых металлопротеаз.
Пептиддеформилаза является привлекательной мишенью для разработки новых антибактериальных веществ. Долгое время считалось,
что этот фермент отсутствует у эукариотических организмов, но исследование геномных последовательностей показало, что он присутствует даже у человека, где является "эволюционным остатком" (рудиментом).
Функции описаны c помощью ресурсов EcoСyc .
© Андреева Мария аka mashik, 2006
