Занятие 2
Программы DSSP и HBplus.
Определение вторичной структуры белка с помощью программы DSSP
Необходимо определить вторичную структуру белка 1PFK с помощью программы DSSP.
Для этого я выполнила на kodomo команду:dsspcmbi 1pfk.pdb 1pfk.dssp
На выходе получила файл, который далее импортировала в Excel.PDB файл записи 1PFK.
Для каждой цепи (А, В) нужно было посчитать число элементов вторичной структуры, то есть число блоков, идущих подряд букв H (альфа-спираль) или Е (бета-тяж).
В таблице можно увитеть, что для цепи А программа DSSP нашла 11 элементов альфа-спирали и 11 элементов бета-тяжа, а для цепи В - 11 элементов альфа-спирали и 12 элементов бета-тяжа.
Далее я открыла PDB-файл в редакторе и изучила поля HELIX и SHEET. Мне нужно было сравнить два описания вторичной структуры (вычисленное DSSP и приведённое авторами записи). Я провела сравнение на примере цепи А:
α-спирали β-тяжи DSSP PDB DSSP PDB 16-29 15 - 30 3 - 8 2 - 9 40 - 45 40 - 47 33 - 37 33 - 38 - 73 - 78 49 - 52 48 - 52 79 - 91 78 - 93 96 - 101 96 - 101 103 - 114 102 - 116 119 - 123 118 - 122 139 - 160 138 - 160 163- 168 162 - 168 175 - 183 177 - 185 188 - 190 188 - 190 198 - 210 197 - 212 216 - 221 216 - 221 227 - 238 226 - 239 242 - 246 241 - 247 - 248 - 252 282 - 287 281 - 287 258 - 277 257 - 278 290 - 295 290-295 296 - 302 295 - 302 309 - 318 308 - 319
Как видно из таблицы, границы бета-тяжей и альфа-спиралей, определённые DSSP, практически полностью совпали с данными авторов PDB-файла (совпадение не совсем точное, т.к. DSSP не включает в состав альфа-спирали граничные остатки).
Анализ значений торсионного угла φ в выдаче DSSP.
В выдаче DSSP мне нужно было рассмотреть колонку с информацией об угле φ. Просмотрев её, можно сделать достаточно простой вывод о том, что большинство углов имеют отрицательные значения.Остатки, имеющие положительное значение угла φ:
Цепь А:
M Метионин 0; I Изолейцин 1; G Глицин 10; G Глицин 15;
G Глицин 31; D Аспарагиновая кислота 39; G Глицин 40;
D Аспарагиновая кислота 47; D Аспарагиновая кислота 59; G Глицин 69;
G Глицин 93; G Глицин 116; G Глицин 132;
G Глицин 138; Q Глутамин 161; G Глицин 170;
R Аргинин 171; G Глицин 185; G Глицин 212;
H Аргинин 223; G Глицин 239; G Глицин 248
G Глицин 254; G Глицин 278; G Глицин 281;
N Аспарагин 288; E Глутаминовая кислота 289.Цепь В:
M Метионин 0; I Изолейцин 1; G Глицин 10;
G Глицин 15; G Глицин 31; D Аспарагиновая кислота 39;
G Глицин 40; D Аспарагиновая кислота 47; D Аспарагиновая кислота 59;
G Глицин 65; G Глицин 69; G Глицин 93;
G Глицин 116; T Треонин 125; N Аспарагин 128;
G Глицин 132; G Глицин 138; Q Глутамин 161;
G Глицин 170; R Аргинин 171; G Глицин 185;
G Глицин 212; H Аргинин 223; G Глицин 239;
G Глицин 248; G Глицин 254; G Глицин 278;
G Глицин 281; N Аспарагин 288; E Глутаминовая кислота 289.Далее я создала в PyMOL изображение, представляющее остовную модель (ribbon) цепи А белка, на котором различными цветами выделены альфа-спирали, бета-тяжи, остатки с положительным φ:
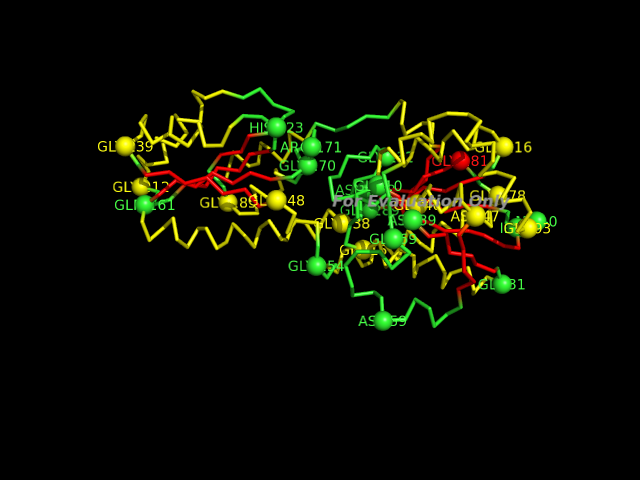
Альфа-спирали покрашены в желтый цвет, а бета-листы - в красный. Подписаны остатки с положительными значениями угла φ.
Определение водородных связей с помощью программы HBPlus.
Файл 1PFK.pdb был подан на вход программе HBPlus, определяющей водородные связи с помощью командыhbplus 1pfk.pdb
Выдача программы: 1PFK.hb2.
Примеры водородных связей:
а) участвующих в стабилизации вторичной структуры:
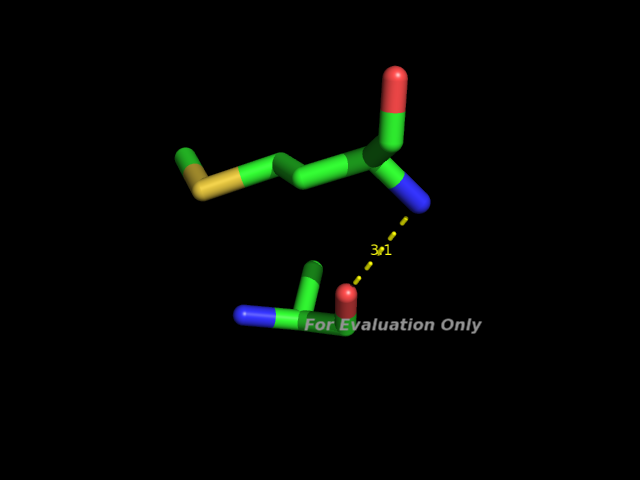
A0016-MET N A0013-ALA O 3.09 MM 3 5.92 159.1 2.14 147.8 149.2 34
Это связь между атомом N метионина 16 цепи А и атомом O аланина 13 цепи А.
Изображение этой связи:
б) между боковыми цепями аминокислотных остатков:
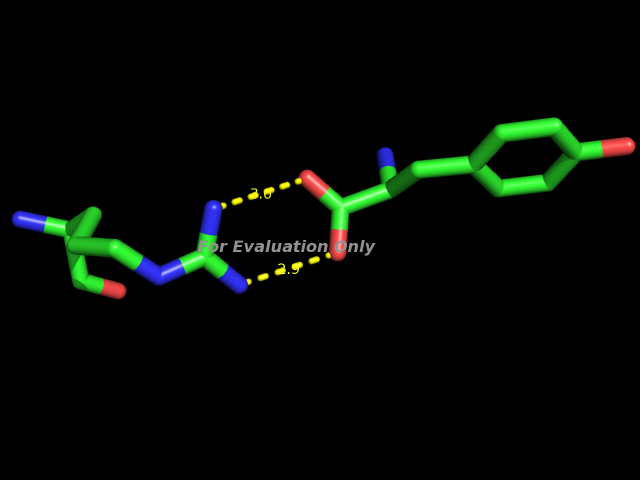
A0054-ARG NH1 B0319-TYR OXT 2.96 SS -1 9.22 161.7 2.00 120.2 119.1 114
Это связь между атомом NH1 аргинина 54 цепи А и атомом OXT тирозина 319 цепи B.
Изображение этой связи:
в) между боковой цепью одного остатка и остовным атомом другого:
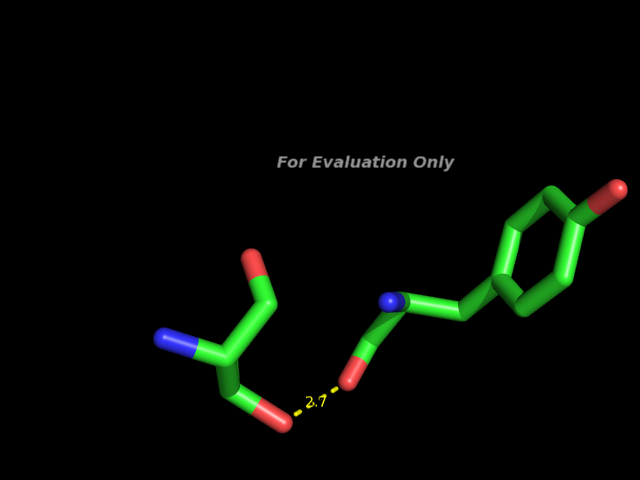
A0133-THR OG1 A0135-TYR O 2.67 SM 2 5.29 179.0 1.67 144.4 144.6 236
Это связь между атомом OG1 треонина 133 цепи А и атомом O тирозина 135 цепи А.
Изображение этой связи:
г) водородные связи между белком и каким-либо лигандом (малой органической молекулой):
малые органические молекулы в структуре отсутствуют
д) водяные мостики:
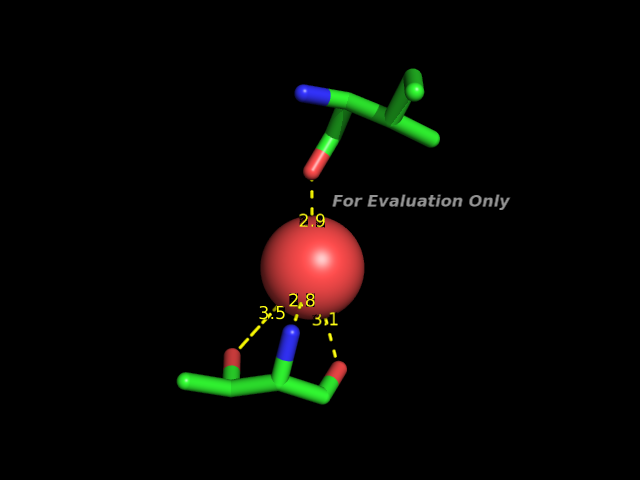
A0008-THR N A0329-HOH O 2.75 MH -2 -1.00 175.7 1.75 -1.0 -1.0 16
A0329-HOH O A0037-ILE O 2.85 HM -2 -1.00 -1.0 -1.00 -1.0 142.1 77Это водяной мостик, образованный молекулой воды 329 цепи А между атомом О изолейцина 37 цепи A и атомом N треонина 8 цепи A.
Изображение этой связи:
<<Обратно на четвертый семестр
<<Обратно на главную страницу©Лелекова Мария,2010