Общая характеристика структуры 2FCA
Идентификатор PDB: 2FCA.
Название белка: tRNA (m7G46) methyltransferase(тРНК(m7G46)метилтрансфераза).
Количество разных цепей в PDB-файле:2
Помимо координат атомов белка и воды, в PDB-файле указаны координаты лигандов белка – атомы калия (всего 3 атома).
Общий вид структуры белка представлен на рисунке 1.
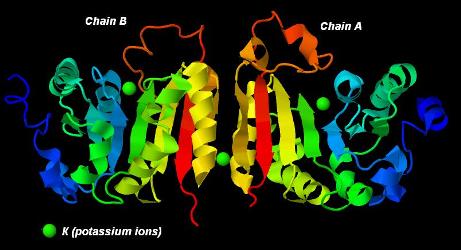 Рис 1. Общий вид структуры белка.
Показаны цепь А (справа) и цепь В (слева), которые представляют собой идентичные последовательности.
В обеих цепях аминокислота на N-конце – аспарагин, аминокислота на С-конце – треонин; в «направлении»
последовательности окраска каждой цепи от N-конца к С-концу меняется от синей к красной («обратная» радуга).
Рис 1. Общий вид структуры белка.
Показаны цепь А (справа) и цепь В (слева), которые представляют собой идентичные последовательности.
В обеих цепях аминокислота на N-конце – аспарагин, аминокислота на С-конце – треонин; в «направлении»
последовательности окраска каждой цепи от N-конца к С-концу меняется от синей к красной («обратная» радуга).
Анализ структуры альфа-спиралей и бета-листов в цепи А белка 2FCA
В работе были рассмотрены некоторые элементы вторичной структуры белка. В каждой цепи по 12 альфа-спиралей и по одному бета-листу. Для анализа выбраны по одному элементу цепи А.
На рисунке 2 представлен общий вид альфа-спиралей в цепи А, на рисунке 3 – общий вид, расположение бета-листа.
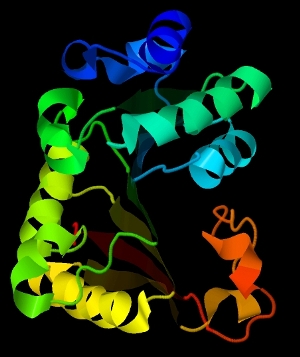 Рис. 2. Общий вид альфа-спиралей в цепи А.
Рис. 2. Общий вид альфа-спиралей в цепи А.
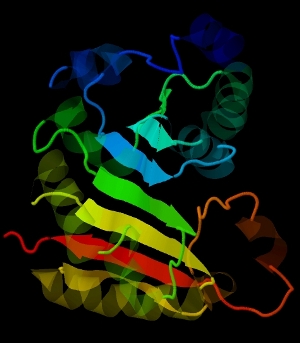 Рис. 3. Расположение бета-листа в цепи А.
Рис. 3. Расположение бета-листа в цепи А.
Альфа-спираль
Для анализа выбрана цепь, содержащая аминокислотные остатки с 9 по 16 в цепи А белка (далее – альфа-спираль 9-16) (рис. 4). На N-конце спирали – триптофан, на C-конце – аспарагин. «Направление» аминокислотной последовательности показано стрелкой (остаток аспарагина белого цвета).
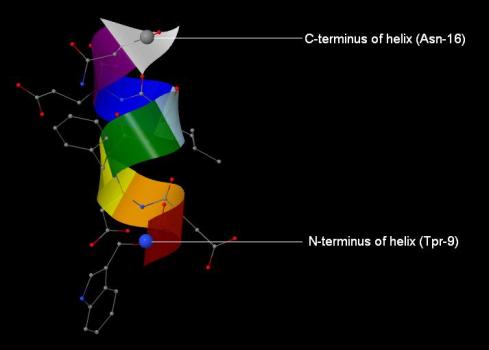 Рис. 4. Альфа-спираль 9-16 цепи А.
Рис. 4. Альфа-спираль 9-16 цепи А.
Шаг спирали равен примерно 5,08 А (примерно 0,5 нм). На один виток приходится по 3 аминокислотных остатка, что свидетельствует о сравнительно плотной «укладке» (наиболее часто встречаются спирали с количеством 3,6).
Водородные связи для остатка N в цепи будут образовываться для атомов кислорода карбонильной группы с атомами азота аминогруппы группы остатков N+2, для атомов азота аминогруппы – наоборот. Водородные связи показаны на рисунке 5.
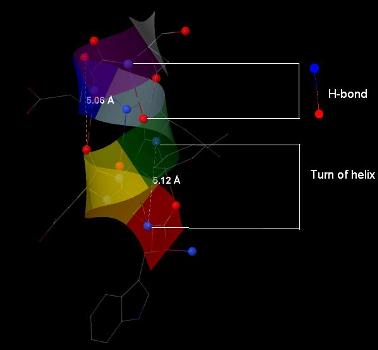 Рис. 5. Альфа-спираль 9-16 цепи А. Показаны расстояния между двумя различными витками спиралей (5,06 А и 5,12 А; расстояния позволяют сделать вывод о средней длине витка). Пунктирными линиями изображены водородные связи между атомами азота (синего цвета) аминогрупп и атомами кислорода (красного цвета) карбонильных групп разных остатков аминокислот.
Рис. 5. Альфа-спираль 9-16 цепи А. Показаны расстояния между двумя различными витками спиралей (5,06 А и 5,12 А; расстояния позволяют сделать вывод о средней длине витка). Пунктирными линиями изображены водородные связи между атомами азота (синего цвета) аминогрупп и атомами кислорода (красного цвета) карбонильных групп разных остатков аминокислот.
Бета-лист
Для анализа был выбран бета-лист цепи А, состоящий из 7 бета-тяжей (содержащих от 3 до 5 аминокислотных остатка). Внешний вид листа представлен на рисунке 6. «Направление» тяжей указано стрелками, в листе 6 тяжей параллельны, между первым и третьим тяжем располагается один, являющийся антипараллельным для остальных. Тяжи соединены водородными связями и образуют выпукло-вогнутую структуру, которая в пространстве частично скручивается в спираль (см. рис. 7).
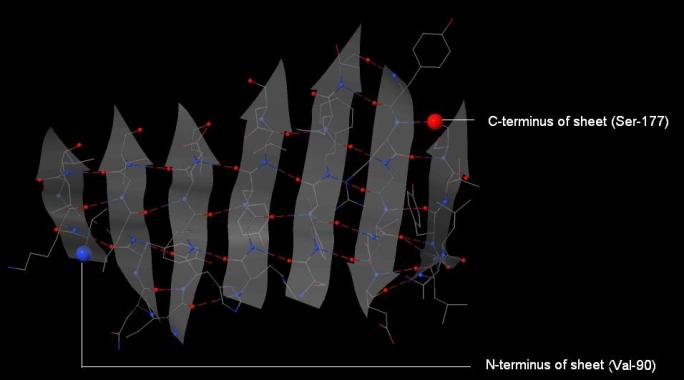 Рис. 6. Бета-лист цепи А. Красным выделен атом азота N-конца листа (т. е. атом азота аминогруппы первого бета-тяжа), синим выделен атом кислорода C-конца листа (т. е. атом кислорода карбоксильной группы последнего, седьмого, бета-тяжа). Водородные связи показаны пунктирными линиями. Направление тяжей показаны стрелками.
Рис. 6. Бета-лист цепи А. Красным выделен атом азота N-конца листа (т. е. атом азота аминогруппы первого бета-тяжа), синим выделен атом кислорода C-конца листа (т. е. атом кислорода карбоксильной группы последнего, седьмого, бета-тяжа). Водородные связи показаны пунктирными линиями. Направление тяжей показаны стрелками.
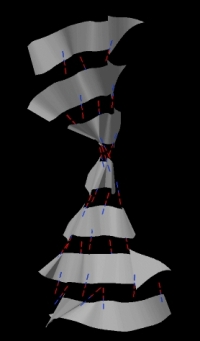 Рис. 7. Бета-лист цепи А в пространстве. Вид спирали.
Рис. 7. Бета-лист цепи А в пространстве. Вид спирали.
Внутримолекулярные взаимодействия боковых групп белка в цепи А структуры 2FCA
Дисульфидные мостики
Дисульфидные связи образуются между атомами серы аминокислотных остатков цистеина. В белке 2FCA цистеин не встречается, поэтому можно заключить, что дисульфидных мостиков в структуре нет.
Солевые мостики
Для анализа вновь выбрана цепь А белка в связи с идентичностью второй цепи.
Совершив поиск с помощью программы JMol, в цепи можно обнаружить всего четыре солевых мостика. Солевые мостики – это ионная связь, образованная положительно заряженной (аргинин, лизин, гистидин) и отрицательно заряженной (аспрагиновая и глутаминовая кислота) аминокислотами белка.
На рисунке 8 показаны атомы, которые непосредственно участвуют и отвечают за образование солевых мостиков; между остатками аминокислот, которым принадлежат эти атомы, образуется ионная связь. На рисунке 9 можно увидеть структуру солевого мостика на примере взаимодействия аргинина и глутаминовой кислоты.
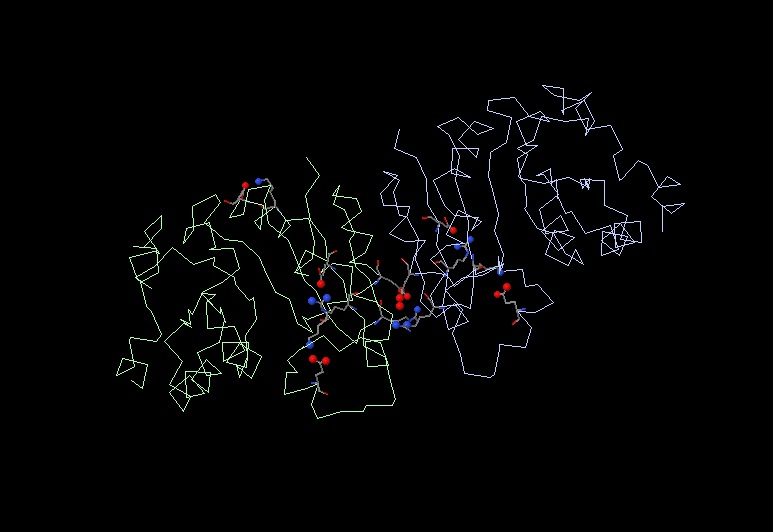 Рис. 8. Солевые мостики в белке.
Рис. 8. Солевые мостики в белке.
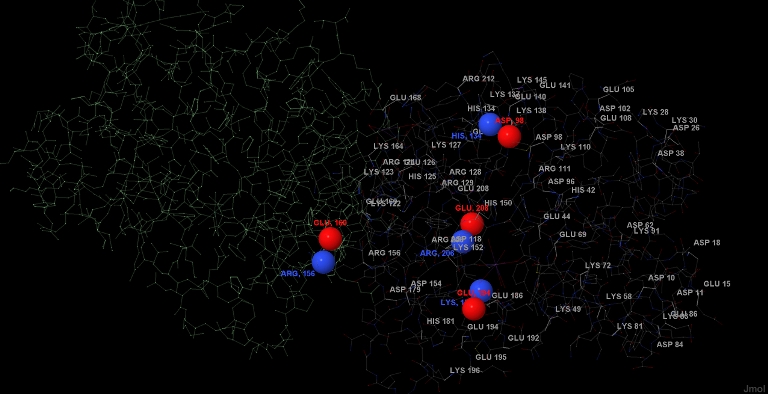 Рис. 8.1. Солевые мостики цепи в А (см. пояснения в тексте).
Рис. 8.1. Солевые мостики цепи в А (см. пояснения в тексте).
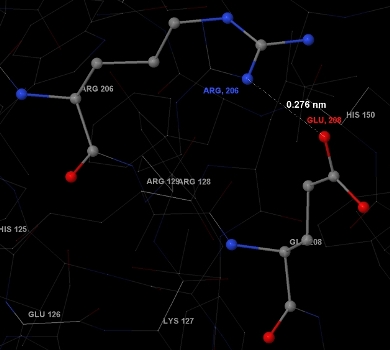 Рис. 9. Структура солевого мостика на примере глутаминовой кислоты (Glu-208) и аргинина (Arg-206). Показано расстояние между атомами азота и кислорода, участвующими в образовании ионной связи (см. пояснения в тексте).
Рис. 9. Структура солевого мостика на примере глутаминовой кислоты (Glu-208) и аргинина (Arg-206). Показано расстояние между атомами азота и кислорода, участвующими в образовании ионной связи (см. пояснения в тексте).
© Medvedev Dima 2012; дата последнего обновления 06.02.2013