Создание репрезентативной выборки гомологов белка TRMB_BACSU
Для создания репрезинтативной выборки белка TRMB_BACSU воспользуемся алгоритмом BLAST. Чтобы сделать выборку наиболее информотивной, определим филум иследуемого оргонизма. Для Bacillus subtilis(T.yellowstonii) - это Nitrospirae (Bacteria, Nitrospirae, Nitrospira, Nitrospirales,Nitrospiraceae, Thermodesulfovibrio, Thermodesulfovibrio yellowstonii, Thermodesulfovibrio yellowstonii DSM 11347). Далее для обоих поисков зададим некоторые параметы: колличество хитов(5000 для поиска по прокариота и 500 по эукариотам) , e-value.Проведем поиск по прокариотам (исключая Eukaryota, Firmicutes) и по эукариотам (ведем поиск только по Eukaryota). Результаты поиска приведены в Таблице 1.
Таблица 1. Результаты поиска по таксонам.
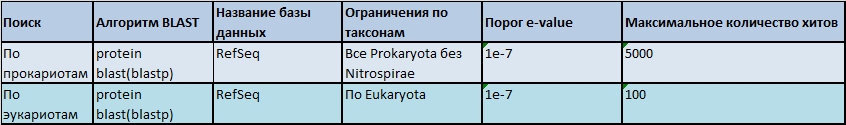
Следующим шагом получения репрезентативной выборки, будет обработка полученных данных по таксонам. Среди Bacteria было полученно - 3005 находок, среди Eukaryotes - 21 , но Archaea нет ни одной. Это говорит о том, что гомологичные белки чаще встречаются среди прокариотических форм, и редко у более продвинутых организмов.
Результаты таксаномической обработки можно посмотреть в Таблице 2.
Таблица 2. Результаты поиска гипотетических гомологов белка TRMB_BACSU с фильтром по таксонам.

Рис. 1. Общее таксономическое дерево гомологов белка TRMB_BACSU.
Множественное выравнивание гомологов белка TRMB_BACSU
В результате отбора таксоспецефических групп было выбранно 29 гомологов. Объеденив гомологичные последовательности был получен один FASTA-файл содержащий их(без TRMB_BACSU, для дальнешего проведения множественного выравнивания). Добавим к полученному файлу FASTA-последовательность начального белка. Затем проводим множественное выравнивание последовательностей гомологов с помощью программы MUSCLE на сайте EBI(Европейского Биоинформатического Института). Параметры выравнивания не были изменены и остались "по умолчанию". Файл с выравниванием был сохранен в формате FASTA.
Рис. 2. Выравнивание последовательностей гомологов TRMB_BACSU с исходной последовательностью. Цветовая гамма: синий цвет - неполярные, амфотические; зеленым - ароматические; розовым - полярные незаряженые; желтым - положительно заряженые; бирюзовый - отрицательно заряженые. Следующая линия(BLOCKS) обозначает "болки" и указывается синими буквами "B" вдоль строки. Строка LIGAND показывает аминокислоты начального белка соединяющиеся с лигандом(в данном случаи с калием). SECONDARY указывает альфа-спирали и бета-листы изначального белка TRMB_BACSU. Следующая линия(BLOCKS) обозначает "болки" и указывается синими буквами "B" вдоль строки. Строка LIGAND показывает аминокислоты начального белка соединяющиеся с лигандом(в данном случаи с калием). SECONDARY указывает альфа-спирали и бета-листы изначального белка TRMB_BACSU.

Рис. 3. Выравнивание последовательностей гомологов TRMB_BACSU с исходной последовательностью. Цветовая гамма : Clustalx. Так же задан параметр By Conservation = 8. На ней лучше видны блоки выравнивания и места консервативных позиций.

Полученное выравнивание(Рис. 3) можно оцень как удовлетворительное или при большом желании хорошимое, посколько прослеживается большое количество консервативных позиций.
Гомологи имеют похожую пространственную структуры, что и белок по которому проводился поиск. Посколько на участках бета-листов и альфо-спиралей белка TRMB_BACSU можно проследить схожесть с гомологичными последовательностями(см. Рис. 4)
Рис. 4. Цепь A белока TRMB_BACSU раскрашеная по схеме Рис. 3.
Интересное наблюдение складывается при просмоте участков участвующих в связывании с лигандом. Здесь наблюдаются как консервативные позиции так и специфические, что говорит нам о наличии других элементах на месте лиганда, или даже о возможном отсудствии.
Рис. 5. Цепь A белока TRMB_BACSU раскрашеная по схеме Рис. 3 аминокислоты участвующие в свяывниии с концевым лигандом(отмечаный зеленым цветом) отмечаны синим.
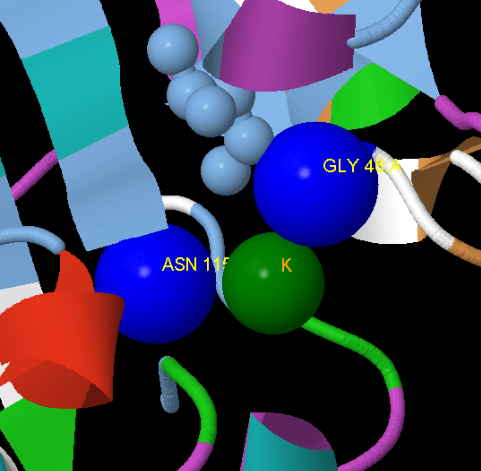
Рис. 6. Цепь A белока TRMB_BACSU раскрашеная по схеме Рис. 3 аминокислоты участвующие в свяывниии с центральным лигандом(отмечаный зеленым цветом) отмечаны синим.

На Рис. 6 и 5 показаны структуры белка TRNB_BACSU в участках связывания с лигандом. GLY 46 - является консервативным участком связывания с лигандом и наблюдается у всех гомолого TRMB_BACSU; ASN 115 недерко меняется на PHE и реже на HIS. C центральными аминокислотами дела обстоят еще сложнее: консеравтивных позиций не выявленно. Подозрение в этой части на отсудсвтие лиганда можно и отбросить т.к. на многих участках прослеживается на сохранение пары [незаряженая]-[отрицательно заряженная] аминокислота.