Особенности мембранных белков
Для трех трансмембранных бета-баррелей и трех трансмембранных альфа-спиральных белков была найдена определеная информация, отраженная в таблице 1:
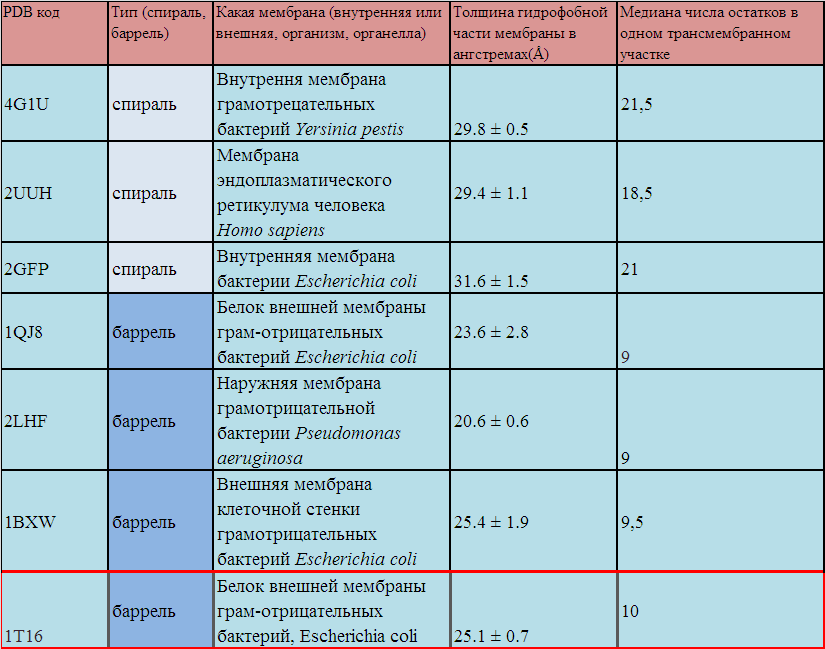
Таблица 1 Описание трансмембранных бета-баррелей и альфа-спиральных в различных организмах. (красным цветом отмечана дополнительная структура)
Из полученный таблицы очень сложно сделать глобальных выводов, но все же стоит заметить, что рамер гидрофобной части баррели у Escherichia coli варирует в +-0.5 аминокислотных остатков. К тому же белки внутренней мембраны(в нашем случае это спирали) имеют большую гидрофобную часть, чем белки внешней мембраны (баррели).
Отбор гомологов белка TatC
По белку TatC(PDB структура: 4B4A), для цепи А, был происведен поиск гомологов белка с целью создания репрезентативной выборки. Сам белок находяится на внутреней мембране бактерии Aquifex aeolicus. Поиск проводился по базе данных RefSeq, с e-value = 1e-5, максимальное число хитов = 1000, матрицей замен BLOSUM62. Поиск проводился сначало по Bactaria, потом по Eucariota. Полученная репрезентативная выборка находится здесь.
Анализ структуры белка TatC
В ходе работы была полученна следующая информация(см. Таблица 2):
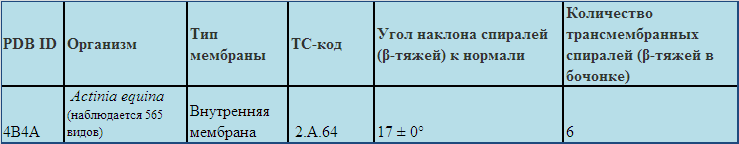
Таблица 2 .Описание структуры трансмембранного белка TatC(идентификатор PDB 4B4A, цепь A)
Этот белок является частью комплекса TatABCE( Twin Arginine Targeting ABCE). Комплекс взаимодействует с полностью сложенными окислительно-восстановительныvb белками, которые имеют N-концевой S/TRRXFLK "аргинина подобный" лидерный мотив (Sargent et al., 2001). Было показано, что TatC служит специфичной детерминантой в секреции белков, через систему Tat и является одним изе кто распознает "аргинина подобный" мотив( Jongbloed et al., 2000). Белок входит в состав внутренней мембраны грамотрицательных бактерий, грамположительных бактерий, входят в состав мембраны митоходрий и хлоропласт растений. Полная информация находится здесь
.Согласно OPM мой белок имеет TC: 2.A.64. Это означает, что белок:
2. - вторичные посредники операторного типа
2.A. - антипортеры, не связанные с прямыми формами энергии, кроме хемиосмотической
2.А.64 - семейство белков Twin Arginine Targeting (Tat)
Анализ множественного выравнивания трансмембранных белков
На основе полученной ранее репрезентативной выборки, было посроено пораммой Muscle, сиквенсное множественное выравнивание белков. Выравнивание в формате jar находится здесь. К выравниванию были добавлены аннотации TM_REAL и TM_PREDICTED. TM_REAL содержит указания на участки выравнивания отвечающие трансмембранным спиралям в белке со структурой 4B4A, которая была прикреплена к последовательности белка NP_213869.1|Aquifex_aeolicus в программе JalView. Они отмечаны буквой "M". TM_PREDICTED обозначает предсказанные с помощью TMHMM участки трансмембранных спиралей в гомологе Sec-independent translocase component C YP_063631.1|Gracilaria_tenuistipitata. Для выравнивания была выбрана цветовая схема "Hydrophobicity" позволяющая визуально различать гидрофобные и гидрофильные остатки (гидрофобные остатки выделены красным цветом), причем интенсивность цвета зависит от того, насколько позиция консервативна (порог - 30%). На вторичной структуре TatC, были отмечаны альфа-спиралей по той же цветовой схеме что и в выравнивании.
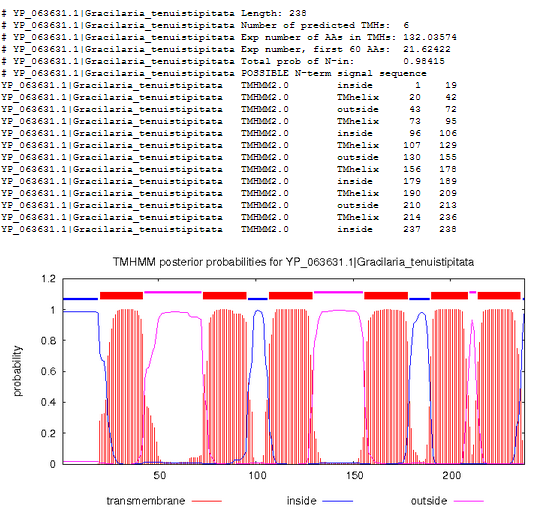
Изображение 1 . Предсказание из TMHMM для гомолога YP_063631.1
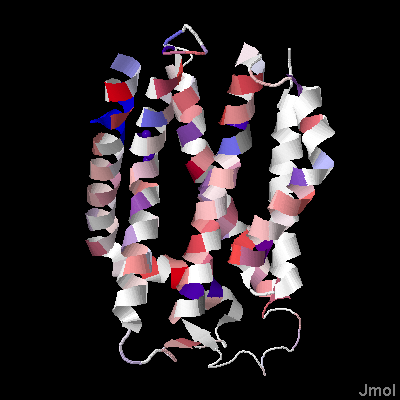
Изображение 2. Белок TatC. Часть белка, ориентированная в n-сторону мембраны, расположена вверху. Была выбрана цветовая схема "Hydrophobicity".

Изображение 3. Множественное выравнивание гомологов в программе JalView. Была выбрана цветовая схема "Hydrophobicity".
Большинство участков, встречающихся в альфа-спиралях, консервативны, но встречаются и неконсервативные фрагменты. Стоит отметить, что есть целая альфа-спираль которая не попала в консервативную область. Часто в альфа-спирялях встречаются остатки гидрофобных аминокислот - лейцина, изолейцина, валина, аланина, фениалаланина, метионина, глицина и пролина (консервативны). Достаточно большое количесво консервативного пролина. возможно он помагает держать структру в мембране, хотя обычно такие аминокислоты встречаются на концах вторичных элементов.
Предсказаные информация о структурах, частично совпадает. Это возможно обусловленно тем, что стуктуры имеют меньшее число аминокислотных остатков в спирале + структуры являются сиквенсными гомологома, а не структурными. Из этого можно заключить, что программа работает весьма точно, для определения примерного расположения элементо вторичный структуры в гомологе.
Остается, вопрос ли о значимости целой альфаспирали для каждого гомолога. Вель, различия в составе аминокислот могу отвечать и за специфичность к соседним белкам, и за специфичность к мембране, и за чпецифичность к другим веществам, котрые взаиможействуют с этим участком.