ЯМР расшифовки структуры
Выбор структуры

Была выбрана ЯМР модель 1N7T. Это белок Erbin (ERBB2IP, Erbb2 interacting protein), относящийся к PDZ домену, регулирует функцию и локализацию ERBB2. Струкутры относящиеся к этому домену имеют от 80-90 аминоксилот в полипептидной цепи. Домен объединяет ряд белков: почтовые белки постсинаптического полости(post synaptic density protein (PSD95)), супресоры больших дрозофильных дисков(Drosophila disc large tumor suppressor (Dlg1)), и блокаторы малой зоны(Zonula occludens (ZO)-1).

Рисунок 1.1Представление модели 1N7T. Синим выделена цепь А, ораньжевым цепь B
Все 20 структур модели 1N7T имеюют явное расскождение в положении концевых участков белка. Вторичные элементы в целом расположен одинаково на всех структурах(Рис. 1.2)
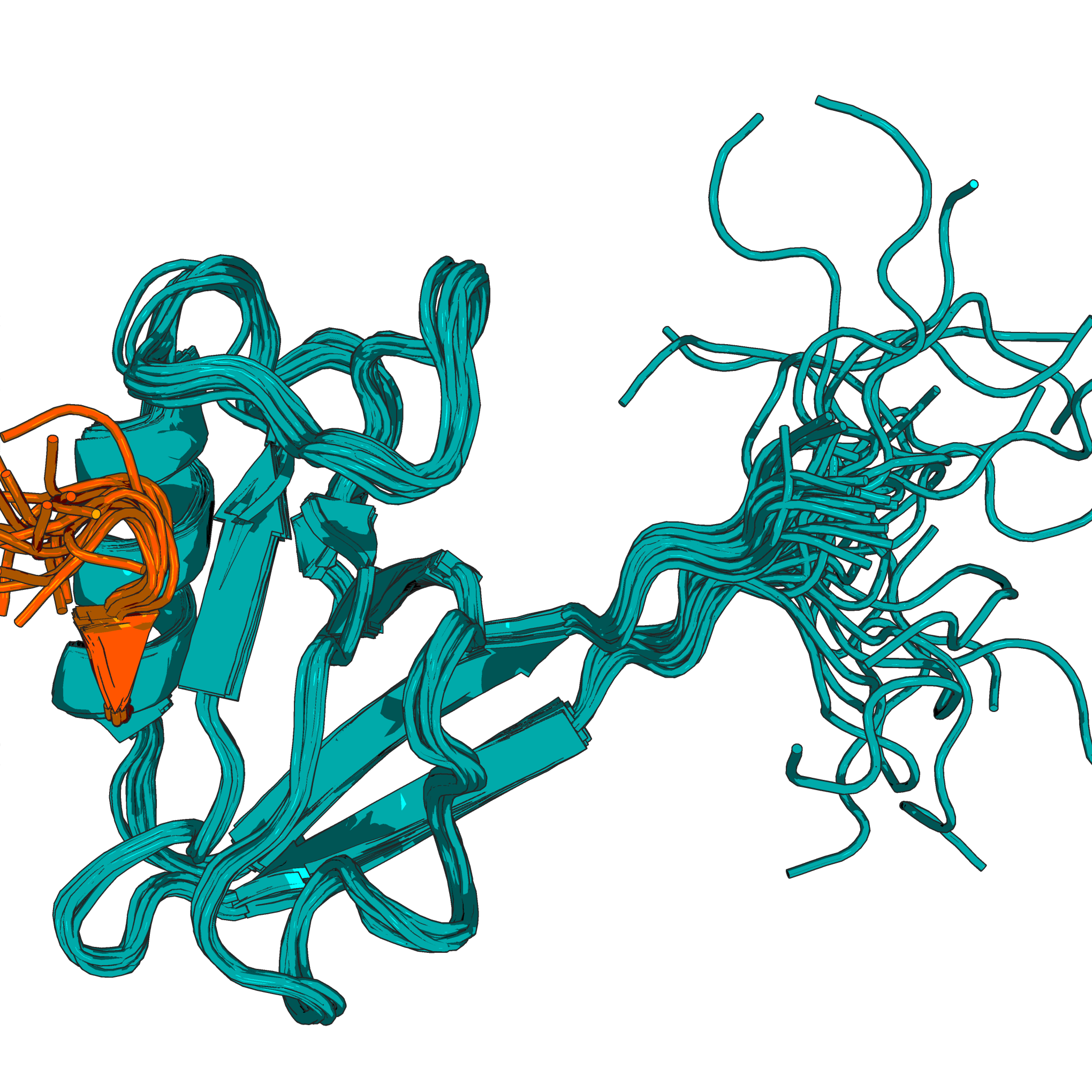
Рисунок 1.2Представление всех структур входящих в состав модели 1N7T. Синим выделена цепь А, ораньжевым цепь B. Стоит отметить, что концевые элементы белков при использовании ЯМР в качестве метода анализа положения структурных элементо, сильно отличаются у всех 20.
Белок имеет так же модель сделаную с помощью РСА - 2H3L. Если счтитать показания РСА более правильными и достоверными, то имеет смысл провести наложение одной структуры на другую.
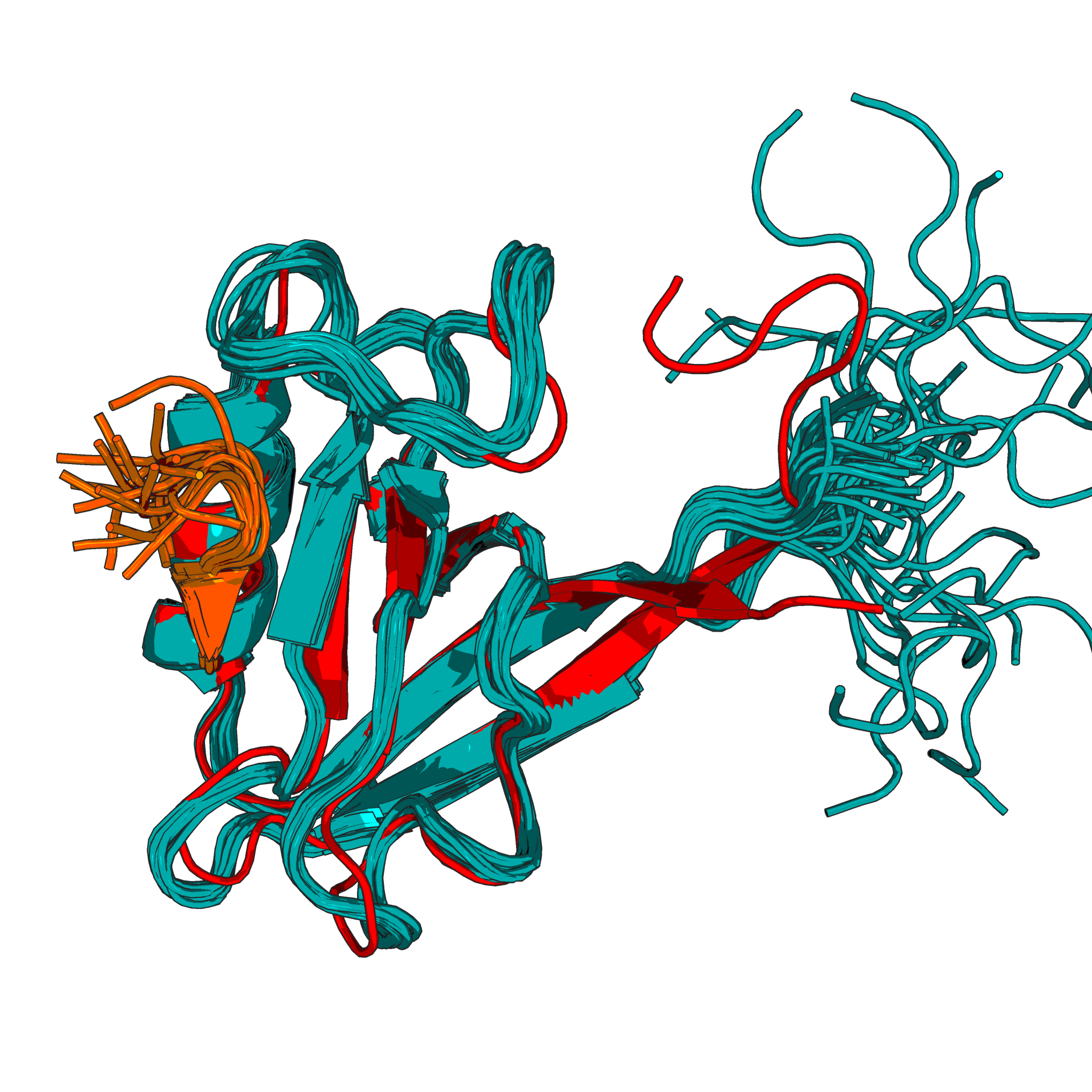
Рисунок 1.3Наложение ЯМР стурктуры 1N7T(синяя) со структурой РСА 2H3L(красная). Положение многих сторичных элементов структуры совпадает. Укладка структур 1N7T и 2H3L идентична. Различия наблюдаются в наличии лишь в положении петлей и концевых участков белка.
Водородные связи могу образовываться, как правило между двумя аминокислотыми, одна из которых будет являться донором протона, друга акцептором. Примером такого взаимодействия возникновение водородной связи между положительнозаряженой аминокислотой и отрицательнозаряженой: глутаматом/аспарагином и аргинином/лизином.
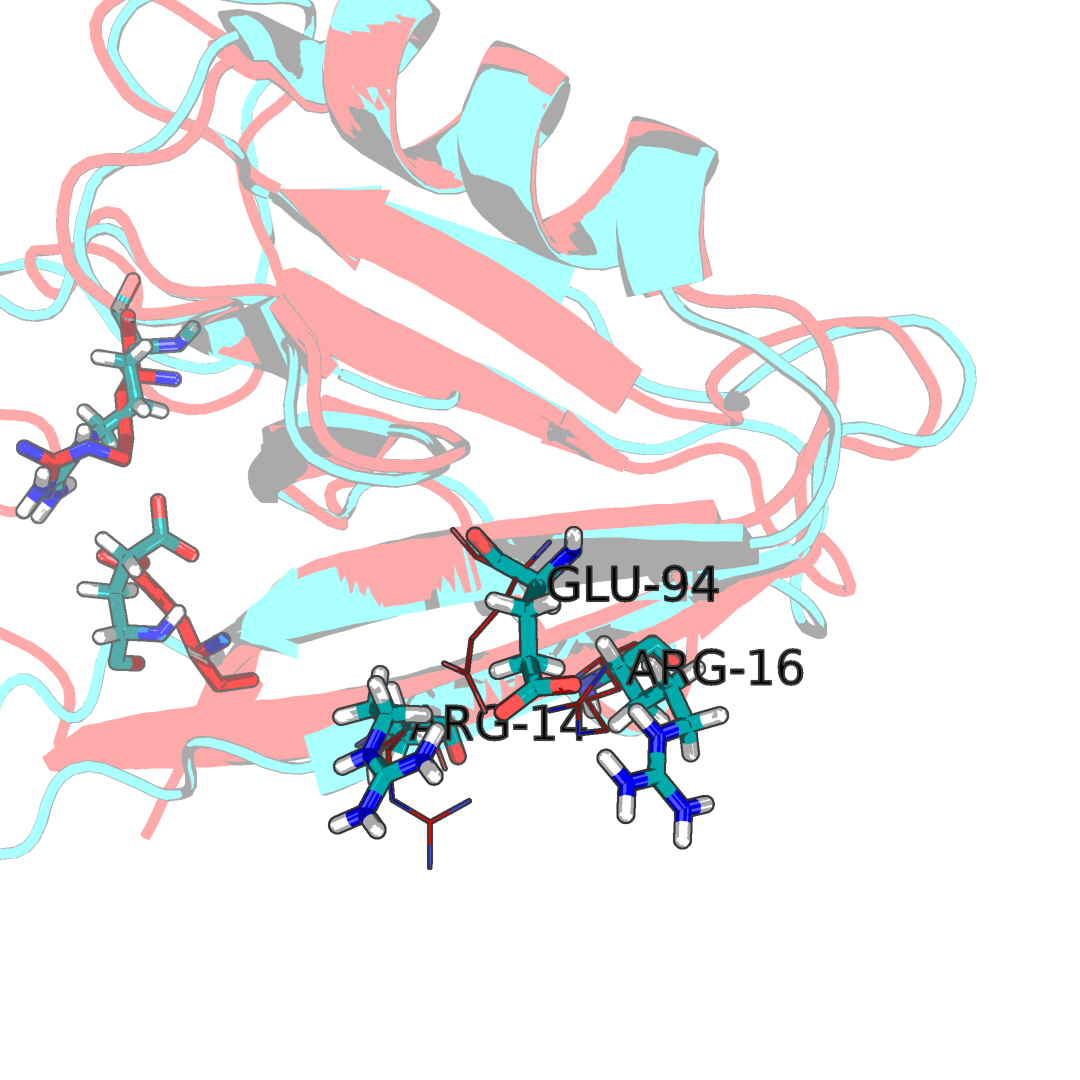
Рисунок 2.1Водородные связи в структуре. Наложение ЯМР стурктуры 1N7T(синяя) со структурой РСА 2H3L(красная). Как видно большенство аминокислот имеют схожее положении что в РСА, что в ЯМР структуре под номером 6.
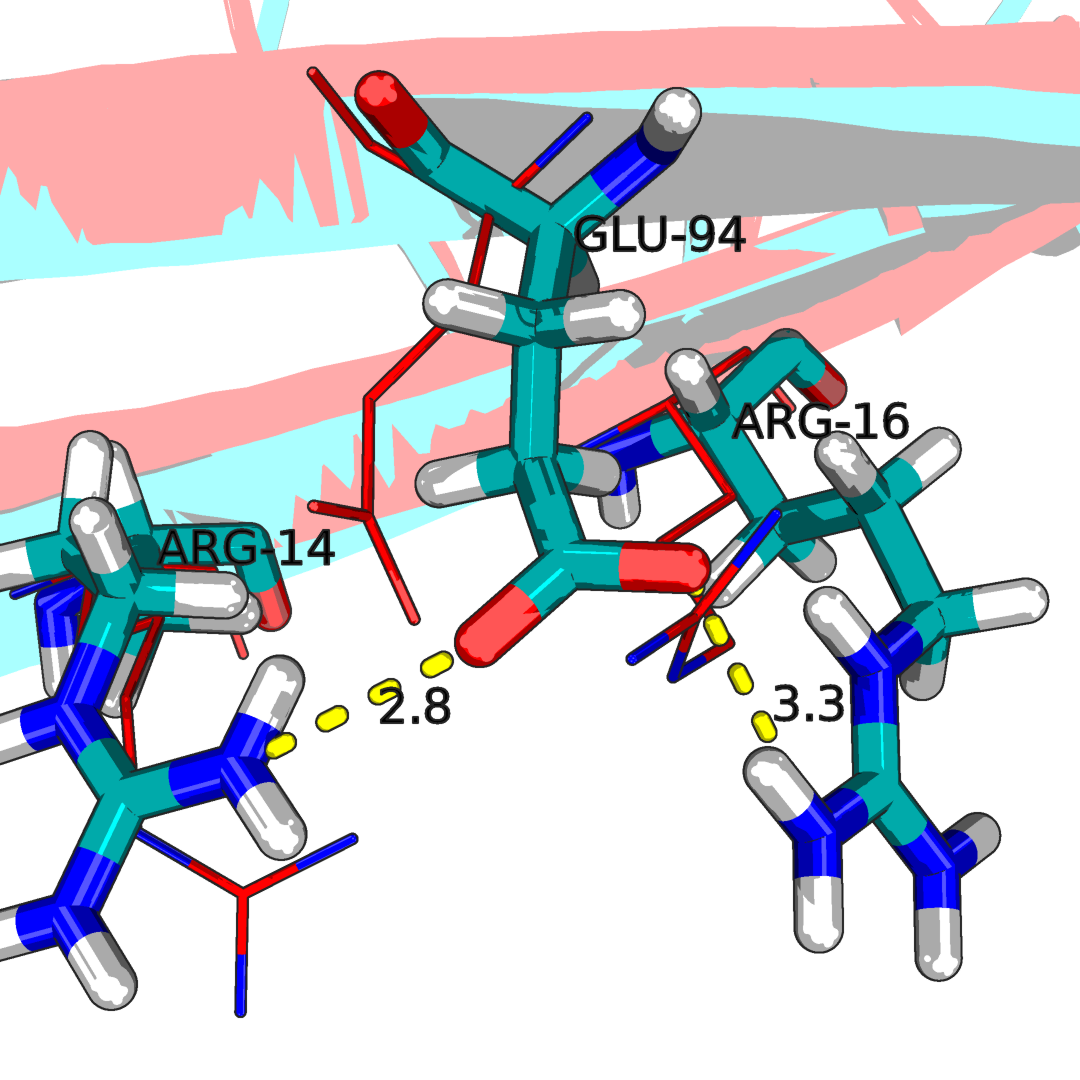
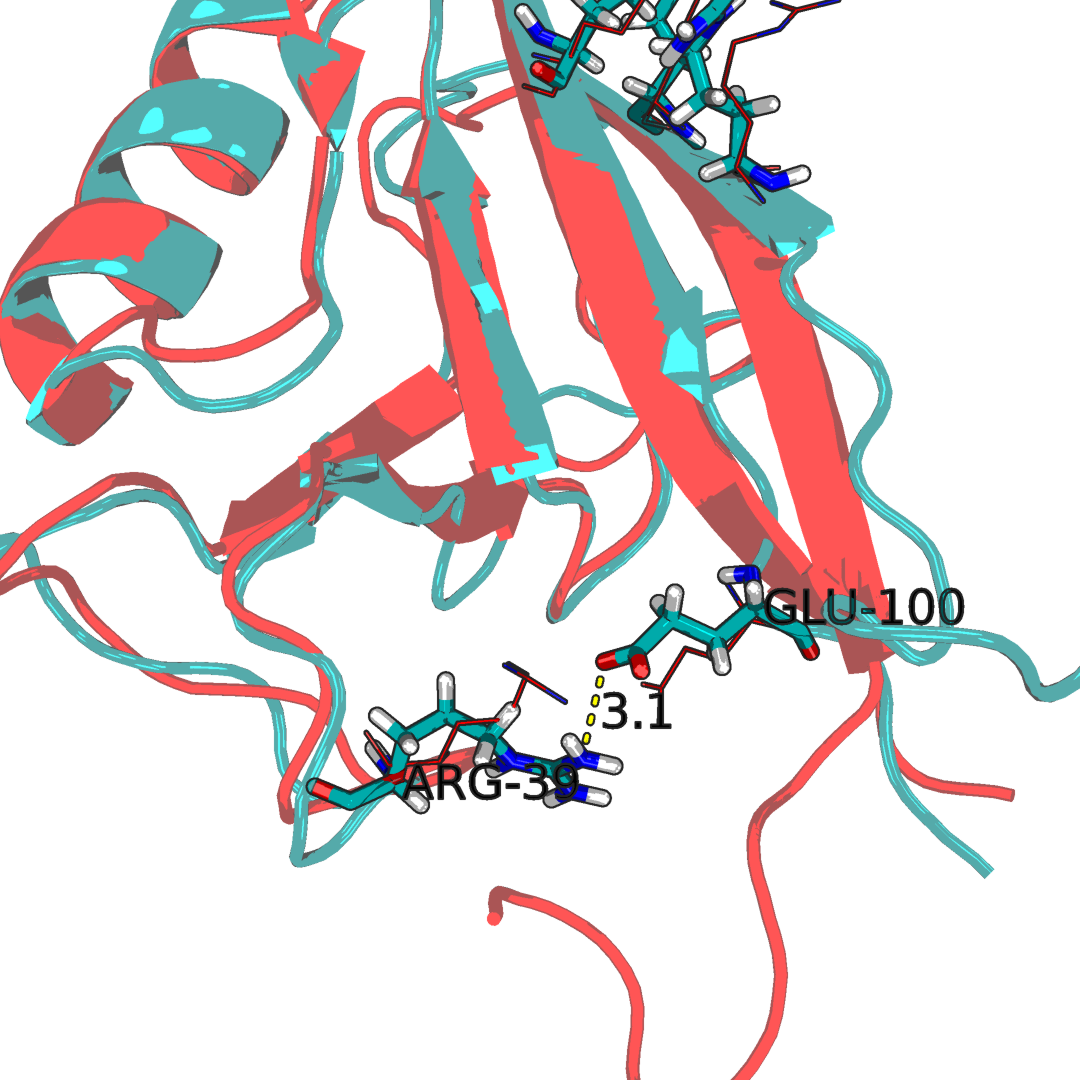
Рисунок 2.2Водородные связи в структуре на поверхности и между петлями. Наложение ЯМР стурктуры 1N7T(синяя) со структурой РСА 2H3L(красная). С права образование водородных связей между двумя бэта-тяжами, с лева оброзования водородной связи между двумя петлями. Можно отетить, что эти аминокислоты значимы для образования топологии белка.
Как видно структура NMR и X-ray имеют одинаковый аминокислотный состав в этой области а так же, положение аминокислот в этой струкуре модели(номер 6(из 20 имеющихся в файле)) схожи с положением аминокслот при X-ray. (6.8 и 8.8, 7.0 и 7.5, 6.6 и 8.1, 2.8 и 8.0, 7.0 и 7.7, 2.8 и 3.3, 7.7 и 7.0 5.8 и 8.5,8.6 и 8.0, 9.0 и 8.6, 7.4 и 7.9, 5.4 и 5.7, 6.2 и 6.2, 4.2 и 7.1, 5.5 и 6.2 5.8 и 4.5, 4.8 и 6.9, 6.3 и 8.9, 5.6 и 6.4, 5.5 и 7.2). В структре сделанной РСА, расстояние до атома кислорода 2.9 и 2.8 соответсвенно(до дальнего кислорода 4.7 и 4.6), что свиетельствует о наличии водородной связи. Плохо, ЯМР, плохо.
C водородными связями представленными для модели структуры под номером 7. Очевидно, что она должна быть и данные с РСА нас в этом убеждают.(Растоянии для X-ray 3.0. Длина связи: : 8.2, 7.0, 5.4, 6.4, 5.1, 4.1, 3.1, 4.8, 6.2, 6.5, 3.7, 12.7, 7.0, 4.1, 8.0, 5.4, 5.8, 6.5, 8.2, 7.8). И не смотря на то, что положение аминокислот очень схоже, наблюдать водородные связи в большенстве моделй 1N7T неприходится. Опять плохо.
Водородные связи могут так же образовываться в элементах вторичной струкутры: остовы альфа спиралей и бета-листов.
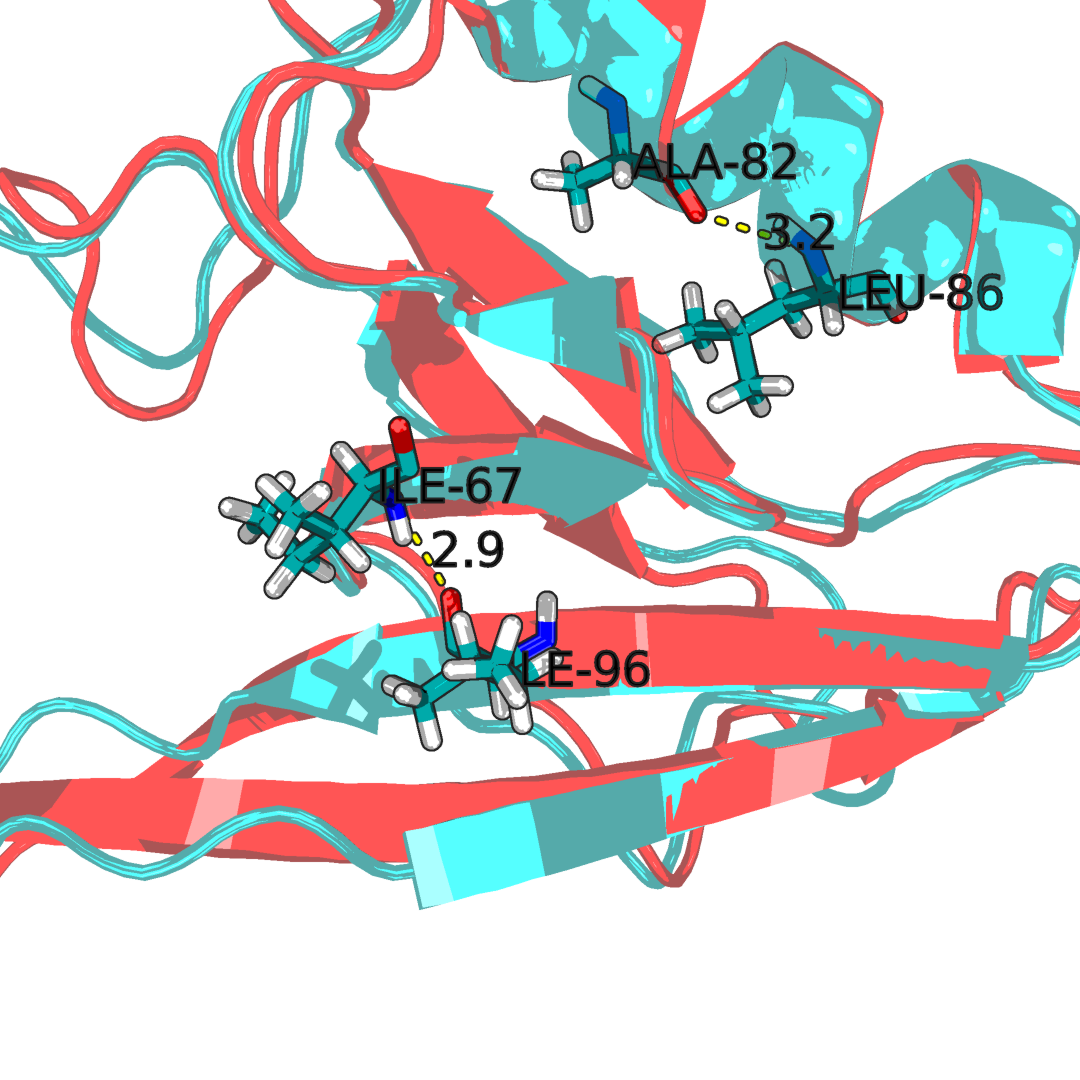
Рисунок 2.3Водородные связи в структуре образованую остовами аминокислот. Наложение ЯМР стурктуры 1N7T(синяя) со структурой РСА 2H3L(красная). Как видно большенство аминокислот имеют схожее положении что в РСА, что в ЯМР структуре под номером 7.
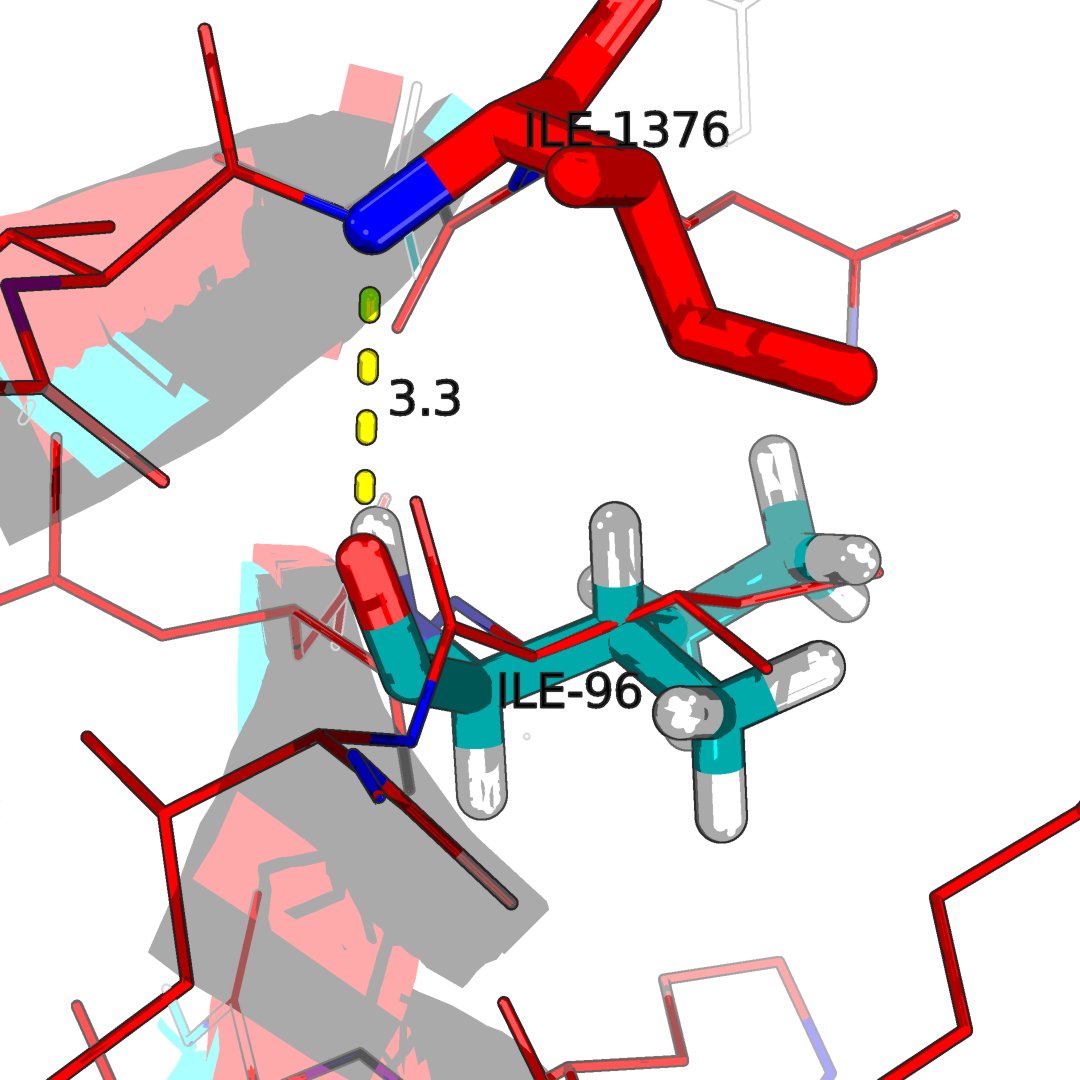
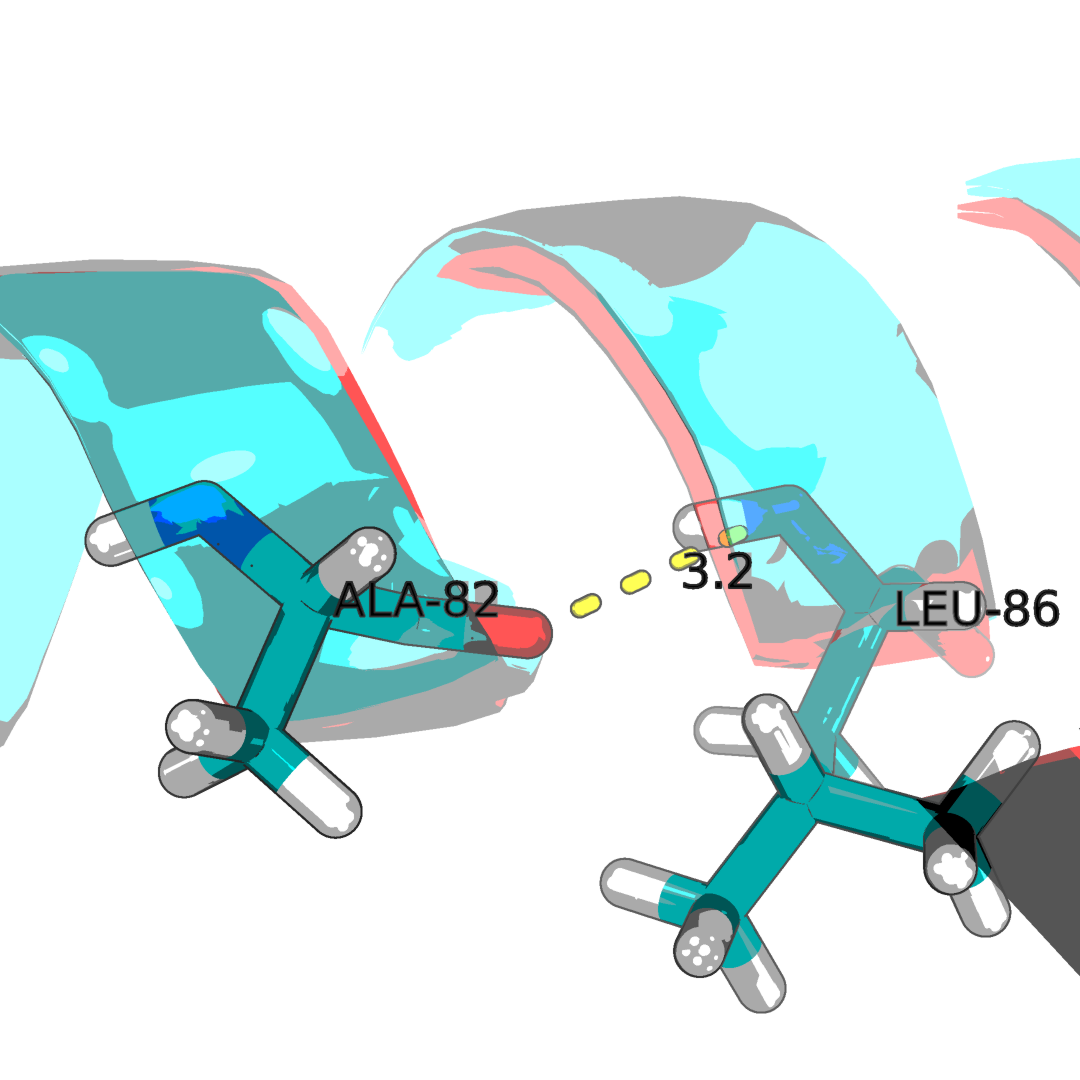
Рисунок 2.4Водородные связи в структуре. Наложение ЯМР стурктуры 1N7T(синяя) со структурой РСА 2H3L(красная). С права образование водородных связей между двумя оставами бэта-тяжамей, с лева в составе альфа-спиралей.
Для остово были полученны следующие результаты длинны связи: альфа(X-ray: 2.7): 3.1, 3.3, 3.2, 3.2, 3.2, 3.3, 3.1, 3.3, 3.2, 3.3, 3.2, 3.1, 3.2, 3.1, 3.3, 3.2, 3.2, 3.1, 3.0, 3.2; бета(X-ray: 2.6): 3.3, 2.9, 2.9, 2.7, 2.7, 3.1, 3.2, 3.3, 2.8, 3.1, 2.8, 2.9, 3.2, 2.9, 3.3, 2.7, 3.1, 3.0, 2.9, 2.9.
Найти водородные связи внутри структуры не удалось.
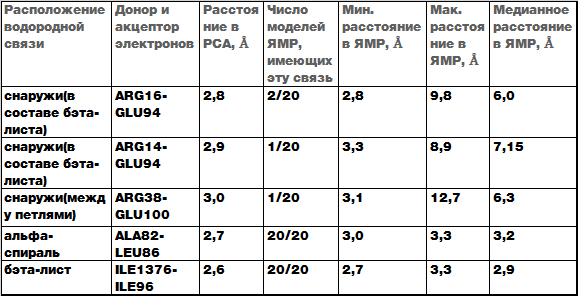
Таблица 1Сводная таблица анализа водородных связей.
На основе полученных данных можно сделать вывод, что водородные связи во вторичных структурах(между остовами альфа-спиралей и бэта-листов) моделей сделаных ЯМР стабильны. Что касается водородных связей образованных в других участках структуры, то они гораздо более лабильны, поэтому присутствуют далеко не во всех моделях ЯМР. Это связано с большой подвижностью боковых радикалов в растворе. Стоит также отметить, что общая топология структуры сохраняется, при наложении могут не совпадать только концевые участки структур.
Примерно именно такой же вывод делают авторы одной статьи 2010 года Kresimir Sikic, Sanja Tomic and Oliviero Carugo. Они таже отмечают, что бэта-тяжи более стабильны в растворе, чем альфа-спирали. Из недостатков метода, они находят случаи, когда при очень хорошем с овпадении остова боковые радикалы в ряде случаев различаются по направлениям