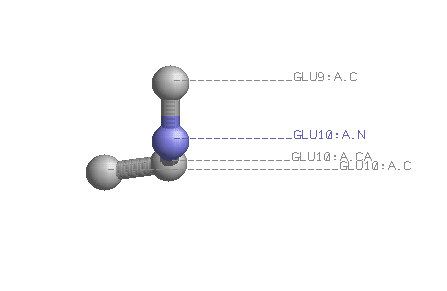

|
Название
двугранного угла |
Угол определяется по координатам атомов
(обращение к атому в соответствие с синтаксисом RasMol, в скобках – название атома) |
Данный угол описывает поворот вокруг связи |
Результат измерения
с помощью RasMol |
| φ |
|
N10 - Cα10 | -89,03° |
| ψ |
|
Cα10 - C10 | -28,46° |
| ω |
|
C10 - N11 | -173,25° |

Карта Рамачандрана позволяет с высокой степенью точности определить вторичную структуру белка. С помощью карты можно установить, какие торсионные углы характерны для α-спиралей и для β-листов, для различных аминокислотных остатков
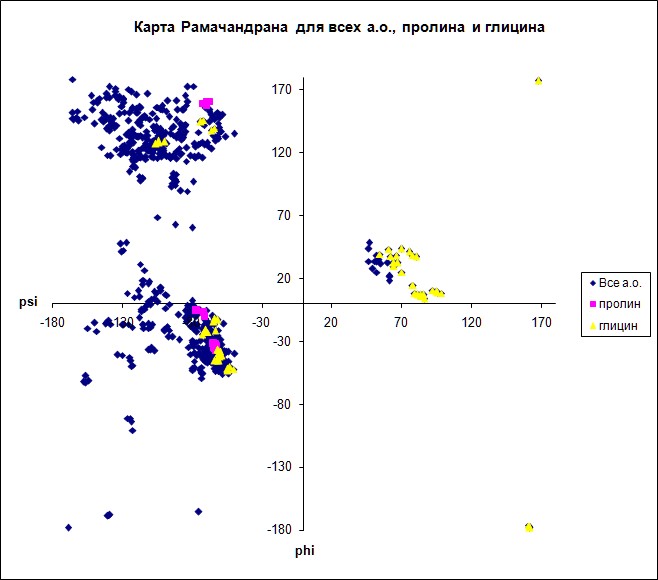 |
Карта Рамачандрана для всех аминокислотных остатков XPT_BACSU,
остатков пролина и глицина.
Значения торсионных углов остатков глицина разнообразны. Это обусловленно строением молекулы: отсутствием громоздкой боковой группы, что облегчает вращение вокруг связей. Значения торсионных углов остатков пролина лежат в довольно узком диапазоне: угол фи принимает только отрицательные значения, а угол пси принимает значения примерно 160 и от -30 до 0. Такое ограничение обусловлено строением молекулы: наличием цикла, включающего в себя α-углерод и азот иминогруппы, затрудняющего вращение вокруг связей |
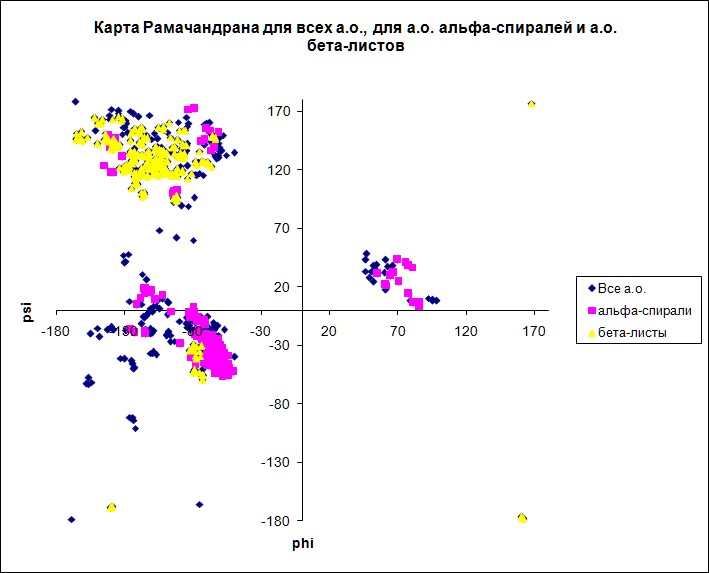 |
Карта Рамачандрана для аминокислотных остатков α-спиралей и для β-листов.
Большинство значений торсионных углов в α-спиралях почти одинаковы и приблизительно равны (большинство по φ от -150 до -50, по ψ от -60 до 20 и от 110 до 170 (концы спирали); по φ от 60 до 80, по ψ от 0 до 30 (концы спирали)) . Это обусловленно тем, что остов белка в данных участках имеет укладку α-спирали. В β-листах значения торсионных углов также принадлежат ограниченному дапазону (большинство по φ от -160 до -70, по ψ от 110 до 170) |