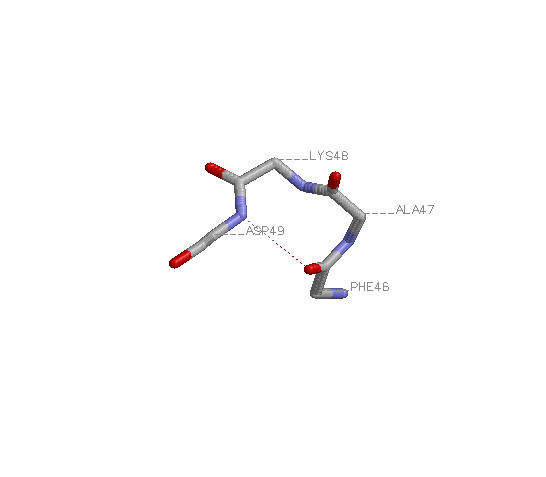
| 2) Свойства α-спирали |
| |
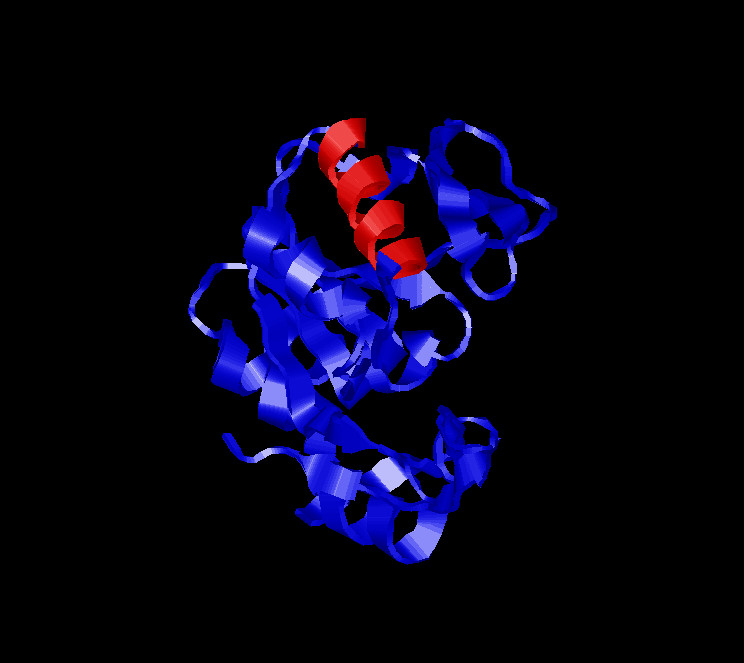 |
На изображении представлены в ленточной модели вся цепь A и красным цветом выделена α-спираль, в состав которой входят аминокислотные остатки с 131 по 142 |
| |
 |
На изображении представлена α-спираль (131-142а.о.) |
| |
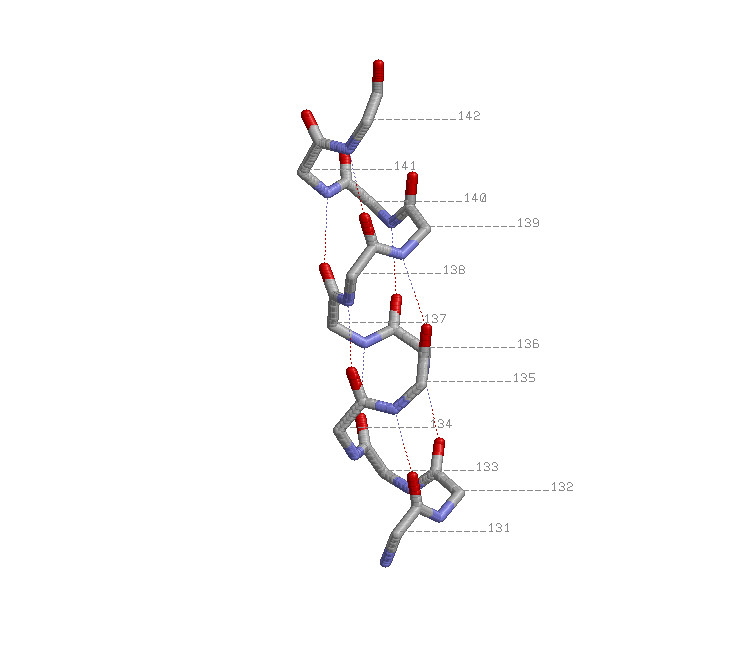 |
Остов α-спирали (131-142а.о.) представлен в проволочной модели
с раскраской по атомам, около каждого Сα атома указан номер
аминокислотного остатка, водородные связи показаны пунктирными линиями.
Паттерн водородных свзей:
H(m,m+4), где m -номер аминкоислотного остатака которому принадлежит атом
кислорода, а m+4 - номер аминокислотного остатка, которому принадлежит атом
азота - формула, задающая номера аминокислотных остатков, участвующих в
образовании водородных связей.
Для данной α-спирали имеем: H(131+n,135+n), n=[0;20] (где 131+n задает номер аминокислотного остатка,
которому принадлежит атом кислорода, а 135+n - номер аинокислотного остатка,
которому принадлежит атом азота.
|
| |
 |
Остов α-спирали (131-142 а.о.) представлен в проволочной модели
с раскраской по атомам,но с меньшим размером проволочек, чем на
предыдущем изображении, около каждого Сα атома указан номер
аминокислотного остатка, водородные связи показаны пунктиром, атомы
Сβ представлены в шариковой модели (шарики красного цвета) и
соединенны тонкими линиями с Сα.
Расположение Сβ атомов:
Все Сβ расположены снаружи от цилиндра, образованного остовом
аминокислотных остатков, причем все атомы Сβ направлены
в сторону N-конца α-спирали |
| 4) Свойства β-тяжа |
Параллельный β-тяж |
 |
три соседние параллельные β-тяжи
(слева направо - №1, №2, №3)
|
|
номера аминокислотных остатков
|
|
β-тяж №1
|
Val172-Ser180
|
|
β-тяж №2
|
Ser146-Lys156
|
|
β-тяж №3
|
His119-Leu127
|
|
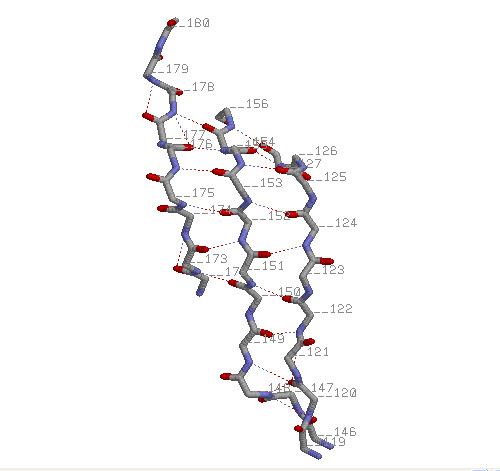 |
Остовы трех β-тяжей (119-127, 146-159, 172-180 а.о.) представлены в проволочной
модели с раскраской по атомам, около каждого Сα атома указан
номер аминокислотного остатка, водородные связи представлены пунктирными линиями.
|
 |
Остов трех β-тяжей (61-65, 91-94, 119-122а.о.) представлен
в проволочной модели
с раскраской по атомам,но с меньшим размером проволочек, чем на
предыдущем изображении, около каждого Сα атома указан номер
аминокислотного остатка, водородные связи обозначены белым цветом, атомы
Сβ представлены в шариковой модели (шарики красного цвета) и
соединенны тонкими линиями с Сα.
Расположение Сβ атомов:
Атомы Сβ в каждом из β-тяжей расположены в соответствии
со следующей закономерностью: если для аминокислотного остатка номера n
Сβ атом уходит за плоскость β-листа, то для аминокислотного
остатка номера n+1 Сβ атом выходит из плоскости β-листа, а
соседние атомы Сβ разных β-тяжей расположены по одну
сторону от плоскости β-листа.
|
Антипараллельный β-тяж |
 |
два соседних антипараллельных β-тяжа
(слева направо - №1, №2)
|
|
номера аминокислотных остатков
|
|
β-тяж №1
|
Leu91-Ser98
|
|
β-тяж №2
|
Thr103-Ser110
|
|
 |
Остовы 2 β-тяжей (91-98, 103-110а.о.) представлены в проволочной
модели с раскраской по атомам, около каждого Сα атома указан
номер аминокислотного остатка, водородные связи представлены пунктирными линиями |
 |
Остовы 2 β-тяжей (91-98, 103-110а.о.) представлен
в проволочной модели
с раскраской по атомам,но с меньшим размером проволочек, чем на
предыдущем изображении, около каждого Сα атома указан номер
аминокислотного остатка, водородные связи обозначены пунктирными линиями, атомы
Сβ представлены в шариковой модели (шарики красного цвета) и
соединенны тонкими линиями с Сα.
Расположение Сβ атомов:
Атомы Сβ в каждом из β-тяжей расположены в соответствии
со следующей закономерностью: если для аминокислотного остатка номера n
Сβ атом уходит за плоскость β-листа, то для аминокислотного
остатка номера n+1 атом Сβ данного остатка выходит из плоскости
β-листа, а
соседние атомы Сβ разных β-тяжей расположены по одну
сторону от плоскости β-листа. |