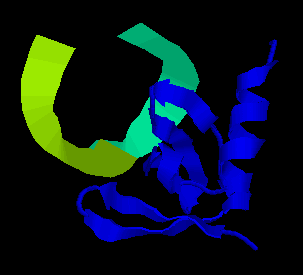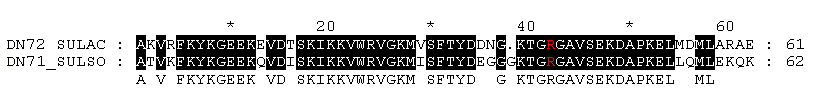Исследование белок-нуклеиновых контактов
|
1.
Получение
файлов со структурами
Нужный файл PDB c ID
1AZP был получен на сайте сайта
PDB, а биологическую единицу комплекса — с сайта Macromolecular Structure Database EBI. В результате обе структуры оказались совершенно
одинаковыми. Так они вылядят: Можно увидеть, что структура не симметрична,
это и является причиной того, что биологическая единица оказалась идентична структуре,
содержащейся в PDB-файле. 2.
Исследование
контактов между молекулами белка и нуклеиновой кислоты
Таблица. Контакты разного типа в комплексе
1AZP
Из таблицы видно, что самое большое количество
контактов как полярных, так и гидрофобных белка с остатками 2'-дезоксирибозы.
Это объясняется тем, что молекула ДНК не устойчива, и эти контакты несут функции поддерживания остова молекулы. Так же много
контактов белка с остатками фосфорной кислоты. Они так же несут
функции поддерживания структуры ДНК. Странно, что полярных контактов
белка остатками азотистых оснований со стороны малой бороздки и неполярных со
стороны малой бороздки совсем нет. Возможно, отсутствие контактов со стороны
малой бороздки обусловлено тем, что малая бороздка достаточно узка (в исследуемом pdb-файле ДНК находится в В-форме) для полярных
контактов. Большая бороздка в свою очередь достаточно широка, чтобы могли
быть возможны неполярные контакты, а отсутсвие
полярных контактов, наверно, объясняется тем, что большая бороздка в свою
очередь глубже, чем малая, и это мешает образованию таких контактов. И эти
контакты белка с остатками азотистых оснований со стороны большой и малой
бороздки несут функции узнавания ДНК белком. Именно
среди этих контактов следует искать остатки связывания ДНК. Для получения данных использовался скрипт P:\y05\Term3\dna.def, определяющий
три нужных множества: Полярными атомами ДНК считались все атомы
кислорода и азота, а неполярными — все атомы углерода. 3.
Поиск
специфических контактов, обеспечивающих узнавание сайта в молекуле ДНК
Специфичными контактами узнавания ДНК белком являются
контакты белка с остатками азотистых оснований со стороны большой и малой
бороздки, так как таковых нет с остатками со стороны малой бороздки. Атомы белка, участвующих в контактах с
остатками азотистых оснований со стороны малой бороздки:
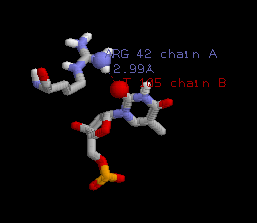
Подробнее был рассмотрен контакт между атомами
азота ARG42A.NH1 и T105B. Изображение данного контакта:
Азотистое основание и аминокислотный остаток подписаны. Более крупно выделены взаимодействующие атомы. 4.
Описание
функций исследованного белка
Описание белка комплекса из UniProt
Функции: Удерживает негативно сверхспирализированную ДНК; может быть вовлечен
в поддержание неприкосновенности генома при высоких температурах. Описание соответствующего ДНК-связывающего
домена в Pfam
Домен 7kD_DNA_binding находится в БД PfamA.
Описание домена из БД Pfam.
Описание из БД INTERPRO (запись IPR003212) полность идентично описанию из Pfam.
Изображение выравнивания домена
7kD_DNA_binding:
Консервативные на 100% участки покрашены
черным. Остаток, исследовавшийся в п. 3, выделен
красным на черном фоне. Этот остаток оказался консервативным на 100%, то есть
можно надеяться, что выбранный остаток участвует в специфическом
взаимодействии с молекулой ДНК. 5.
Построение
диаграммы контактов белка с ДНК
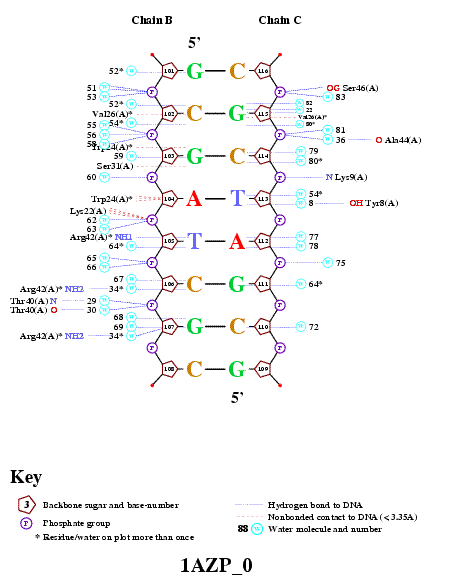
Использовалась программа nuclplot
командой nucplot 1AZP_0.pdb Полученная диаграмма В файле 1azp_0.bond, созданным
программой, были найдены следующие данные о взаимодействии атомов остатка ARG
42: Donor Acceptor DistanceARG A 42 NH1 T B 105 O2 2.99 Как видно, атомы NH1 ARG 42 и O2 T 105 образуют связь по
донорно-акцепторному механизму. То есть предположение, что атом NH1 ARG 42
участвует в специфическом связывании
ДНК, оказалось верным. |
На главную страницу третьего
семестра
© Кузеванов Алексей,2005