Таблица. Параметры водородных связей между остовными атомами во вторичной структуре
| № | Вторичная структура | Атом О | Атом N | Длина связи (A) | Угол связи C-O-N (°) |
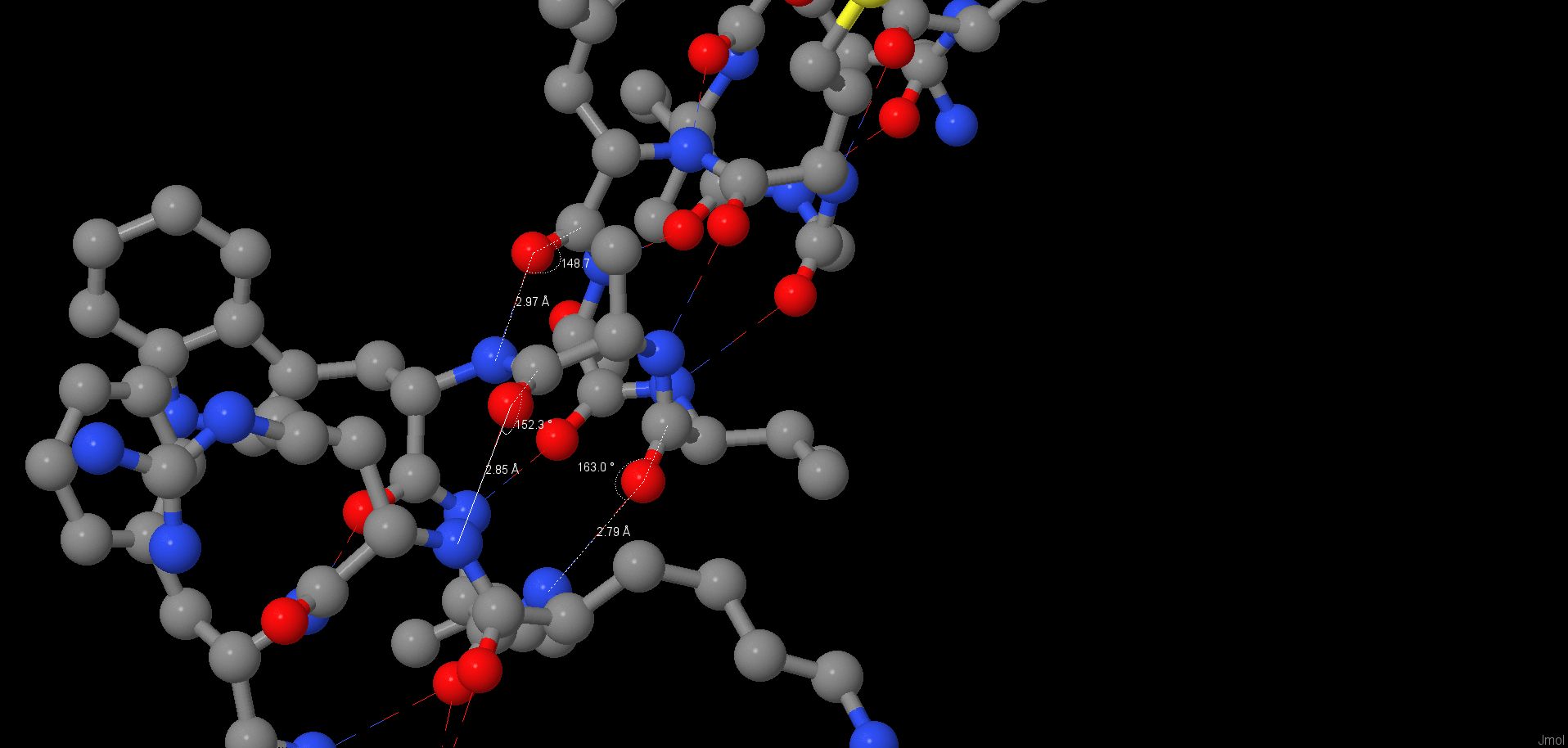
| 1 | Альфа-спираль | [TYR]260:A | [TRP]264:A | 2.97 | 148.7 |
| 2 | Альфа-спираль | [ALA]263:A | [ARG]267:A | 2.85 | 152.3 |
| 3 | Альфа-спираль | [VAL]262:A | [LYS]266:A | 2.79 | 163.0 |
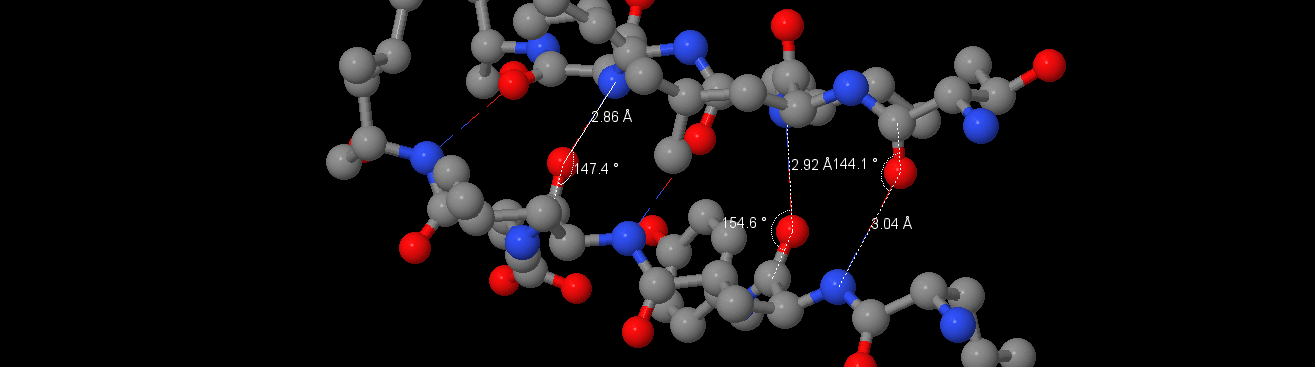
| 4 | Бета-тяж | [LEU]240:A | [GLY]211:A | 2.86 | 147.4 |
| 5 | Бета-тяж | [ALA]238:A | [ILE]209:A | 2.92 | 154.6 |
| 6 | Бета-тяж | [THR]207:A | [ALA]238:A | 3.04 | 144.1 |
Альфа-спираль с водородными связями
Бета-тяж с водородными связями