(2S,3S)-2-amino-3-methylpentanoic acid
 [1]
[1] [1]
[1]Общие сведения
Трехбуквенный код: Ile
Однобуквенный код: I
Кодоны в стандартном генетическом коде: AUU, AUC и AUA
Впервые выделил Ф. Эрлих из патоки в 1904 г. [1]
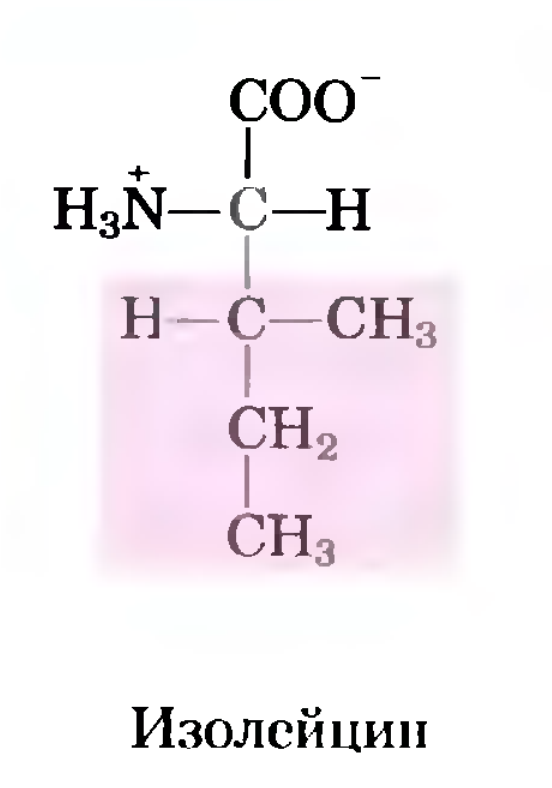
| Химическая формула [2] | |
 | |
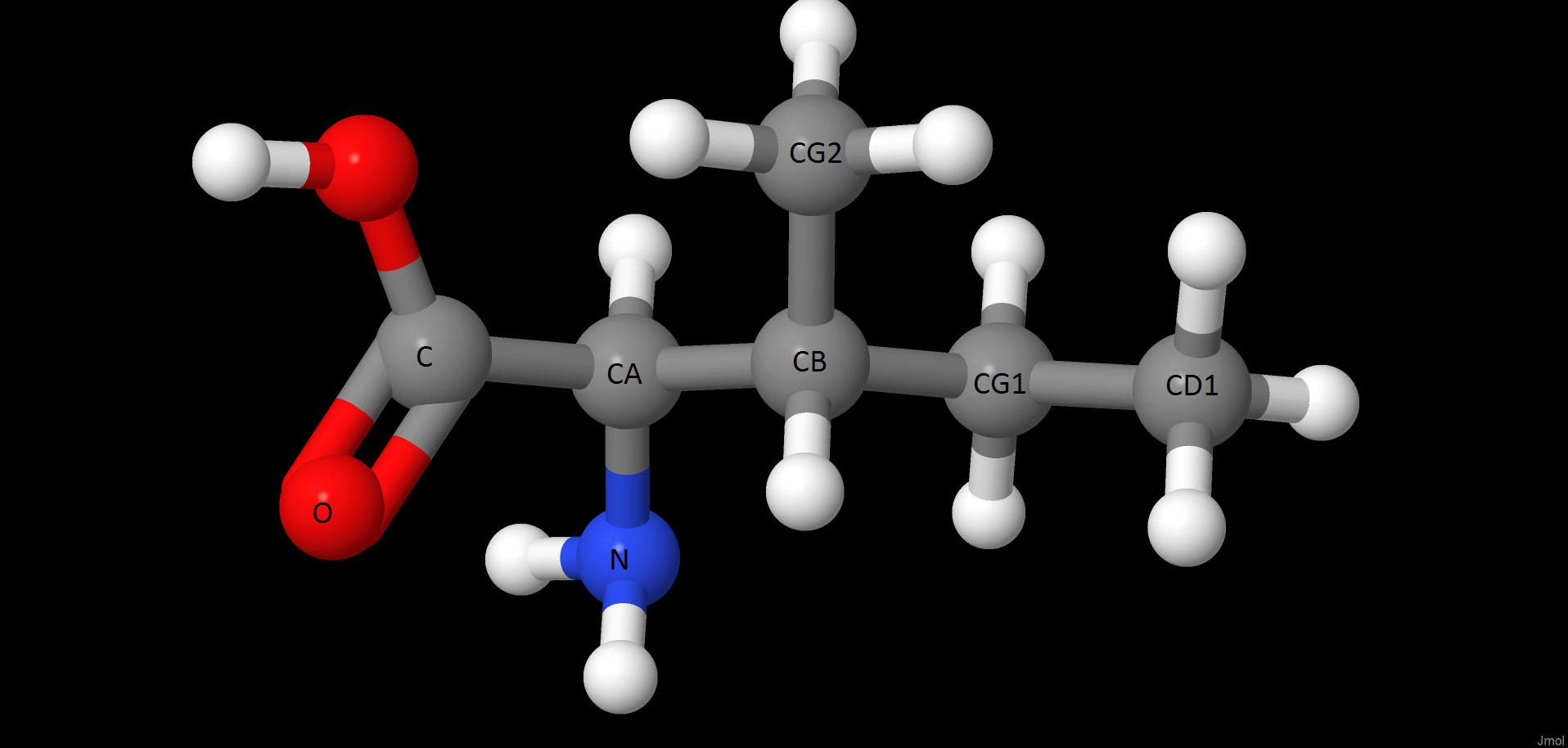
| Изображение в шариково-стержневой модели с подписанными именами тяжёлых атомов | |
 | |
| Шариково-стержневая модель изолейцина | |
| Физико-химические свойства | |
| Название по IUPAC: 2-амино-3-метилпентановая кислота (2S,3S)-2-amino-3-methylpentanoic acid | |
| Химическая формула: HO2CCH(NH2)CH(CH3)CH2CH3 | |
| Брутто-формула: C6H13O2N | |
| Молярная масса: 131,17292 г/моль[3] | |
 [1] [1] | |
 [1] [1] | |
| Атомы-доноры водородной связи - 2. Атомы-акцепторы водородной связи - 3.[3] | |
| Идентификатор в базе данных PubChem - 6306 | |
| Протонированная, депротонированная формы и цвиттер-ион изолейцина | |
| Взаимодействия с аминокислотами | |
| Поскольку изолейцин - незаряженная аминокислота, он не образует солевых мостиков. | |
| Взаимодействия с ДНК | |
| Изолейцин - неполярная аминокислота и потому не взаимодействует с ДНК, чей сахарофосфатный остов заряжен отрицательно (было проверено несколько ДНК-связывающих белков). | |
| Биохимические особенности | |
| Изолейцин - незаменимая аминокислота в организме человека. Минимальная суточная потребность индивидуума составляет 0,7 г. Более точно потребность можно определить из расчёта 10 мг/кг. Наиболее богаты изолейцином такие продукты, как пшеничная мука (4,2 % из расчёта на сухую массу), соевая мука (5,4 %), рыбная мука (4,6 %), говядина (6,0 %), коровье молоко (7,8%), кормовые дрожжи (5,5%). Белки с наиболее высоким содержание изолейцина: белок овса 4,3%, сывороточный альбумин быка 2,6% [1]. | |
| В отличие от большинства аминокислот, которые катаболизируются в печени, изолейцин (как и две другие разветвлённые аминокислоты - лейцин и валин) окисляются для получения эергии в основном в мозге, мышцах, почках и жировой ткани. Ключевой фермент катаболизма этих аминокислот - дегидрогеназный комплекс альфа-кетокислот, который осуществляет их окислительное декарбоксилирование с высвобождением карбоксильной группы в виде СО2 и образованием ацил-КоА производного [4]. | |
| Инактивирующие мутации, затрагивающие дегидрогеназный комплекс альфа-кетокислот, приводят к развитию редкого генетического расстройства - болезни кленового сиропа. При этом заболевании в моче в избытке накапливаются три разветвлённые альфа-кетокислоты, а также аминокислоты, превращающиеся в них в ходе катаболизма (например, лейцин). Они придают моче характерный запах, за что болезнь и получила своё название. В отсутствие лечения нарушается развитие мозга, развивается умственная отсталость и в раннем детстве наступает смерть [4]. | |
| В клетках бактерий изолейцин синтезируется из аспарагиновой кислоты [4]. | |
| Использованные источники | |
| Литература | |
| [1] Х.-Д. Якубке, Х. Ешкайт. Аминокислоты. Пептиды. Белки. - М.: "Мир", 1985. - с. 11, 14, 18, 19, 24, 33 | |
| [2] Нельсон Д., Кокс М. Основы биохимии Ленинджера в 3 т. Том 1: Основы биохимии. Строение и катализ - с.119. М.: "БИНОМ: Лаборатория знаний", 2012. ISBN 978-5-94774-366-1 | |
| [4] Нельсон Д., Кокс М. Основы биохимии Ленинджера в 3 т. Том 2: Биоэнергетика и метаболизм - с. 296-297, 524-525. М.: "БИНОМ: Лаборатория знаний", 2014. ISBN 978-5-94774-366-1 | |
| Онлайн-ресурсы | |
| [3]PubChem |
Страница находится в стадии разработки