Был выбран один из белков, для которого есть ЯМР и РСА структура с помощью списка белков, чья структура расшифрована разными методами (на сайте PDB).
Были взяты структуры человеческого транстиретина. PDB ID для X-ray структуры = 6GRP, разрешение 1.6 Å. В ней 2 цепи А и В, но в данном практикуме была рассмотрена только цепь А. PDB ID для NMR структуры = 2NBP. Количество моделей = 20. Это структура мономера, а не димера, поэтому в ней представлена только цепь А.
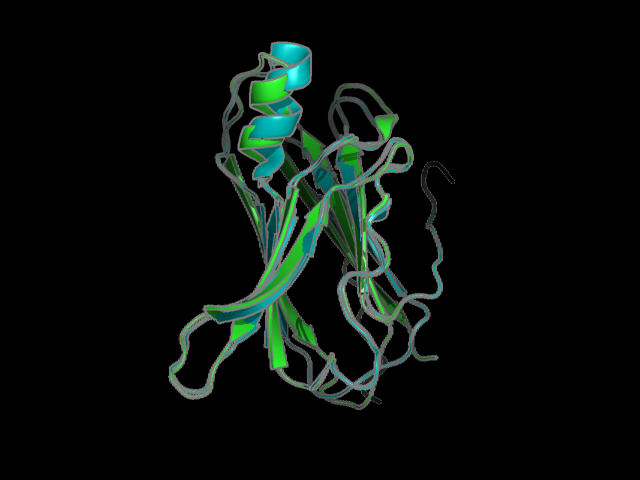
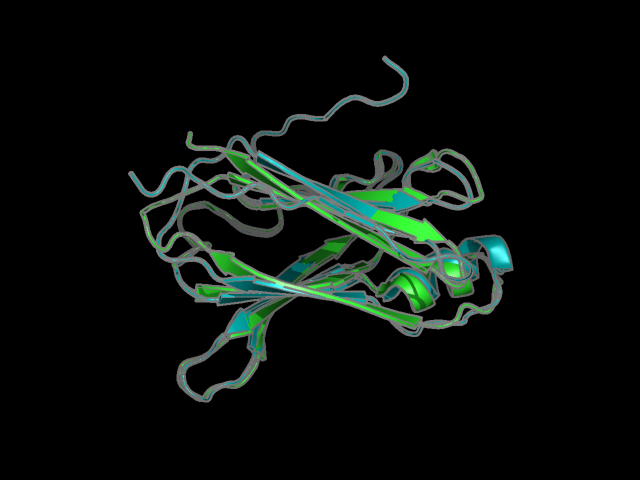
На рис. 1 представленно наложение РСА и ЯМР структуры, а на рис.2 показаны и все модели ЯМР.
|
|
|
Рис 1. Наложение структуры РСА (зеленым) и топ структуры ЯМР (синим) в разных ракурсах.
|
|
|
Рис 2. Наложение структуры РСА (зеленым) и всех структур ЯМР (синим) в разных ракурсах.
Были выбраны несколько водородных связей (порог по расстоянию 3.5 Å), информация по которым представлена в таблице 1, информация для ЯМР считалась по моделям, для которых данная связь была обнаружена. Первые 2 связи, это связи между атомами основной цепи одной пары аминокислотных остатков. Вторые две связи - это связи между атомами боковых цепей. Т.к. водородных связей между боковыми цепями было найдено мало, а в ядре белка не было найдено вовсе (ну, белок представляет собой бочку), то были взяты связи между боковыми цепями остатков бета листа (1) и бета и альфа спирали (2). (*две связи вместо одной в качестве наказания за то, то нет ядра). И последние две связи - это связи между боковыми цепи в остатках, находящихся на подвижных участках, петлях. (Их было взято две, потому что получилось, что лизин взаимодействует с глутаматом, а этот глутамат взаимодействует с гистидином, и получается забавная цепочка из трех остатков).
Таблица 1. Водородные связи
| № | Остатки | Описание | Длина связи РСА (Å) | Модели ЯМР, где есть связь | Min длина связи ЯМР (Å) | Max длина связи ЯМР (Å) | Median длина связи ЯМР (Å) |
| 1 | LYS70N---PHE33O | Связь между бета-листами в основной цепи | 2.8 | 20 (100%) | 2.74 | 2.81 | 2.75 |
| 2 | PHE33N---LYS70N | Связь между бета-листами в основной цепи | 2.8 | 20 (100%) | 2.74 | 2.83 | 2.76 |
| 3 | LYS76NZ---GLU89OE2 | Связь между бета-листом и альфа-спиралью в боковой цепи | 2.7 | 0 (0%) | - | - | - |
| 4 | HIS90NE2---GLU92OE2 | Связь в рамках бета-листа в боковой цепи | 2.8 | 14 (70%) | 2.80 | 3.21 | 2.85 |
| 5 | LYS15NZ---GLU54OE2 | Связь между петлями в бокой цепи | 2.6 | 0 (0%) | - | - | - |
| 6 | GLU54OE2---HIS56NE2 | Связь между петлей и бета-листом в боковой цепи | 2.9 | 1 (5%) | 2.94 | 2.94 | 2.94 |
|
|
|
Рис 3. Водородная связь между LYS70 и PHE33 (№1 №2) вблизи и на фоне всей молекулы
|
|
|
Рис 4. Водородная связь между LYS76 и GLU89 (№3) вблизи и на фоне всей молекулы
|
|
|
Рис 5. Водородная связь между HIS90 и GLU92 (№4) вблизи и на фоне всей молекулы
|
|
|
Рис 6. Водородная связь между LYS15, GLU54 и HIS56 (№5 №6) вблизи и на фоне всей молекулы
Как можно видеть по рис. 3-6 водородные связи, которые всттречаются как в РСА, так и во многих ЯМР моделях относятся к стабильным структурам: связь между бета листами в основоной цепи или связь между боковыми цепями у близких, почти соседних в одном бета-листе остатков. Это ожидаемо, т.к. эти элементы очень стабильные и не должны сильно меняться даже в расстворе. А если идет речь о струткурах менее стабильных, таких как боковые цепи у остатков из разлчных элементов второичной структуры, или о петлях, то тогда в ЯМР структурах такие водородные связи встречаются крайне редко, т.кю там все слишком подвижно.