Увеличить рисунок
Главная страница > Первый семестр > Описание области контакта с функциональным лигандом
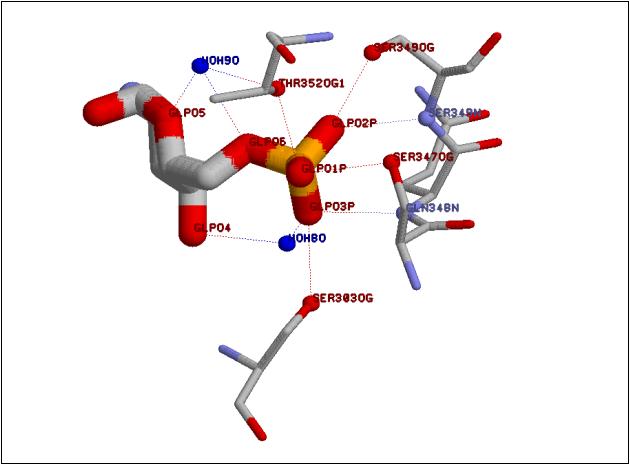
Так как глюкозамин-6-фосфат не имеет протяженных гидрофобных участков, различных ароматических структур и
содержит большое количество полярных группировок, его взаимодействие с белком осуществляется только посредством
водородных связей (см. схему взаимодействия глюкозамин-6-фосфата с белком). Аминокислотные остатки, контактирующие с глюкозамин-6-фосфатом, можно разделить на две группы:

|
Рис. 1. Взаимодействие фосфатной группы глюкозамин-6-фосфата с глюкозамин-6-фосфатсинтазой
Увеличить рисунок |
|
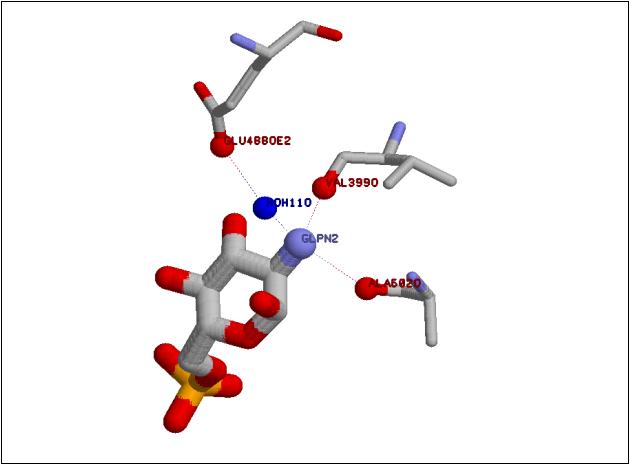
Рис. 2. Взаимодействие 2-NH2 группы глюкозамин-6-фосфата с глюкозамин-6-фосфатсинтазой Увеличить рисунок |
|
|
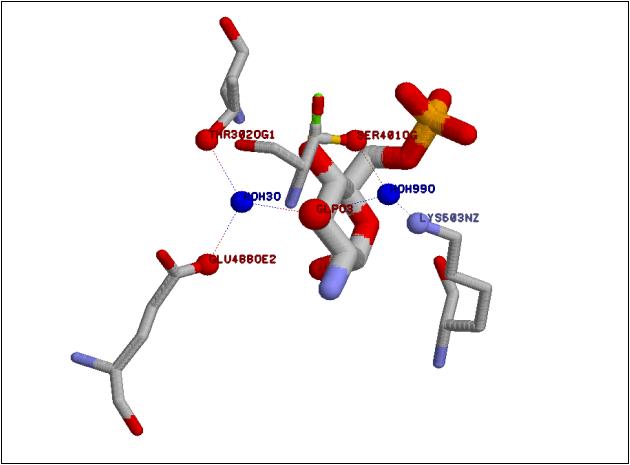
Рис. 3. Взаимодействие 3-OH группы глюкозамин-6-фосфата с глюкозамин-6-фосфатсинтазой Увеличить рисунок |
|
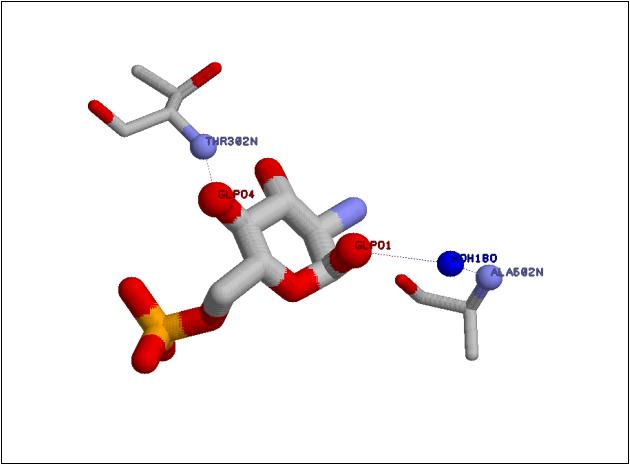
Рис. 4. Взаимодействие 1-OH и 4-OH групп глюкозамин-6-фосфата с глюкозамин-6-фосфатсинтазой Увеличить рисунок |
|
Изображения на рис. 1-5 получены при
выполнении RasMol-скрипта
Замены аминокислотных остатков, которые могут привести к снижению способности связывания белка с глюкозамин 6-фосфатом
В связи с тем, что глюкозамин-6-фосфат контактирует со многими аминокислотными остатками, следует ожидать, что замена
одного может привести к снижению активности фермента, а не к полной потере способности взаимодействовать с субстратом.
Влияние на связывание глюкозамин-6-фосфата может оказать замена контактирующего с ним аминокислотного остатка с полярной
боковой цепью на гидрофобный аминокислотный остаток, например, glu488 на метионин. Атом glu488.Oε2 образует водородную связь
с двумя молекулами воды, которые, в свою очередь, контактируют с 3-OH и 2-NH2 группами глюкозамин-6-фосфата (формируются два
«водяных мостика»). В связи с тем, что боковые цепи метионина и глутамата близки по размеру, ослабление способности белка
взаимодействовать с лигандом будет вызвано только отсутствием заряженной карбоксильной группы в боковой цепи метионина. На
месте Oε2 атома глутамата окажется неполярная метильная группа, которая не будет участвовать в образовании водородных связей
с 3-OH и 2-NH2 группами субстрата (через «водяные мостики»), что понизит сродство GLMS_ECOLI к глюкозамин-6-фосфату. Кроме
того, отсутствие заряженной карбоксильной группы глутамата способно вызвать нарушение укладки полипептидной цепи в районе
активного центра, что также скажется на связывании лиганда. Таким образом, замена glu488 на метионин приведет к сильному
ослаблению способности белка взаимодействовать с глюкозамин-6-фосфатом.
Ослабить связывание белка с глюкозамин-6-фосфатом можно также путем замены какого-либо аминокислотного остатка,
контактирующего с лигандом и имеющего небольшую боковую цепь, на аминокислотный остаток с достаточно объемной боковой цепью.
Например, замена ser347 на триптофан приведет не только к исчезновению водородной связи между Oγ атомом серина и фосфатной
группой лиганда, но и значительно изменит взаимное расположение соседних аминокислотных остатков, также контактирующих с
лигандом: gln348, ser349 и thr352. Это приведет к потере большинства водородных связей между белком и фосфатной группой.
Кроме того, изменение укладки полипептидной цепи может сильно изменить взаимное расположение отдаленных аминокислотных
остатков, в том числе и тех, которые контактируют с аминогруппой или с гидроксильными группами лиганда. Таким образом,
данная замена может сильно ослабить взаимодействие GLMS_ECOLI и глюкозамин-6-фосфата.
Таким образом, замены ser347 на триптофан и glu488 на метионин могут привести к снижению способности белка связывать
глюкозамин 6-фосфат (см. рис. 6 и листинг 1).
Замены аминокислотных остатков, слабо влияющие на способность связывания белка с глюкозамин-6-фосфатом
Замена ser349 на треонин повлияет на связывание белка с глюкозамин-6-фосфатом незначительно. В GLMS_ECOLI атомы ser349.N
и ser.349.Oγ, являющиеся донорами протона, контактируют с фосфатной группой лиганда. Так как боковые цепи серина и треонина
близки по размеру, после введения замены роль атомов серина, взаимодействующих с глюкозамин-6-фосфатом, возьмут на себя
аналогичные по расположению атомы thr349.N и thr349.Oγ1, которые также способны быть донорами протона. При этом терминальная
метильная группа Cγ2 боковой цепи треонина незначительно повлияет на укладку белка. Это связано с ее небольшими размерами
и неполярностью, препятствующей участию в каких-либо взаимодействиях с полярными группами лиганда и близлежащих
аминокислотных остатков. Таким образом, замена не отразится на связывании молекулы глюкозамин-6-фосфата.
Замена ala602 на глицин также не окажет сильного влияния на взаимодействие белка с лигандом. Вместо атомов ala602.O и
ala602.N, принадлежащих остову полипептидной цепи, водородные связи с субстратом будут образовывать атомы остова gly602.O
и gly602.N соответственно. Отсутствие небольшой и достаточно инертной боковой цепи (метильной группы ala.Cβ) не приведет к
значительным изменениям в укладке белка.
Таким образом, замены ser349 на треонин и ala602 на глицин незначительно повлияют на способность белка связывать
глюкозамин 6-фосфат (см. рис. 6 и листинг 1).
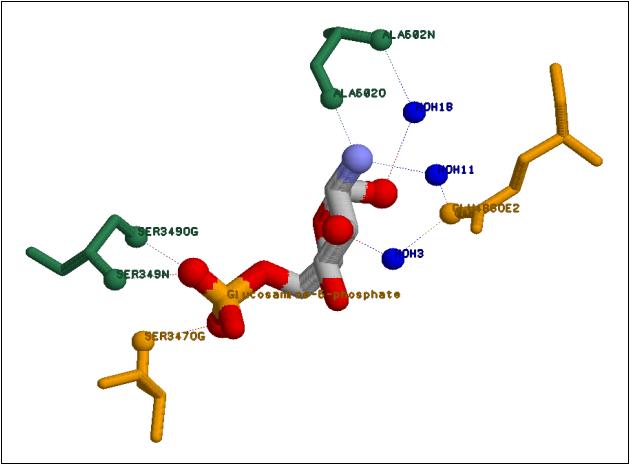
|
Рис. 6. Аминокислотные остатки, подлежащие замене
(желтым показаны остатки, замена которых приведет к снижению способности связывания
белка и субстрата, зеленым - остатки,
замена которых незначительно повлияет связывание, см. пояснения в тексте)
Увеличить рисунок |
© Куравский Михаил Львович