Главная страница > Четвертый семестр > Метаболические пути
Рассмотрен метаболический путь, в ходе которого происходит деградация аргинина до пирувата. Проведен поиск записей БД KEGG COMPOUND* (структуры низкомолекулярных веществ, участвующих в биохимических процессах), соответствующих начальному и конечному продуктам метаболического пути (L-аргинину и пирувату). Найденные записи (L-аргинин — C00062 и пируват — C00022) содержат информацию о химических свойствах веществ и об их функциях в живых организмах, в том числе:
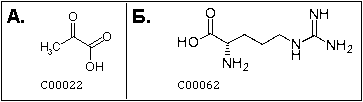
структурные формулы (рис. 1) и трехмерные структуры (поле Structure),
брутто-формулы (поле Formula),
молекулярные массы (поле Mass),
список известных химических реакций с участием данных веществ (поле Reaction),
список известных метаболических путей с участием данных веществ (поле Pathway),
список кодов (EC) ферментов, работающих с данными веществами (поле Enzyme).
Кроме того, в записях KEGG COMPOUND приведены ссылки на другие БД, в которых имеется информация о рассматриваемых веществах. Например, в поле Remark записи C00062 (L-аргинин) указано, что в БД KEGG DRUG (лекарственные препараты, входит в состав KEGG LIGAND) также имеется запись, соответствующая L-аргинину (D02982). По данным KEGG DRUG, L-аргинин может быть использован при отравлении аммиаком и при диагностике некоторых заболеваний гипофиза.
*
KEGG COMPOUND является составной частью БД химических соединений и реакций (KEGG LIGAND), наряду с БД KEGG ENZYME (ферменты), KEGG REACTION (биохимические реакции) и др.

Рис. 1. Структурные формулы пирувата (pyruvate) (А) и L-аргинина (L-arginine) (Б). По данным
KEGG COMPOUND.
Поиск метаболической карты, содержащей рассматриваемый метаболический путь (деградация аргинина до пирувата), был проведен с помощью инструмента Color objects in pathways. Для этого в поле запроса были введены ID начального и конечного продуктов метаболического пути:
cpd:C00062 red
cpd:C00022 red
Найдена единственная метаболическая карта (map00330, метаболизм аргинина и пролина), содержащая L-аргинин и пируват одновременно. Кратчайший путь между данными веществами включает в себя семь стадий (подробнее см. ниже). Ферменты, катализирующие реакции выбранного пути, были выделены на карте желтым цветом. Для этого был подан следующий запрос:
cpd:C00062 red
cpd:C00022 red
ec:3.5.3.1 yellow
ec:4.3.1.12 yellow
ec:1.14.11.2 yellow
ec:1.5.1.12 yellow
ec:1.5.1.12 yellow
ec:2.6.1.1 yellow
ec:4.1.1.3 yellow
Фрагмент метаболической карты, соответствующий кратчайшему пути деградации L-аргинина в пируват, приведен на рис. 2.
Рис. 2. Фрагмент метаболической карты map00330 (метаболизм аргинина и пролина), соответствующий кратчайшему пути деградации аргинина до пирувата.
Выбранный метаболический путь включает в себя семь этапов (табл. 1). Первая стадия (расщепление аргинина до орнитина и мочевины, катализируемое аргиназой, EC 3.5.3.1) представляет собой одну из реакций цикла мочевины и является необратимой. Следующая стадия представляет собой обратимую циклизацию орнитина, катализируемую орнитинциклодеаминазой (OCD, EC 4.3.1.12). Продуктом реакции является L-пролин. По данным
KEGG ORTHOLOGY (K01750, см. ниже), OCD характерна только для прокариотических организмов и некоторых протистов (Shizosaccharomyces pombe, Dictyostelium discoideum и Entomaeba histolytica). У многоклеточных эукариот реализуется альтернативный путь, включающий в себя три реакции и требующий затраты NADH·H+ (3 эквивалента ATP, рис. 3). Возможно, роль OCD заключается в обеспечении более выгодного с энергетической точки зрения катаболизма аргинина. Сходные выводы были получены в работе Dessaux et al. (1986) на основании изучения мутантов Agrobacterium tumefaciens с неактивной OCD. Было показано, что такие мутанты (в отличие от нормальных бактерий) неспособны расти на средах, содержащий аргинин или орнитин в качестве единственного источника углерода.Следует отметить, что гомолог OCD был найден и у человека (Kim et al., 1992). Данный белок экспрессируется преимущественно в нервной ткани и представляет собой μ-кристаллин хрусталика глаза (до 15% от общего количества белков хрусталика). При этом μ-кристаллин предположительно сохраняет орнитинциклодеаминазную активность, о чем свидетельствуют его высокая консервативность и экспрессия в различных тканях организма (например, в мышечной ткани и в почках). Так как аргинин является незаменимой аминокислотой для человека (не синтезируется в организме), а пролин синтезируется из глутамата через L-глутамат-5-семиальдегид (один из интермедиатов альтернативного пути деградации орнитина до пролина), роль орнитинциклодеаминазы человека вряд ли заключается в осуществлении биосинтеза пролина (пролин может быть синтезирован из доступного глутамата без участия орнитинциклодеаминазы). Деградация аргинина также осуществляется без участия орнитинциклодеаминазы через L-глутамат-5-семиальдегид до одного из интермедиатов цикла Кребса — 2-оксоглутарата (возможно в связи с тем, что при деаминировании орнитина образуется токсичный аммиак) [1]. В работе Kim et al. (1992) выдвинуто предположение о том, что орнитинциклодеаминаза участвует в осморегуляции (пролин является одним из важнейших осмолитов). Данная функция важна для поддержания как прозрачности хрусталика, так и баланса электролитов в почках, где также экспрессируется данный фермент.
Следующие пять стадий (четыре из которых являются необратимыми) представляют собой реакции катаболизма углеродного скелета. Конечными продуктами цепочки реакций являются пируват и глиоксилат, которые могут быть использованы при биосинтезе других аминокислот или окислены. Данный метаболический путь энергетически выгоден, так как в ходе него происходит восстановление одной молекулы FAD и одной молекулы NAD+ (5 эквивалентов АТP). Вероятно, роль деградации аргинина до пирувата заключается именно в получении энергии, так как пируват, как правило, является более доступным веществом, чем аргинин (может быть легко синтезирован из сахаров), в связи с чем синтез аминокислот из пирувата является более рентабельным, чем из аргинина.
В KEGG отсутствует какая-либо информация о дальнейшем метаболизме глиоксилата у человека. По данным [2], в печени из глиоксилата синтезируется глицин (реакция катализируется глицинтрансаминазой, осуществляющей перенос аминной группы глутамата или аланина на глиоксилат). Кроме того, может осуществляться окисление глиоксилата до оксалата (Ichiyama et al., 2000). При этом снижение активности глицинтрансаминазы, имеющее место при некоторых генетических заболеваниях (гипероксалурия I типа), приводит к увеличению доли глиоксилата, окисляемого до оксалата, и, как следствие, к избыточному накоплению оксалата. Отсутствие в KEGG информации о метаболизме глиоксилата у человека (и у других млекопитающих) может быть связано с запаздыванием аннотирования, хотя некоторые реакции были открыты уже достаточно давно.
В целом деградация аргинина представляет собой менее выгодный с энергетической точки зрения процесс, чем деградация сахаров. В том числе это связано с тем, что энергия, выделяющаяся при окислении атома Сζ (уходит в составе мочевины), не запасается. Кроме того, при гидроксилировании пролина один из атомов углерода 2-оксоглутарата также окисляется и уходит в виде CO2 (без запасения энергии). Если сравнивать деградацию аргинина с гликолизом (в обоих процессах происходит окисление соединений, содержащих шесть атомов углерода), то гликолиз окажется более выгодным процессом с энергетической точки зрения. При гликолизе образуются 5 эквивалентов ATP (2 молекулы ATP и одна молекула NADH·H+), тогда как при деградации аргинина — только 2 (одна молекула FADH2, у человека образовавшийся NADH·H+ расходуется на альтернативном пути превращения орнитина в пролин). Кроме того, в результате гликолиза образуются две молекулы пирувата на одну молекулу глюкозы, тогда как в ходе деградации аргинина образуется одна молекула пирувата и одна молекула глиоксилата, которая окисляется с меньшим энергетическим выходом, чем пируват). Возможно, в связи с большей энергетической выгодой в качестве источников энергии живые организмы в первую очередь расходуются углеводы и липиды, и только затем — белки.
Была рассмотрена возможность осуществления рассмотренного пути деградации аргинина до пирувата у одного эукариотического организма (homo sapines), двух бактериальных (E.coli K-12 MG1655 и Pseudomonas aeruginosa PAO1) и одного представителя архей (Methanococcus janaschii). Ни для одного из перечисленных организмов не были описаны все семь реакций пути (табл. 2). Например, у человека не описаны вторая и последняя реакции. При этом вместо второй реакции может осуществляться альтернативный путь, включающий в себя три стадии (один из интермедиатов — L-глутамат-5-семиальдегид, см. выше).
Поиск в UniProt, проведенный с помощью SRS, не выявил у эукариот ни одного из трех ферментов, способных катализировать последнюю реакцию рассматриваемого метаболического пути (4.1.1.3, 4.1.2.14 или 4.1.3.16, то есть предположение о том, что ферменты, катализирующие последнюю стадию, были найдены, но не были аннотированы в KEGG, не подтвердилось). В связи с этим роль предшествующих четырех необратимых реакций может заключаться в преобразовании 2-оксоглутарата в глутамат (реакция, сопряженная с шестой стадией, см. табл. 1).
Невозможность деградации аргинина до пирувата у человека не говорит о невозможности осуществления деградации аргинина другим путем. Например, у человека имеет место деградация аргинина до 2-оксоглутарата [2] (рис. 4, первая реакция, катализируемая аргиназой, является общей для обоих путей). Возможно, это связано с тем, что при деградации аргинина до пирувата образуется достаточно токсичный продукт — глиоксилат.
Табл.
1. Возможный путь превращения
L-аргинина в пируват (цепочка из последовательных
реакций).
| Этап | Ферментативная реакция | Фермент | Обратимая? |
| 1 | L-аргинин + H2O = L-орнитин + мочевина | 3.5.3.1 | нет |
| 2 |
L-орнитин
= L-пролин + NH3 |
4.3.1.12 | да |
| 3 |
L-пролин
+ 2-оксоглутарат + O2
= транс-4-гидрокси-L-пролин
+ сукцинат + CO2 |
1.14.11.2 | нет |
| 4 | транс-4-гидрокси-L-пролин + FAD = L-1-пирролин-3-гидрокси-5-карбоксилат + FADH2 | 1.5.1.12 | нет |
| 5 |
L-1-пирролин-3-гидрокси-5-карбоксилат
+ NAD+ + 2 H2O = L-эритро-4-гидроксиглутамат
+ NADH + H+ |
нет | |
| 6 |
L-эритро-4-гидроксиглутамат
+ 2-оксоглутарат =
D-4-гидрокси-2-оксоглутарат
+ L-глутамат |
2.6.1.1 | нет |
| 7 |
D-4-гидрокси-2-оксоглутарат
= пируват + глиоксилат |
4.1.1.3 | да |
Табл.
2. Возможность осуществления
выбранной цепочки реакции у некоторых организмов.
| Организм | Возможна ли деградация аргинина до пирувата? | Краткое обоснование |
| Homo sapiens | нет | отсутствуют ферменты, катализирующие вторую и седьмую стадии (4.3.1.12 и 4.1.1.3 соответственно) |
| Escherichia coli K-12 | нет | отсутствуют ферменты, катализирующие первую, вторую и третью стадии (3.5.3.1, 4.3.1.12 и 1.14.11.2 соответственно) |
| Pseudomonas aeruginosa PAO1 | нет | отсутствуют ферменты, катализирующие первую и третью стадии (3.5.3.1 и 1.14.11.2 соответственно) |
| Methanococcus janaschii | нет | отсутствуют все ферменты, кроме фермента, катализирующего шестую стадию (2.6.1.1) |
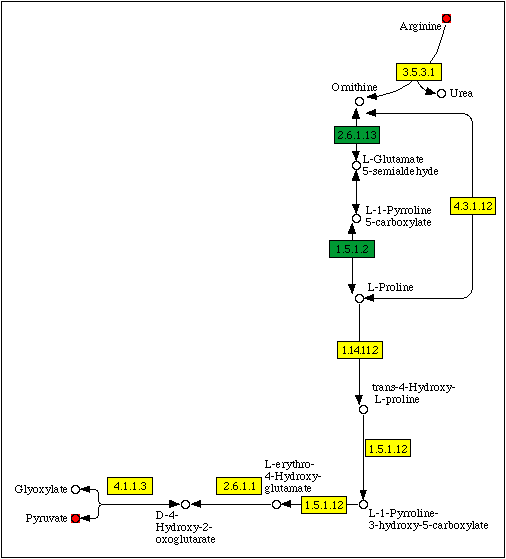
Рис. 3. Фрагмент метаболической карты map00330 (метаболизм аргинина и пролина), соответствующий деградации аргинина до пирувата. Ферменты, катализирующие реакции кратчайшего пути, выделены желтым. Ферменты, катализирующие реакции альтернативного пути превращения орнитина в пролин, выделены зеленым.
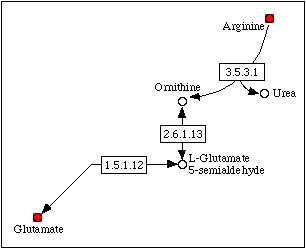
Рис. 4. Фрагмент метаболической карты map00330 (метаболизм аргинина и пролина), соответствующий пути деградации аргинина до 2-оксоглутарата, который реализуется у человека. Последняя реакция (превращение глутамата в 2-оксоглутарат) не показана.
При переведении метаболической карты map00330 (метаболизм аргинина и пролина) в режим Reference: KO часть прямоугольников с кодами ферментов оказалась закрашенной синим цветом, а часть — нет. Закрашенные прямоугольники содержат гиперссылки на записи БД
KEGG ORTHOLOGY (KO).Записи
KO соответствуют группам ортологичных генов. KO задает задает соответствие между известными генами и функциями их продуктов, как и БД KEGG ENZYME. При этом KO позволяет преодолеть некоторые недостатки KEGG ENZYME: невозможность описания белков, не участвующих в метаболических путях (например, регуляторных или структурных белков) и наличие белков, катализирующих сразу несколько ферментативных реакций (имеющих несколько кодов EC). KO является курируемой базой данных (Kanehisa and Goto, 2000; Kanehisa et al., 2004).Отсутствие записей
KO для некоторых ферментов является следствием запаздывания аннотирования (аннотирование KO — этап, следующий за аннотированием генов и аннотированием функций их продуктов). Рассмотрим запись K00134, соответствующую генам, кодирующим один из ключевых ферментов гликолиза — глицеральдегид-3-фосфатдегидрогеназу (ГАФД, GAPD, EC 1.2.1.12). По данным записи, человек имеет единственный ген, кодирующий соматический изофермент ГАФД, а мышь — два гена, кодирующие соматический и сперматозоидный изоферменты, а также экспрессирующийся псевдоген LOC14433. Однако сперматозоидная ГАФД характерна для всех млекопитающих, в том числе и для человека. Последовательность сперматозоидной ГАФД человека приведена в записи SwissProt G3PT_HUMAN, также известен и кодирующий ее ген (подробнее о генах, кодирующих различные ГАФД человека, см. Li et al., 2004). Участие сперматозоидной ГАФД человека в гликолизе подтверждено экспериментально (Miki et al., 2004). Таким образом, отсутствие информации о наличии генов сперматозоидной ГАФД человека связано с запаздыванием аннотирования.
Рассмотрен описанный выше путь деградации аргинина до пирувата. У E.coli K-12 MG1655 присутствуют все ферменты, катализирующие реакции
данного пути, кроме аргиназы (первая стадия, EC 3.5.3.1), орнитинциклодеаминазы (вторая стадия, EC 4.3.1.12) и пролингидроксилазы (третья стадия, EC 1.14.11.2). В связи с тем, что аннотирование функций в KEGG может запаздывать (см. выше), был проведен поиск указанных ферментов по EC в БД EcoCyc, BRENDA и UniProt (поиск в UniProt был проведен с помощью SRS). Поиск не выявил ни одного белка E.coli, катализирующего какую-либо из первых трех реакций. Запрос SRS, с помощью которого был проведен поиск записей UniProt, приведен ниже:([uniprot-ID:*_ECOLI] & (([uniprot-ECNumber:3.5.3.1] | [uniprot-ECNumber:4.3.1.12]) | [uniprot-ECNumber:1.14.11.2]))
Возможно, искомые ферменты присутствуют в протеоме E.coli, но их функции неизвестны. Вероятно, эти ферменты гомологичны ферментам других организмов, выполняющих те же функции. Для проверки этой гипотезы с помощью BLASTP был проведен поиск белков E.coli, сходных с белками наиболее близких бактериальных организмов, для которых показана возможность катализировать первые три реакции рассматриваемого метаболического пути* : аргиназа Xanthomonas axonopodis, орнитинциклодеаминаза Yersinia pestis CO92 и пролингидроксилаза Ralstonia eutropha JMP134 (поиск проводился по всем неизбыточным базам данных). Поиск не позволил выявить ни одной белковой последовательности, сходной с последовательностями запросов.
Возможно, последовательности искомых ферментов неизвестны. Так как они отсутствуют в
Refseq (по результатам поиска с помощью BLASTP, см. выше), их гены не были определены автоматически (что является маловероятным, так как автоматическое предсказание бактериальных генов, как правило, дает хорошие результаты). Для проверки этой гипотезы с помощью программы TBLASTN был проведен поиск участков генома E.coli, трансляты которых сходны с известными последовательностями ферментов близкородственных бактериальных организмов. Поиск также не позволил выявить ни одной нуклеотидной последовательности, транслят которой был бы сходен с одной из последовательностей запросов.Единственная возможность, которая не может была проверена — негомологичность искомых ферментов E.coli и ферментов родственных организмов, катализирующий первые три стадии рассматриваемого метаболического пути. Так как вероятность осуществления такой возможности мала, можно говорить о том, что у E.coli, скорее всего, отсутствуют ферменты, катализирующие первые три стадии выбранного пути деградации аргинина до пирувата.
Возможно, у E.coli, как и у человека, имеет место деградация аргинина до 2-оксоглутарата. Однако отсутствие аргиназы (EC 3.5.3.1) и орнитинтрансаминазы (EC 2.6.1.13) не позволяют этому процессу идти по тому же пути (в четыре стадии через L-глутамат-5-семиальдегид). По данным
KEGG, у E.coli, как и у некоторых других бактерий, имеется обходной шестистадийный путь превращения аргинина в 2-оксоглутарат, отсутствующий у эукариотических организмов (рис. 5).* Для выявления ближайших родственников E.coli, имеющих искомые ферменты, использовалась БД
KEGG ORTHOLOGY.
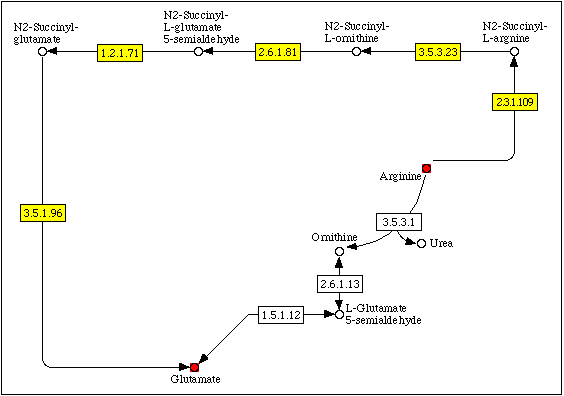
Рис. 5. Фрагмент метаболической карты map00330 (метаболизм аргинина и пролина), соответствующий путям деградации аргинина до 2-оксоглутарата, которые реализуются у человека и к E.coli. Ферменты E.coli выделены желтым. Последняя реакция (превращение глутамата в 2-оксоглутарат) не показана.
1. E.Koonin, M.Galperin Sequence-Evolution-Function: Computational Approaches in Comparative Genomics.
2. Р.Марри, Д.Греннер, П.Мейес, В.Родуэлл Биохимия человека (в 2-х томах). М.:"Мир", 2004.
© Куравский Михаил Львович, 2007