Учебный сайт Кузнецовой Марии
Мембранные белки
В рамках данного практикума я исследовала структуру мембранного белка NAD(P) transhydrogenase бактерии Thermus thermophilus, его идентификатор PDB - 4o9u. Я рассматривала цепь D этого белка. Мой белок есть в базе данных ОРМ (ссылка), где для цепи D имеются координаты 9 трансмембранных участков: 1(3-20), 2(31-48), 3(55-73), 4(84-105), 5(112-138), 6(153-172), 7(177-198), 8(206-227), 9(228-242). С помощью BLAST я составила репрезентативную выборку гомлогов этого белка (в неё вошло 8 белков бактерий, 6 белков архей и 7 белков эукариот, поиск производился по базе данных Refseq). Файл с последовательностями рапрезантативной выборки можно скачать тут. Затем я построила выравнивание этих последовательностей с помощью Muscle.
Я открыла выравнивание в Jalview, связала с последовательностью белка 4o9u его трёхмерную структуру, удалила последовательности XP_002186435.1 и WP_024808808.1, которые плохо выровнялись. Затем на основе данных ОРМ составила строку аннотации TM_REAL, где отметила буквами "М" 9 участков трансмембранных спиралей.
Далее для гомолога NAD synthetase Cyanothece sp. PCC 8801 (WP_041229806.1) провела предсказание трансмембранных доменов с помощью программы TMHMM. В результате было предсказано 8 трансмембранных спиралей: 4-23, 55-77, 87-109, 122-144, 159-181, 188-210, 230-252, 265-287. Это предсказание я отметила в строке аннотации TM_PREDICTED. Получившееся выравнивание с аннотациями можно увидеть на рис. 1, а соответствующую ему структуру белка можно увидеть на рис. 2. Проект Jalview можно скачать тут.
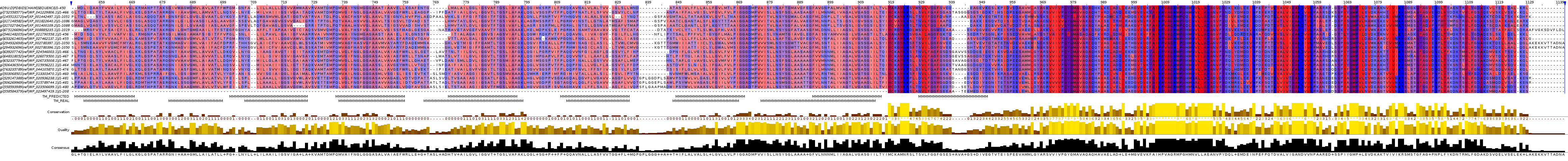
Рис. 1 Выравнивание гомологов белка 4o9u с аннотациями. Раскраска Hydrophobicity (красный цвет соответствует гидрофобным остаткам, синий - гидрофильным). Conservation 10%. Изображение получено с помощью программы Jalview.
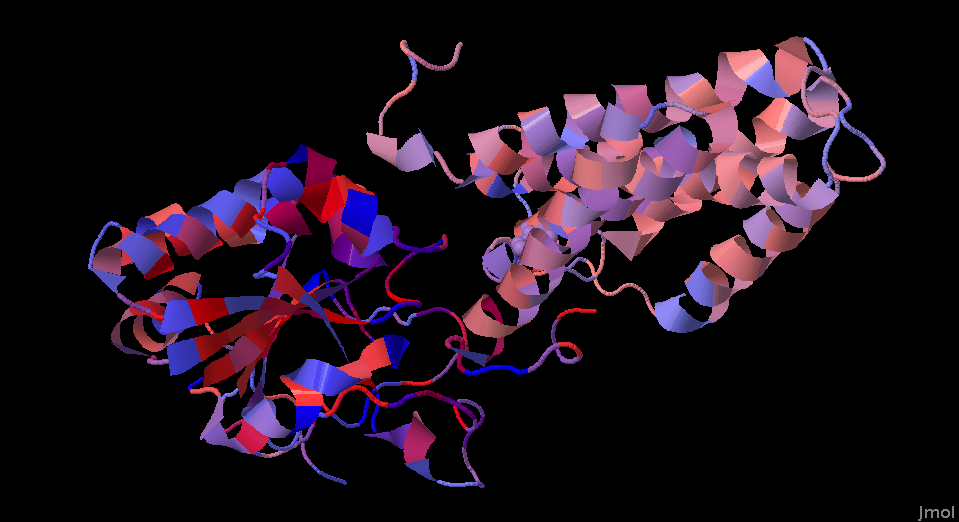
Рис. 2. Структура белка 4o9u, покрашенная в соответствии с выравниванием. Слева можно видеть более консервативный внутриклеточный домен, а справа - менее консервативный трансмембранный.
В целом, все 9 трансмембранных спиралей менее консервативны, чем внутриклеточные. Возможно, что связано с тем, что этот внутриклеточный домен является фрагментом каталитической части целого белка.
В трансмембранных спиралях часто встречаются относительно консервативные гидрофобные остатки (например, изолейцин, лейцин, валин).
TMHMM нормально предсказала 1, 3-7 и 9 спирали, не распознав 2 и 8. При этом была предсказана лишняя спираль. Возможно, это связано с тем, что в этом участке есть консервативные гидрофобные аминокислоты.
Дата последнего обновления: 15.09.2014
Copyright © Кузнецова Мария, 2013.