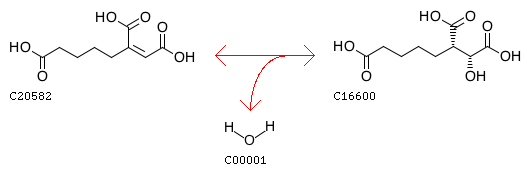
KEGG Orthology.
1. Выбор пары ортологических рядов для дальнейшей работы.
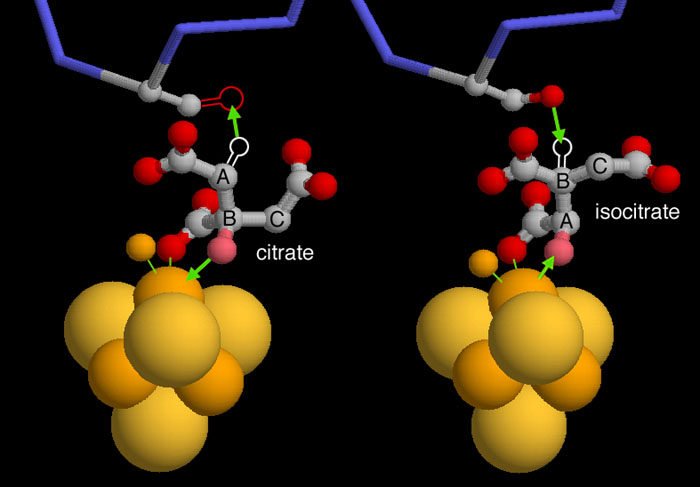
Для работы был выбран метаболизм метана, представленный на рисунке 1. Голубым цветом отмечена рассматриваемая реакция (ID: 4.2.1.114), в ходе которой происходит изомеризация цитрата в изоцитрат путем последовательной асимметрической реакции дегидратации и регидратации через промежуточное образование цис-аконитата (рис.2) под действием фермента аконитазы.
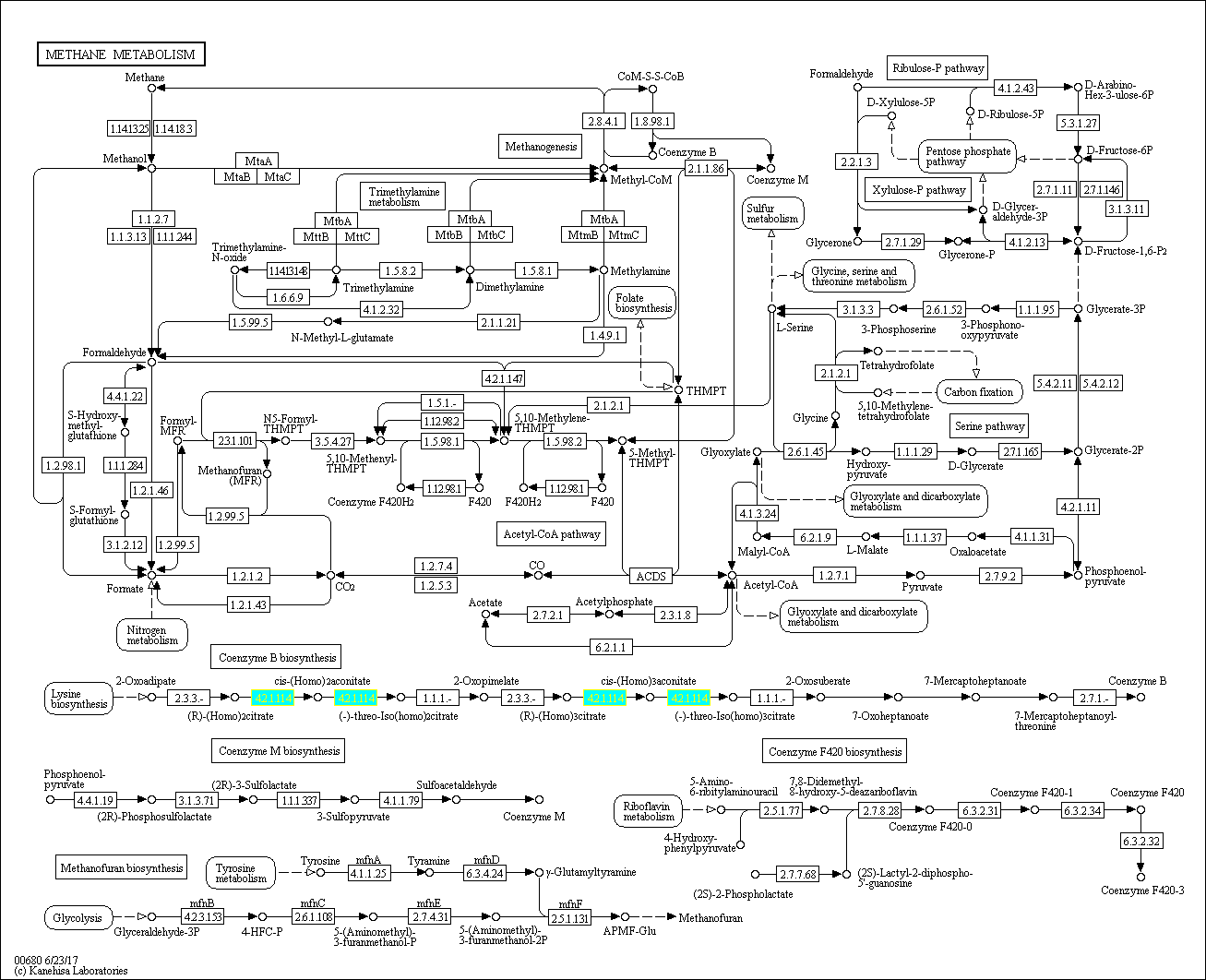
Рис.1 Метаболический путь метана.
Рис.2-3 Реакция изомеризации.
Аконитаза представляет из себя фермент класса лиаз, дегидратаз, участвующий в цикле Кребса, который катализирует образование цис-аконитовой кислоты из лимонной кислоты; имеет сложную структуру и содержит несколько железосерных центров. А. способна также связываться с некоторыми мРНК (напр., мРНК ферритина и трансферрина), регулируя этим их трансляцию и стабильность; используется как биохимический маркер в генетических исследованиях. Недостаточность А. в организме приводит к миопатии.
Также важно отметить, что реакция изомеризации цитрата ингибируется фторацетатом, который сначала превращается во фторацетил-СоА ; последний конденсируется с оксалоацетатом , образуя фторцитрат . Непосредственным ингибитором аконитазы является фторцитрат; при ингибировании накапливается цитрат.
Аконитазы относятся к
Классу: Лиазы
Подклассу: Углерод-кислород лиазы
Подподклассу: Гидро-лиазыВ KEGG число ортологичных рядов состояло из двух: ряд из больших субъединиц метаогенных гомо-аконитаз K16792 и ряд из малых субъединиц тех же ферментов K16793. Оба ряда соответствуют поставленным требованиям – содержат не более 200 белков. В случае K16792 число белков в базе Uniprot 106, в случае К16793 – 118.
2. Получение совместного множественного выравнивания.
Для каждого из ортологичных рядов из базы данных Uniprot (Retrieve/ID Mapping) были получены последовательности всех входящих в них белков (K16792.fasta и K16793.fasta). Затем с помощью скрипта были модифицированы идентификаторы каждого белка так, чтобы они содержали информацию об ортологическом ряде (K16792_ed.fasta и K16793_ed.fasta). В программе Jalview при помощи сервиса Muscle было построено множественное выравнивание. Фаста файл с выравниванием. Проект jalview. После этого файл был немного почищен (было удалено порядка 20 последовательностей).
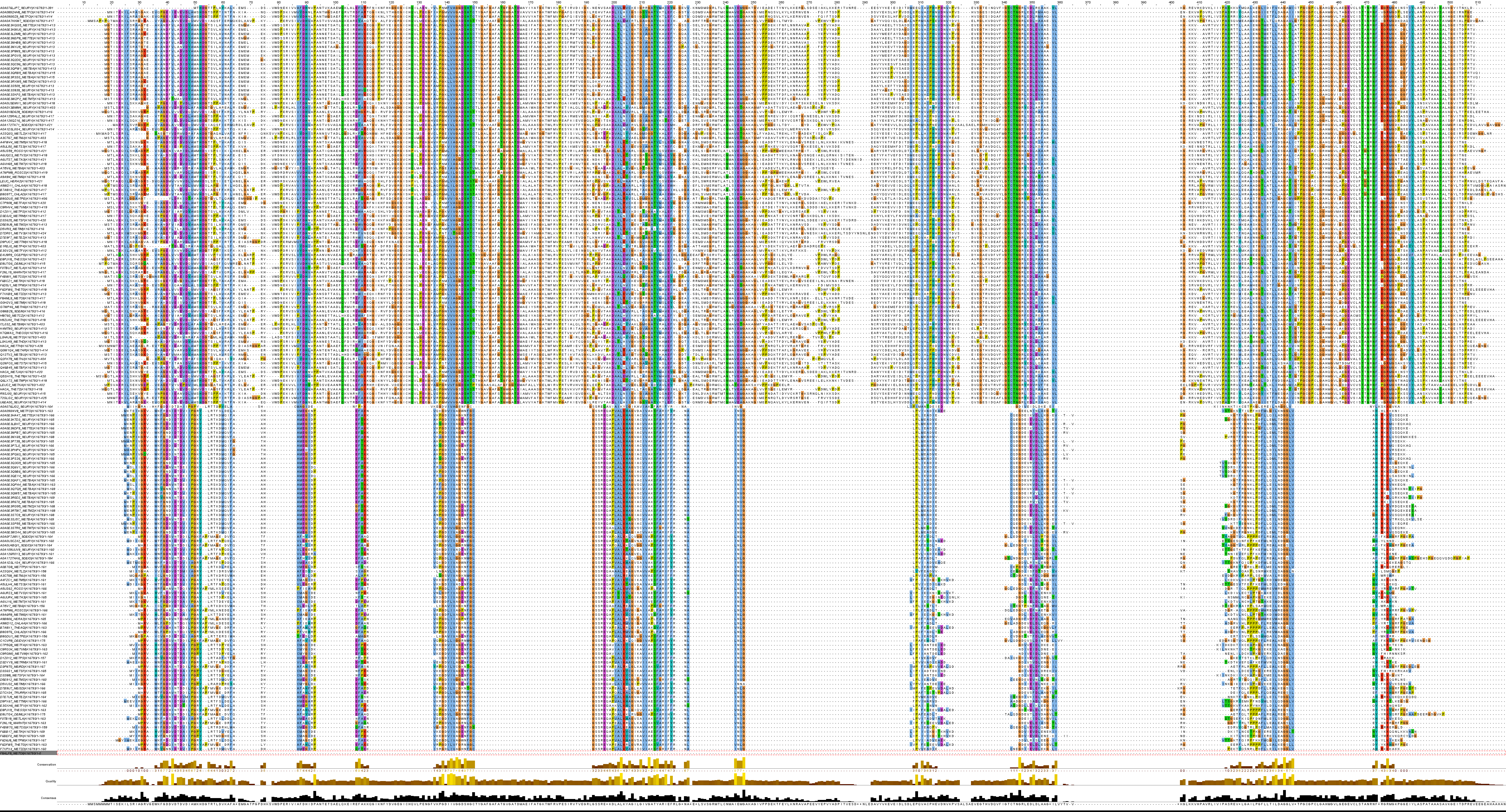
Рис.4. Выравнивание после чистки.
3. Проверка гомологичности белков в выравнивании.
По полученному выравниванию сложно судить о его качестве и как следствие гомологичности белков. Как видно на рис.4 последовательности из ряда К16793 намного короче, чем последовательности из ряда К16792. Безусловно, в выравнивании наблюдаются консервативные позиции для аминокислот, но их количество едва-ли больше половины (относительно длины последовательности). Стоит отметить, что не смотря на явную негомологичность белков из двух разных рядов, гомология сохраняется в пределе ряда. Исходя из вышесказанного, можно заключить, что все-таки гомологами белки из разных рядов не являются и качество такого выравнивания оставляет желать лучшего.
4. Построение филогенетического дерева.
Рассматриваемые белки из двух разных рядов представляют из себя две разные субъединицы одного фермента. Основываясь на манипуляциях, проделанных в пункте 3 данного практикума, получить множественное выравнивание данных белков не удается, так как гомология между рядами отсутствует. Учитывая данный факт, построение филогенетического дерева по результатам такого выравнивания было бы в высшей степени некорректно.