Сравнение ЯМР- и РСА- структур одного белка
В этом практикуме сравнивались структуры цитотоксичной рибонуклеазы, полученные методами ЯМР (1bc4) и РСА (1km8). В ЯМР-структуре содержится 15 моделей. Разрешение РСА-модели - 1,9 Å.
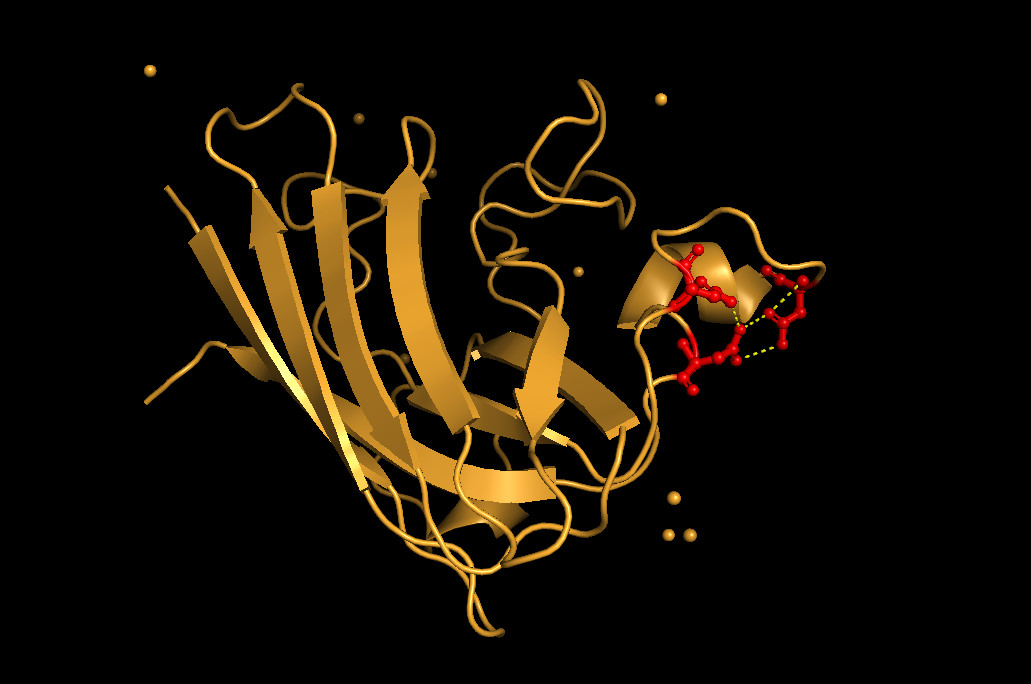
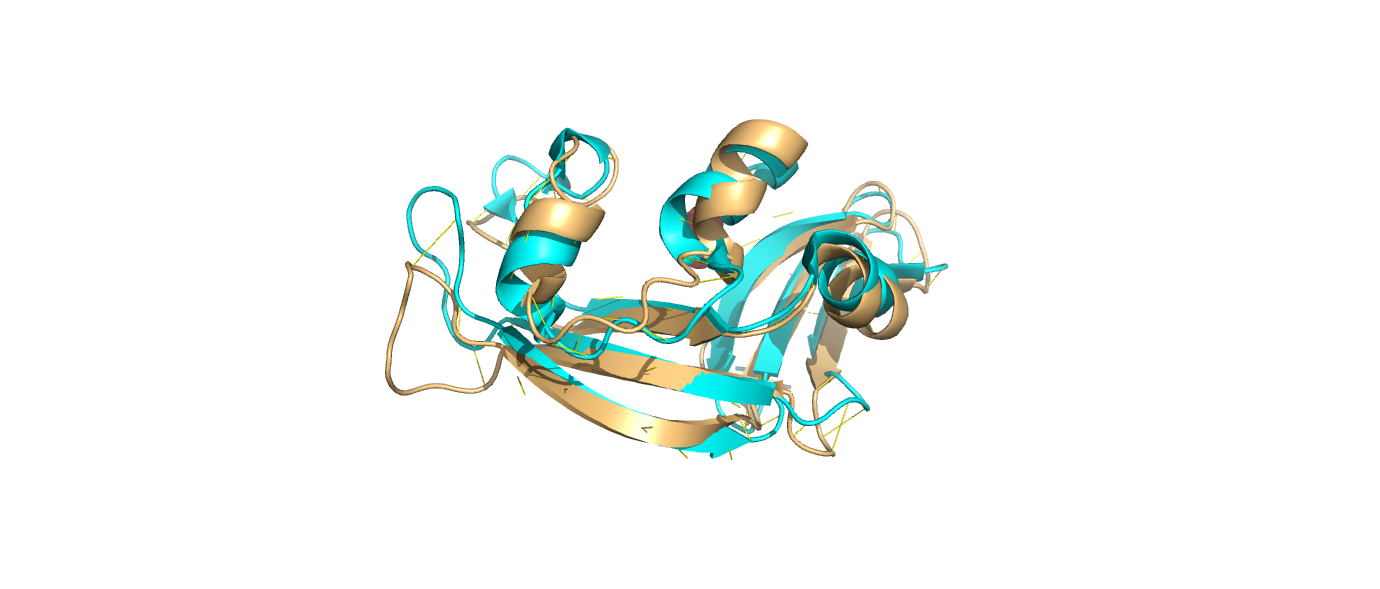
Выбранные структуры похожи, их укладка в большей мере совпадает за исключением некоторых спиралей и петель (рис. 1).
Рис. 1. Наложение структур 1bc4 и 1km8.Золотым цветом изображена структура, расшифрованная с помощью ЯМР (1bc4), а голубым - с пощью РСА (1km8).
Для сравнения этих структур было выбрано несколько аминокислотных остатков, между которыми образуются водородные связи.
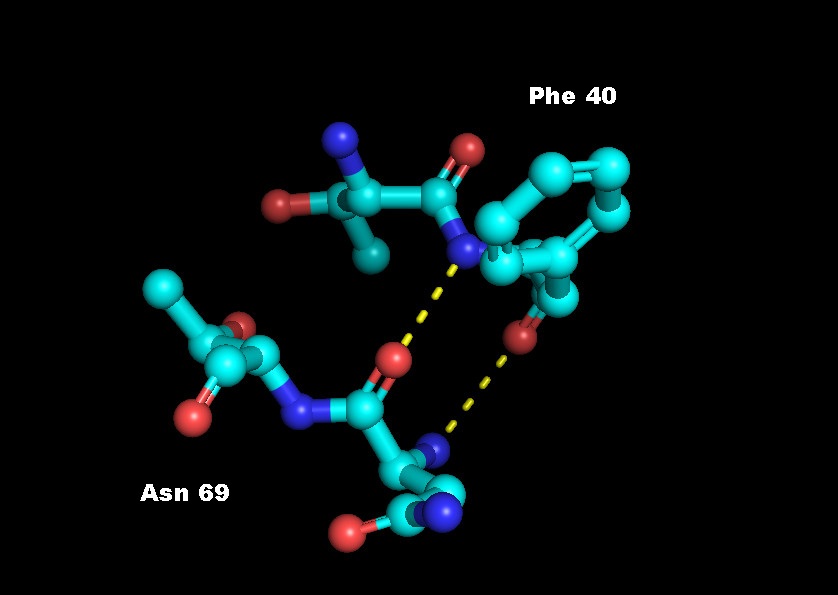
- между остовными атомами внутри глобулы белка (Phe40 и Asn69) (рис. 2)
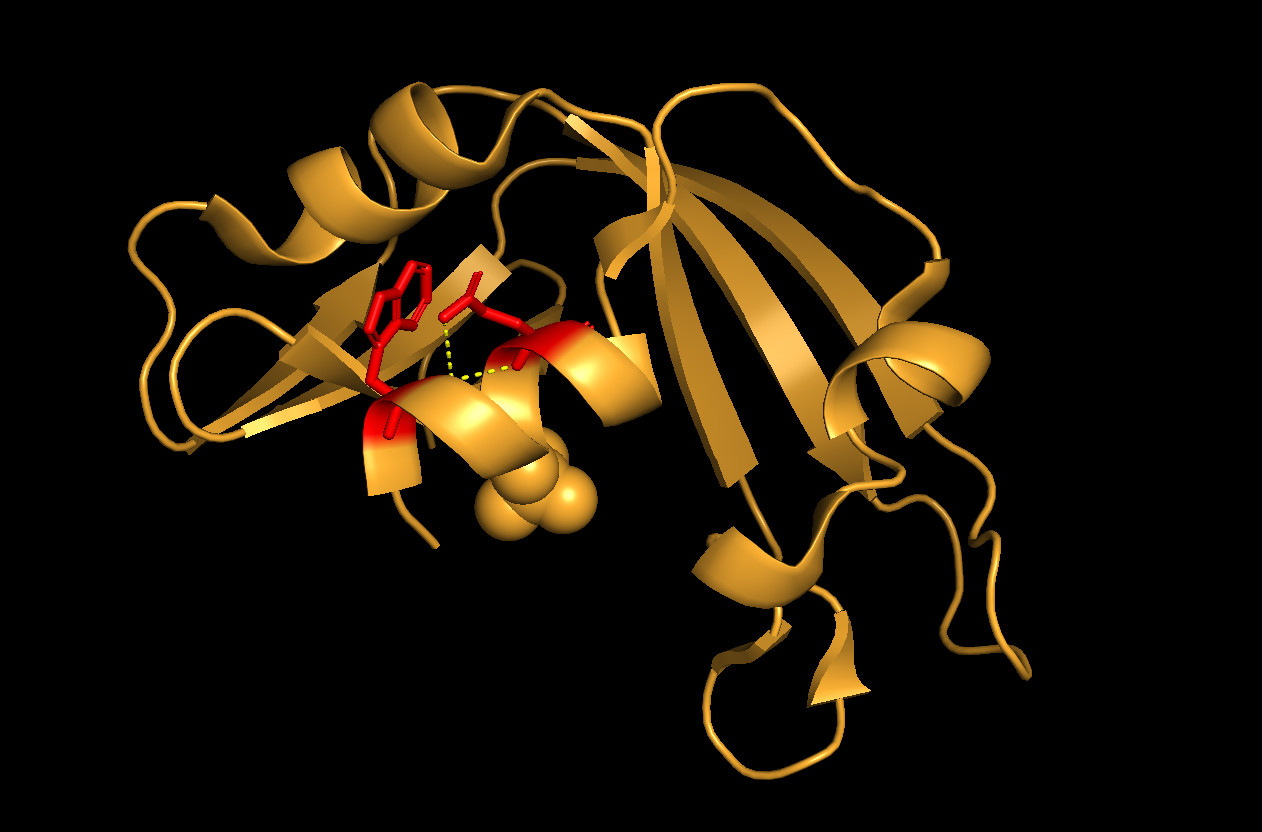
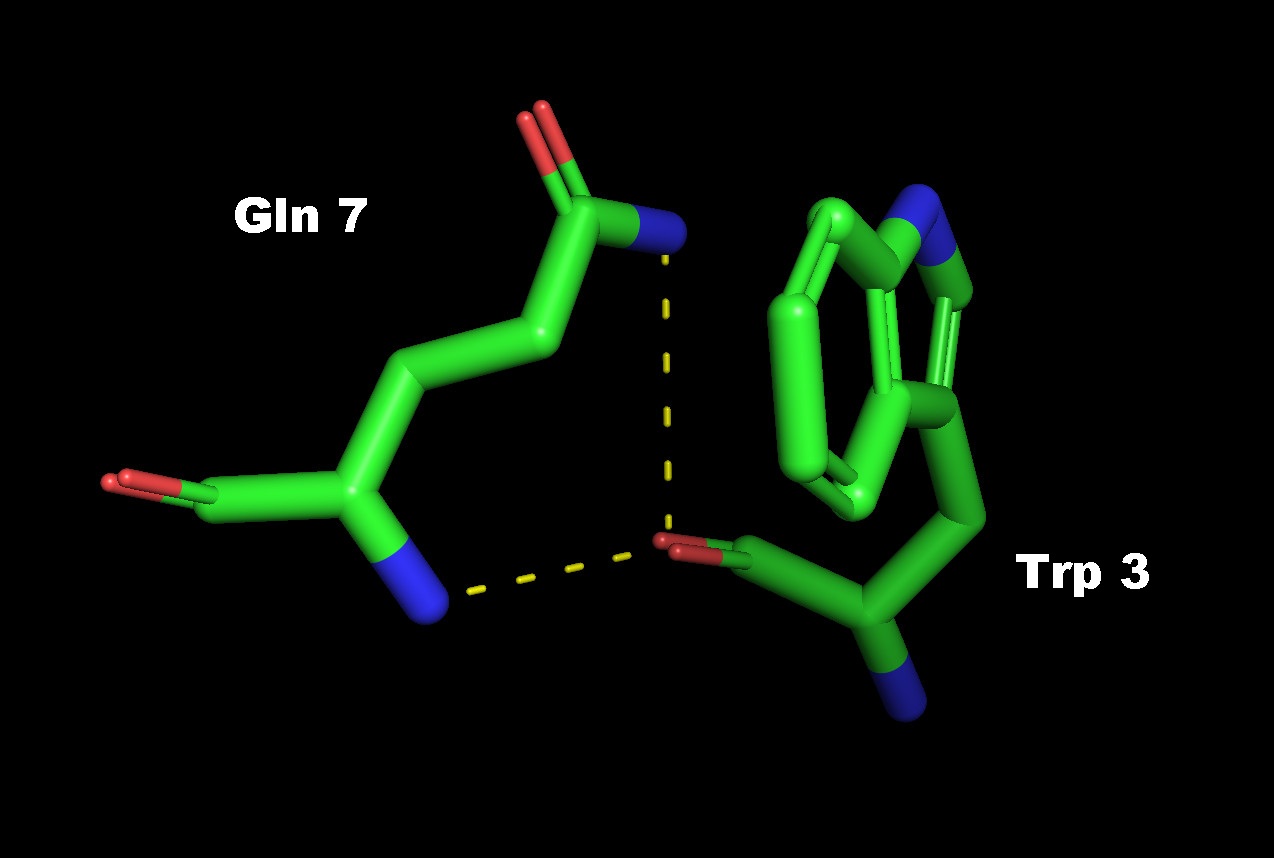
- между боковыми цепями аминокислот внутри глобулы белка (Asn57, Lys95 и Glu97; Trp3 и Gln7) (рис. 3 и 4 соответственно)
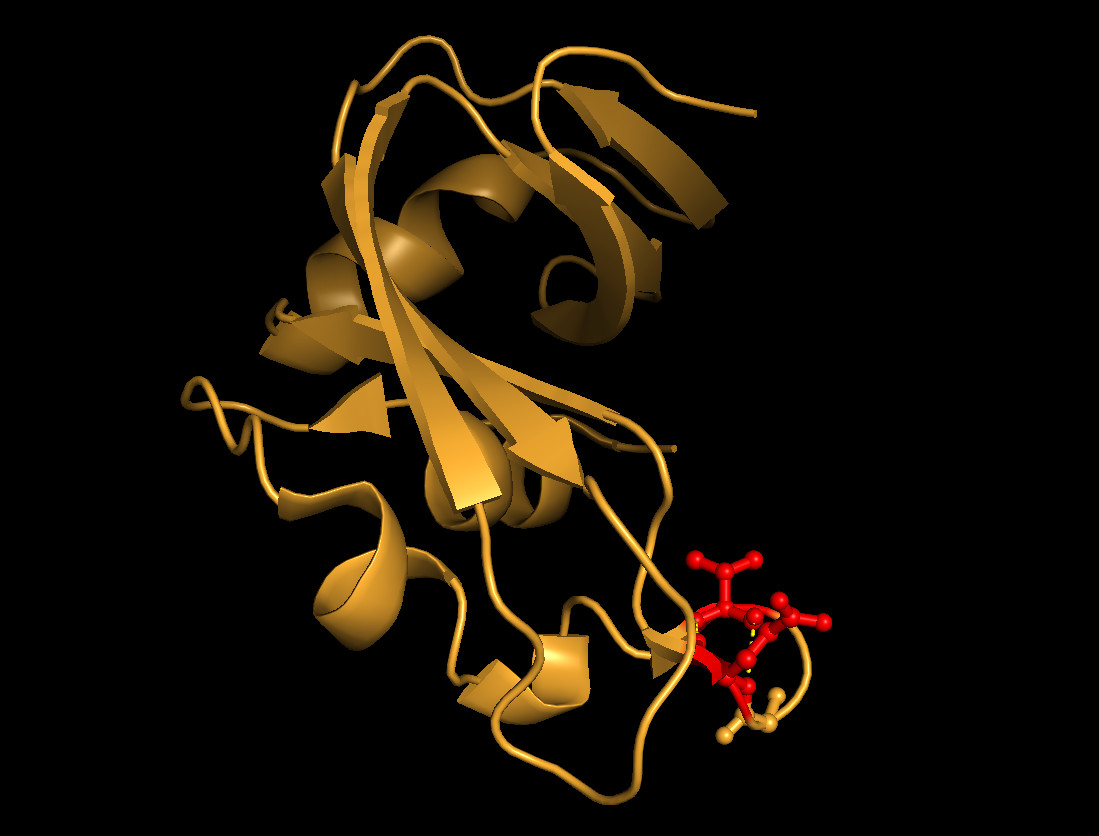
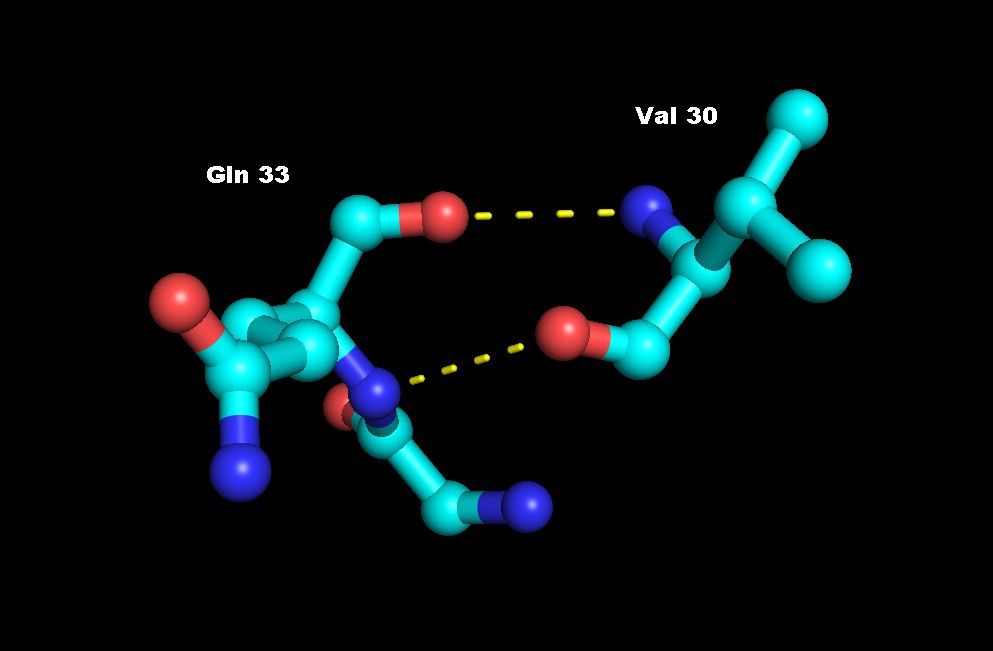
- между остовными атомами в петле (Val30 и Gln3) (рис. 5)
Стоит отметить, что найти водородные связи между боковыми цепями аминокислот внутри глобулы оказалось достаточно сложно, поэтому выбранные остатки расположены не в самой глобуле, а ближе к ее поверхности.
Рис. 2. Водородные связи между остовными атомами внутри глобулы белка. Положение остатков (отмечены красным) в структуре белка показано слева.
Рис. 3. Водородные связи между боковыми цепями аминокислот внутри глобулы белка. Положение остатков (отмечены красным) в структуре белка показано слева.
Рис. 4. Водородные связи между кислородом остовной цепи Trp3 и азотами остовной и боковой цепей Gln7. Положение остатков (отмечены красным) в структуре белка показано слева.
Рис. 5. Водородные связи между остовными атомами в петле. Положение остатков (отмечены красным) в структуре белка показано слева.
Данные взаимодействия между выбранными остатками были проанализированы в ЯМР-структуре. Для каждой из 15 моделей оценивалось расстояние между соотвествующими атомами данных остатков, которые участвуют в формировании водородной связи.
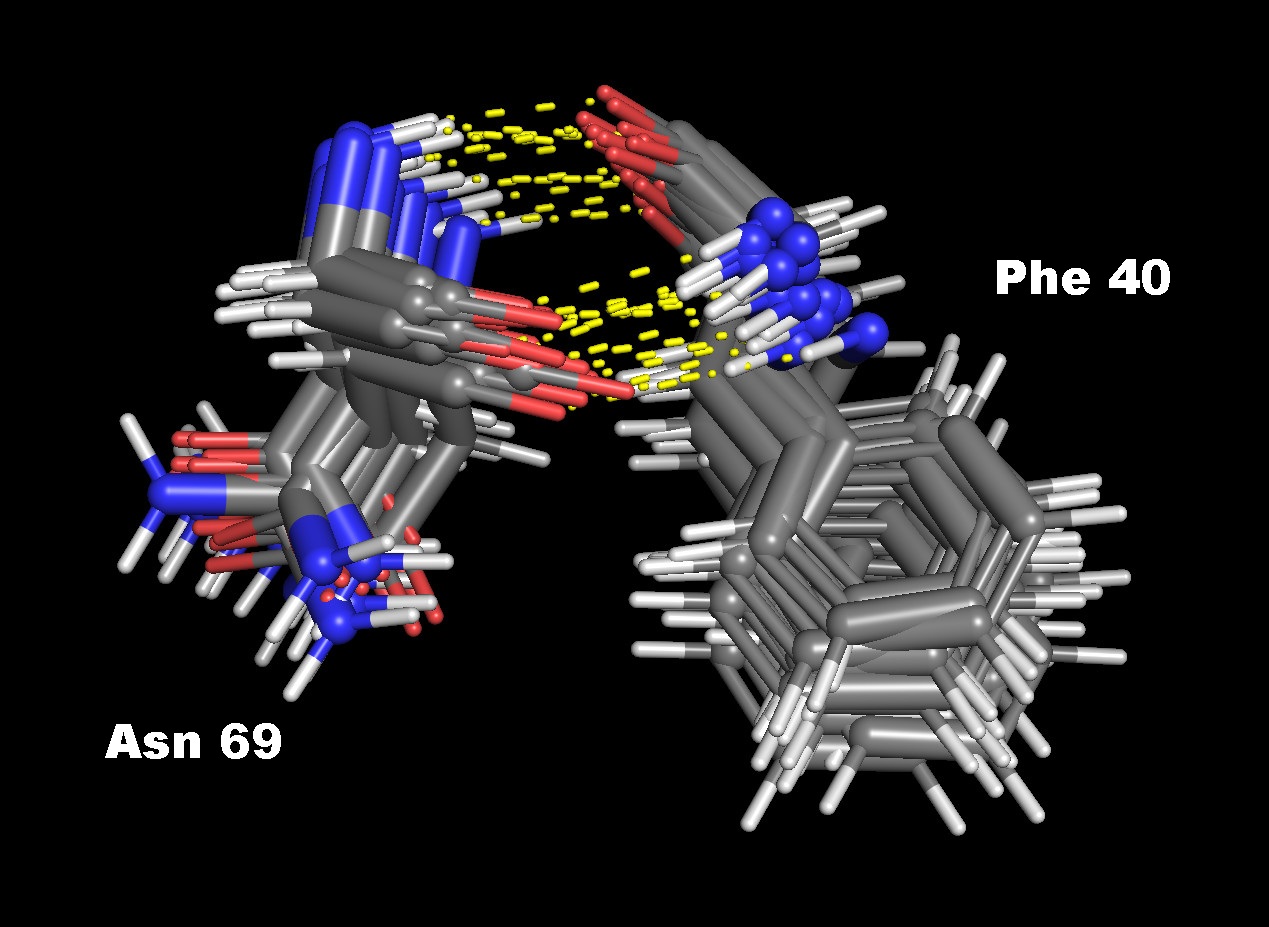
Рис. 6. Контакт Phe40-O и Asn69-N и Phe40-N и Asn69-O во всех 15 моделях структуры 1bc4.
В таблице 1 представлены полученные результаты. Для каждого взаимодействия оценивался процент моделей ЯМР, в которых присутствует водородная связь (третий столбец, %), а также минимальное, максимальное и среднее расстояния между атомами (dmin, dmax и dmean, соответственно).
Таблица 1
Как видно из таблицы 1, взаимодействия между остовными атомами аминокислот внутри глобулы были прекрасно воспроизведены во всех 15 моделях ЯМР структуры. С другой стороны, примеры взаимодействий для боковых цепей аминокислот и взаимодействий между остовными атомами аминокислот в петле в структуре, полученной РСА, не были обнаружены в случае ЯМР структуры. Это может быть обусловлено высокой подвижностью боковых цепей на выбранных участках, а также мобильностью аминокислот в петлях. Также были проанализированы все остальные возможные взаимодействия между боковыми цепями внутри глобулы (картинки не приведены), однако все эти немногочисленные взаимодействия не были воспризводимы в структуре, полученной с помощью ЯМР. В связи со сложившейся ситуацией было решено рассмотреть данный тип взаимодействия на другом белке. В качестве примера были рассмотрены структуры человеческой мутированной супероксиддисмутазы, полученные методом ЯМР(1ba9) и РСА (1mfm). В ЯМР-структуре содержится 36 моделей, 7 из которых идентичны. Разрешение РСА-модели - 1,02 Å.
В данных структурах были проанализированы только лишь водородные связи, образующиеся между боковыми цепями аминокислот спирали и петли (рис. 7 (РСА) и 8 (ЯМР)). Результаты приведены в таблице 2. П
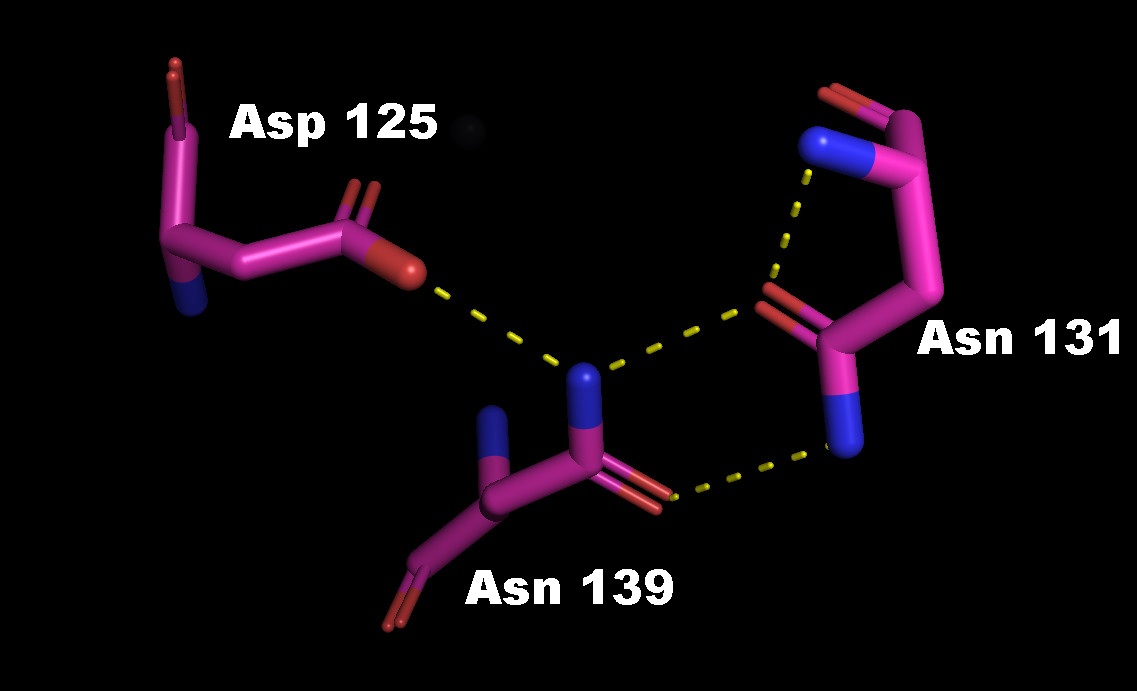
Рис. 7. КонтактAsn139-ND2 и Asn131-OD1 иAsn139-ND2 и Asp125-OD2 в структуре 1mfm.
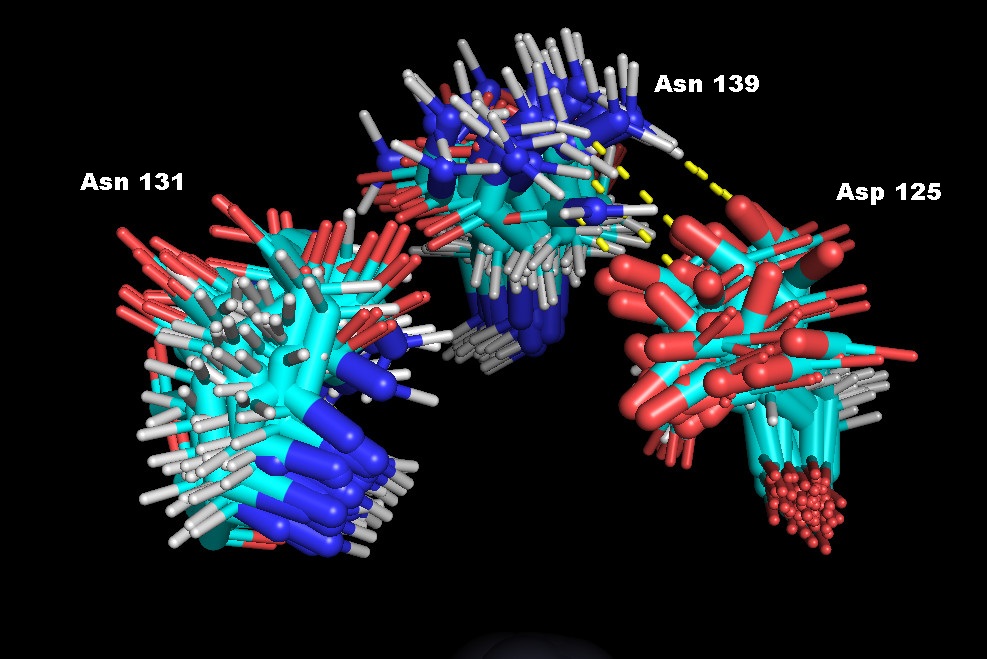
Рис. 8. Контакт Asn139-ND2 и Asp125-OD2 во всех в 5 из 30 возможных структурах 1ba9.
Таблица 2
.jpg)
.jpg)
.jpg)