Практикум 3
Альтернативные положения
При проведении рентгеноструктурного анализ кристаллов белков может возникать ситуация,
при которой одна и та же химическая группа может находиться в нескольких конформациях в разных ячейках кристалла.
В даннном задании изучались такие альтернативные положения остатка Lys-10 в структуре 6NNR.
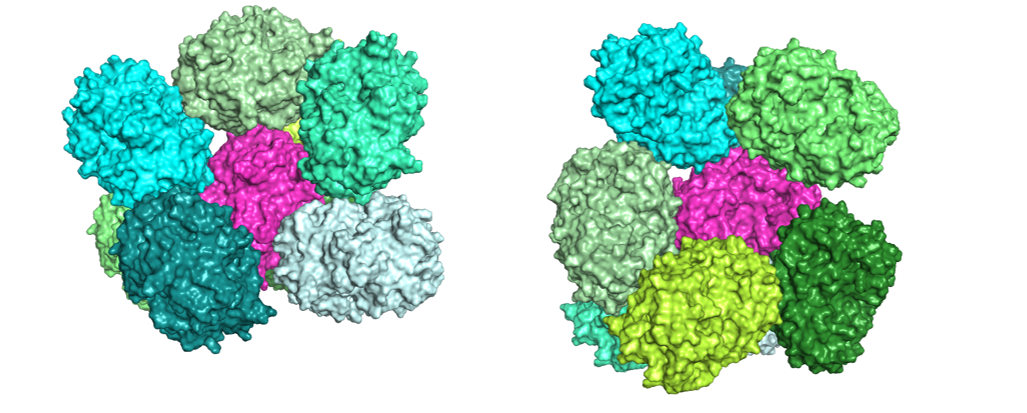
На рис. 1 приведены альтернативные положения остатка Lys 10. Всего у Lys два альтернативных положения,
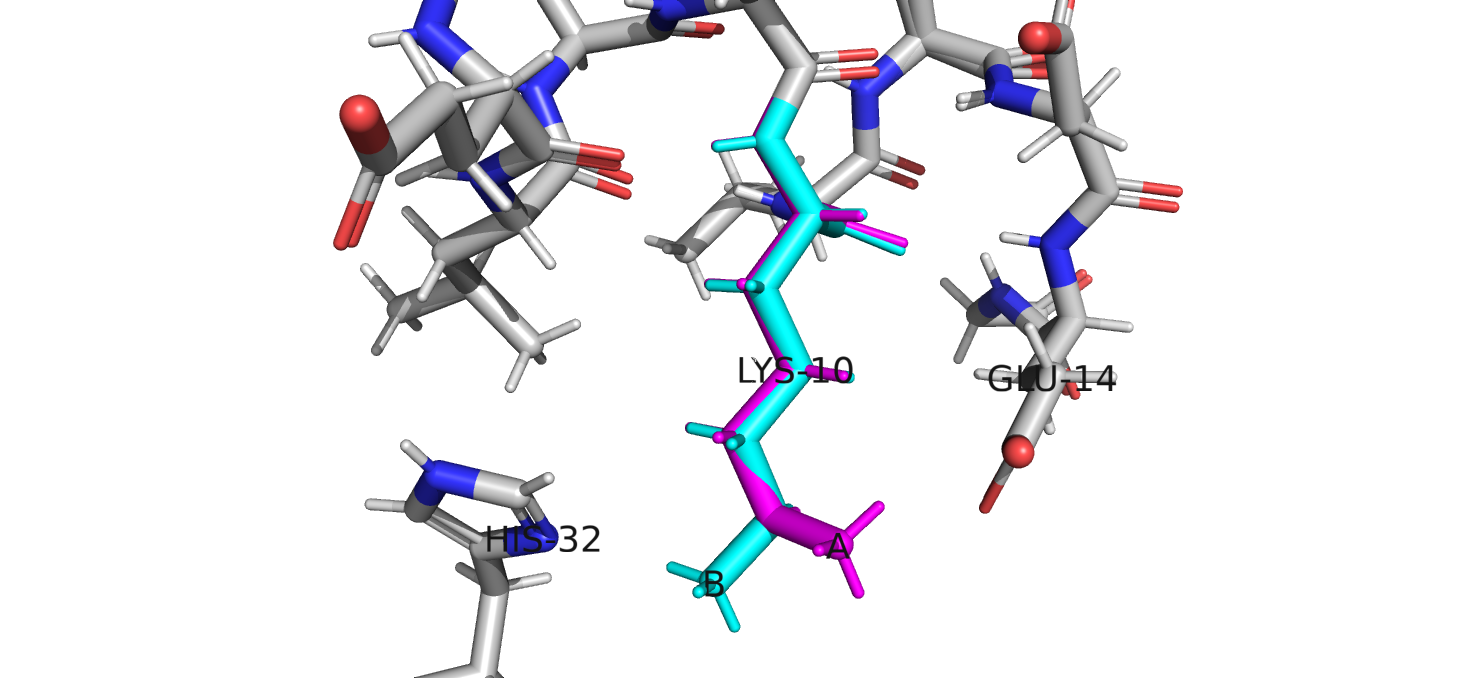
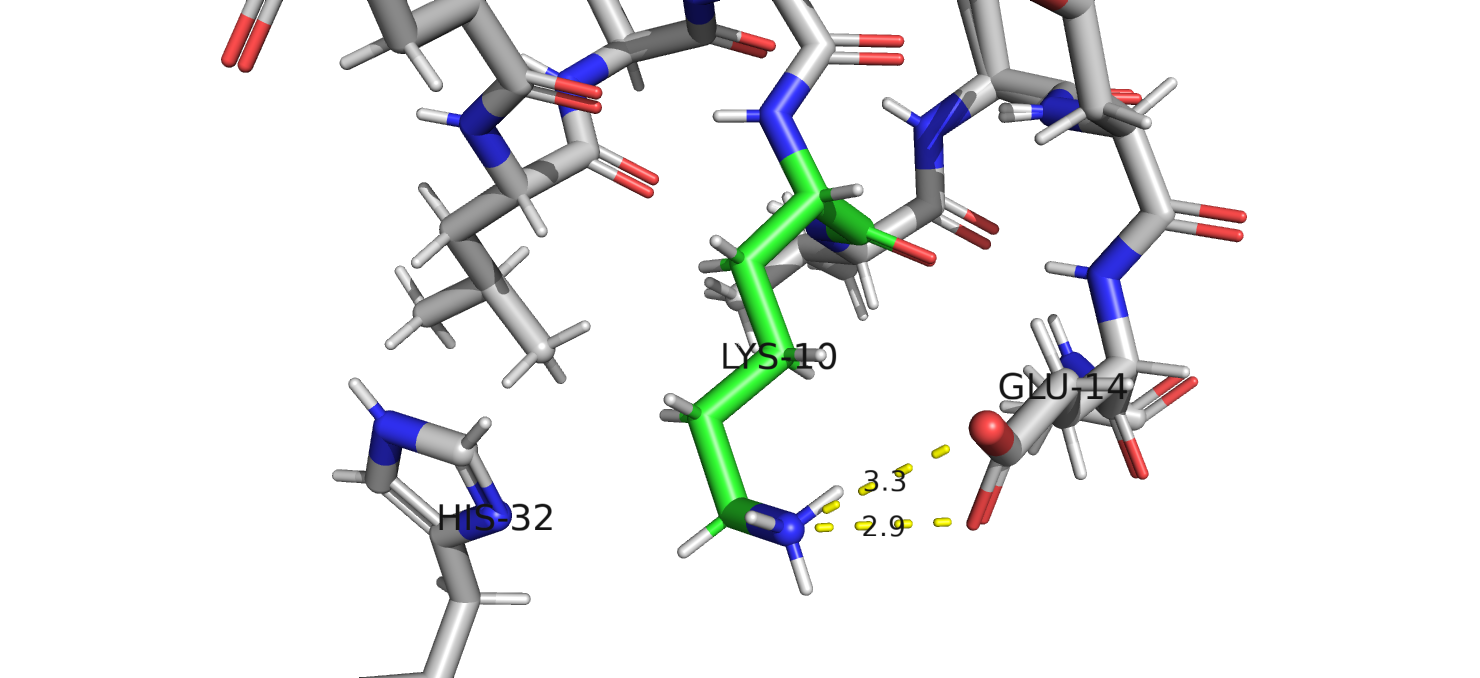
которые отличаются расположением азота. Конформация А стабилизируется солеым мостиком, возникающим между –NH3 группой Lys-10 и
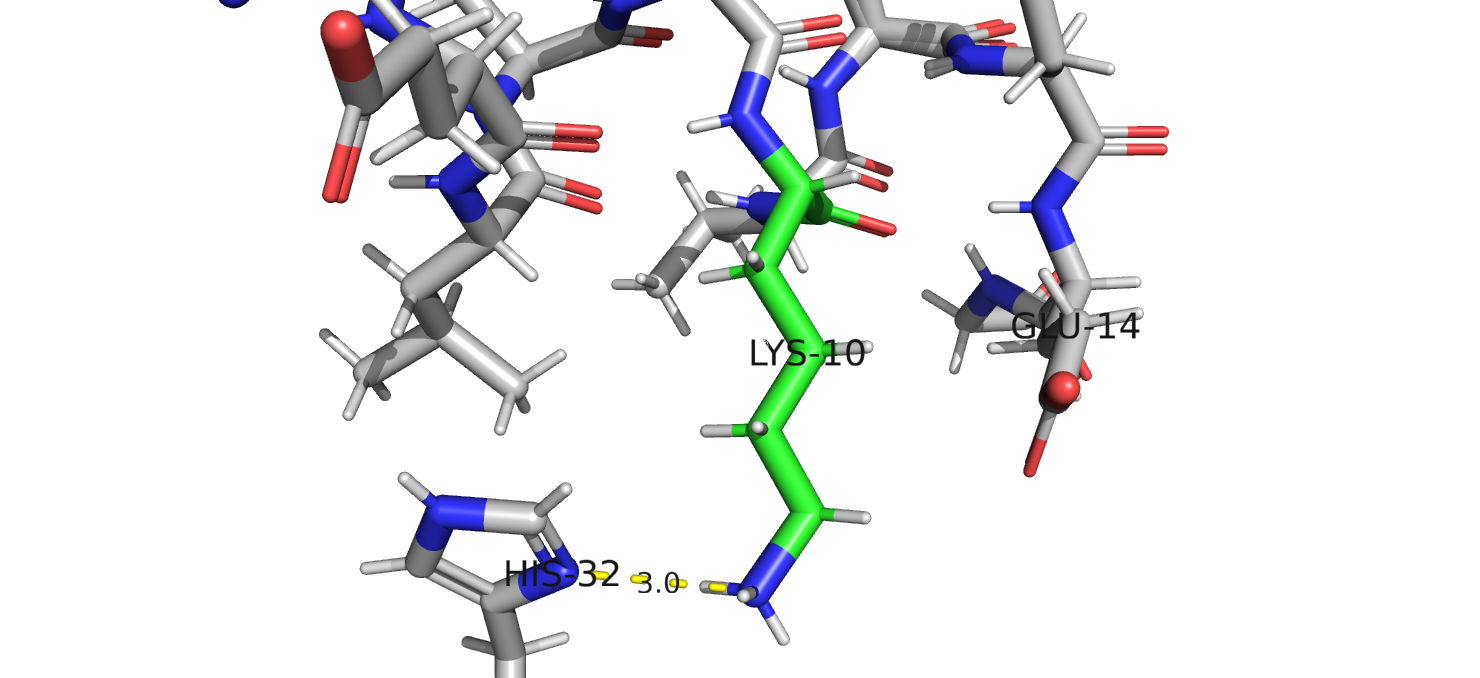
–COOH группой Glu-14.(рис. 2) Конформация B стабилизируется водородной связью между азотом His-32 и Lys-10 (рис. 3).
По данным PDB записи населённость конформации А 0.31, а конформации B – 0.69. На мой взгляд, такие значения заселённости странные,
поскольку конформация А стабилизируется солевым мостиком, взаимодействием, которое должно быть сильнее водородной связи.
B-фактор
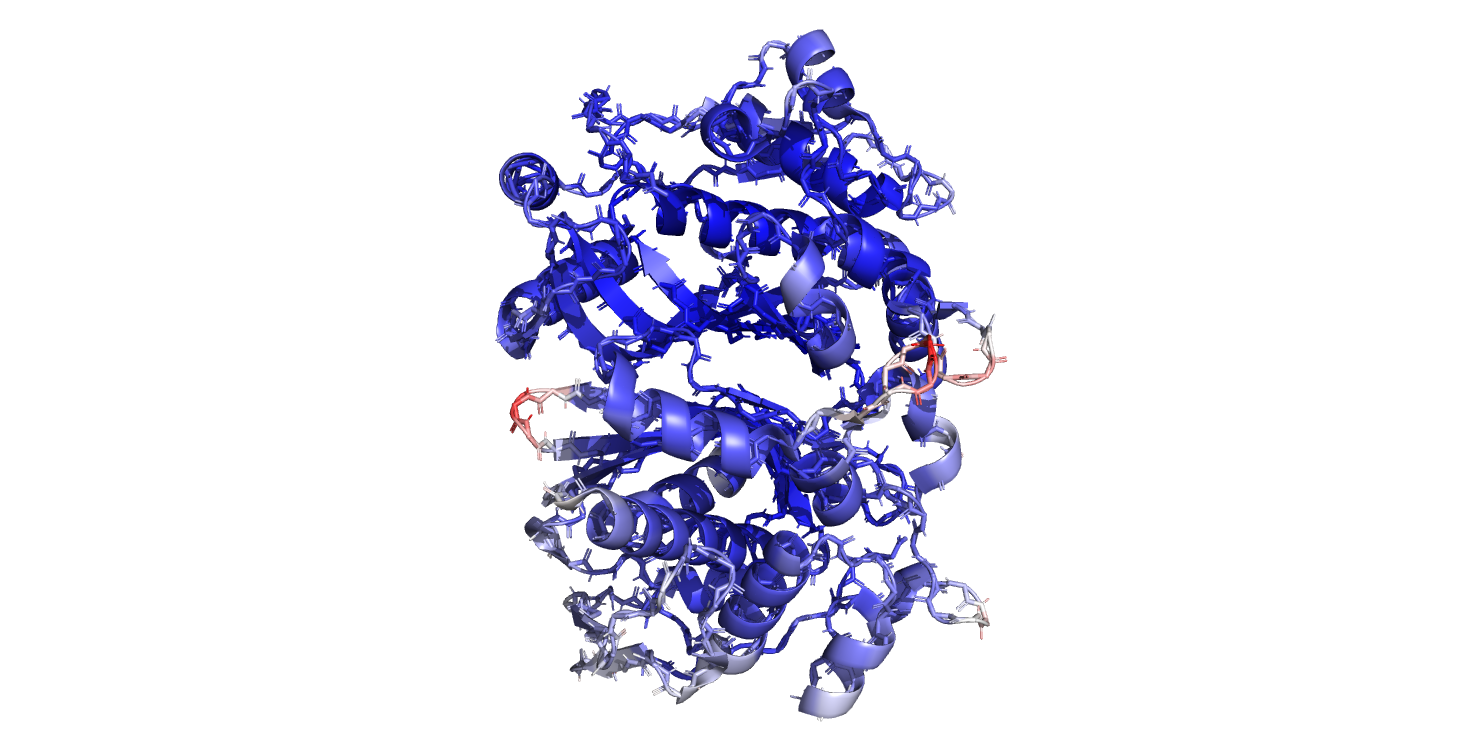
В этом задании также изучалась структура 6NNR. Сначала остов белка был покрашен по B-фактору (рис. 4). Здесь атомы с низким В-фактором покрашены синим, а с высоким – красным. Величина B-фактора отражает колебания атомов относительно их среднего положения, чем больше значения, тем выше подвижность. На рис.4 можно увидеть, что в основном атомы остова имеют низкие значения B-фактора, но есть и красные регионы с высокими значениями. Если наложить на стержневую модель отображение вторичных структур (cartoon) (рис.5), то станет понятно почему определённые части белка имею соответствующие значения В-фактора. Части остова, входящие в такие вторичные структуры как альфа-спирали и бета-листы имеют низкий В-фактор, поскольку эти структуры довольно стабильные и атомы слабо колеблются относительно их среднего положения. А вот красные и белые фрагменты остова не являются частью таких стабильных структур и обладают большей подвижностью, поэтому и имеют высокое значение В-фактора.
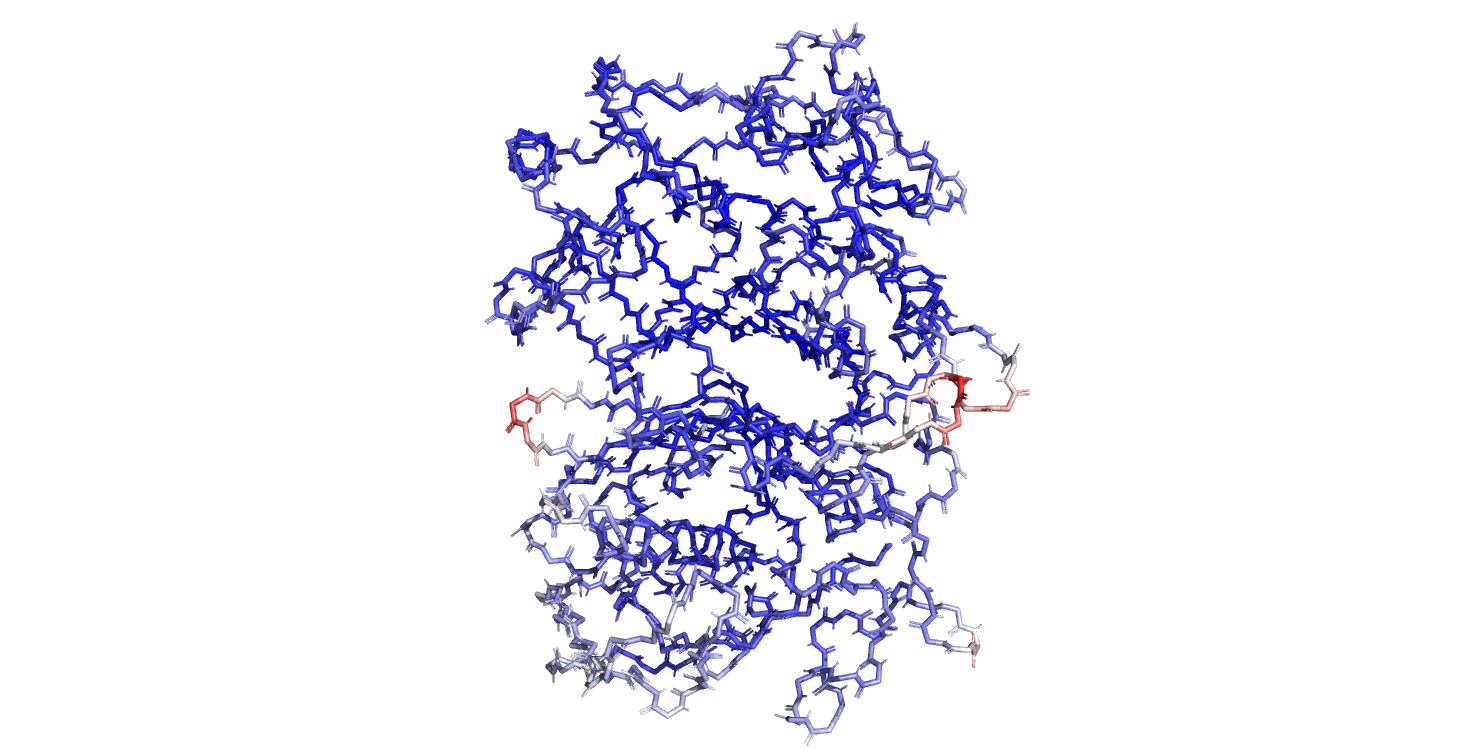
Далее по B-фактору были покрашены все атомы белка, включая боковые цепи.
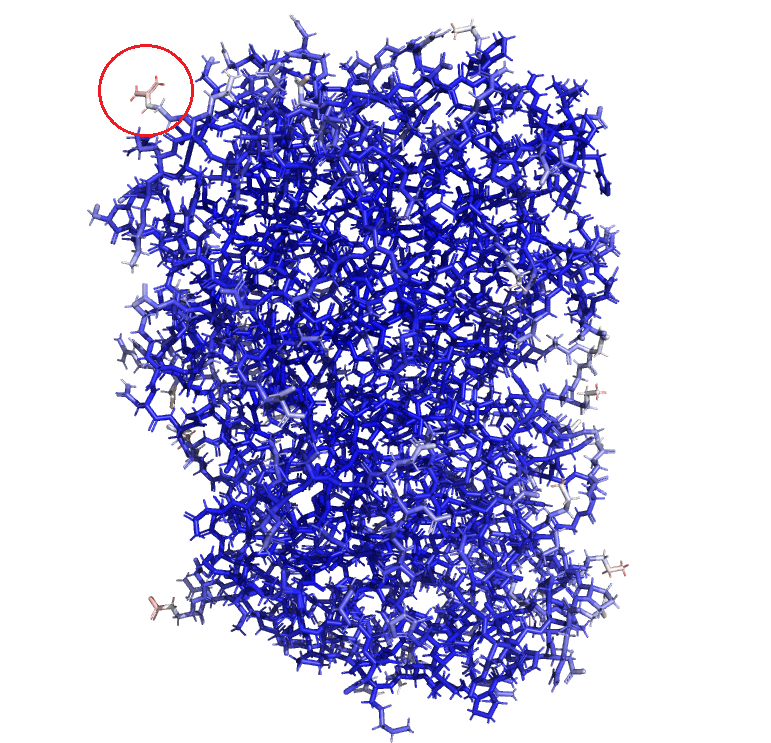
Был выбран остаток Arg-243, атомы бокового радикала которого заметно краснеют к его окончанию (рис.6),
т.е. они являются одними из самых подвижных в структуре, электронная плотность этих атомов наиболее ‘размазана’.
Если сравнить рис. 5 и 6, то можно заметить, что те части остова, которые были красными на рис. 5,
стали синими на рис.6. Получается, что высокие(красные) и низкие(синие) значения В-фактора определяются по максимальным и
минимальным В-факторам, имеющимся в структуре. Т.е. “высокая” подвижность фрагментов с рис.5 не сравнится с ещё более высокой
подвижностью и размазанностью ЭП боковых радикалов некоторых остатков. Насколько их электронная плотность размазана,
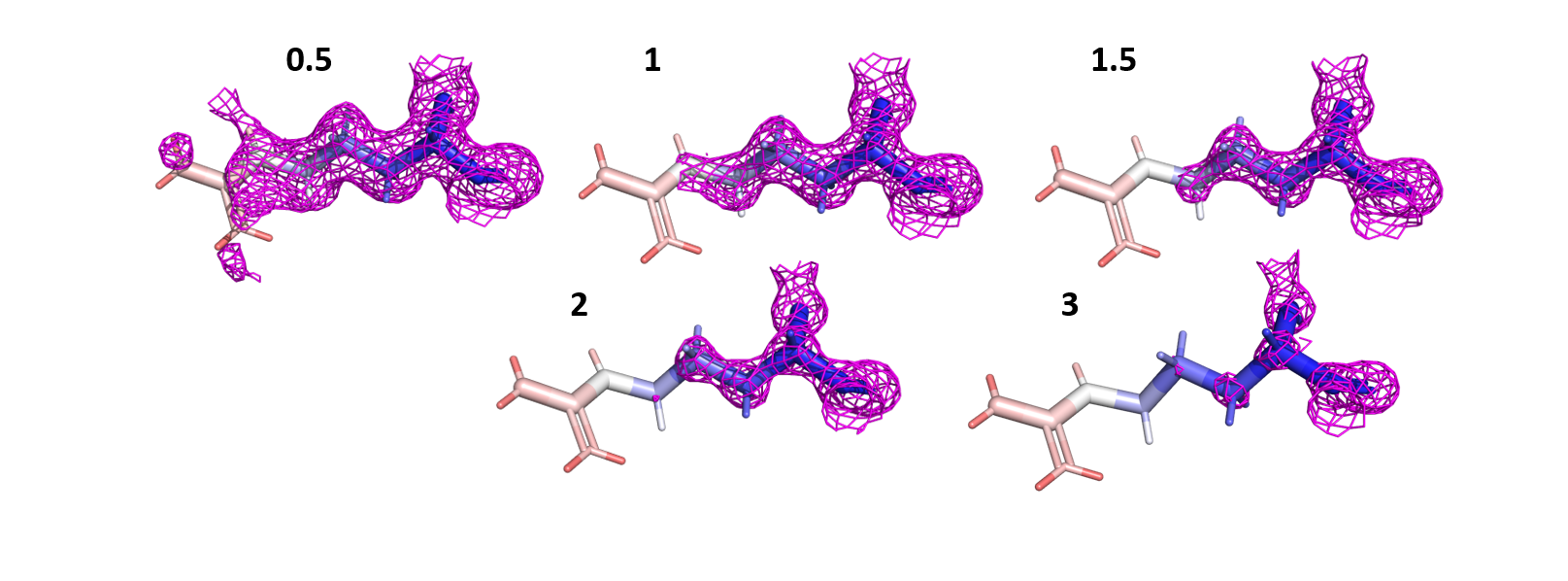
можно увидеть на рис.7. На нём представлена серия mesh-ей вокруг Arg-243 с разным значением подрезки.
При увеличении уровня подрезки ЭП начинает пропадать, сначала вокруг красных атомов, а затем белых.
Т.е. можно утверждать, что существует связь между величиной B-фактора рассматриваемых атомов и распределением их ЭП.
Соседи
В рентгеноструктурном эксперименте белок находится в составе кристалла, вокруг него есть соседи. Для визуализации кристалличности были сгенерированы соседи с отсечкой в 12 А (рис. 8).
Далее были оставлены только те соседи, которые касаются исходной молекулы белка (отсечка 6 А). Всего их оказалось 8. Они окружают исходную молекулу с двух сторон двумя “кольцами”, состоящими из 5-ти молекул белков, при этом две из них входят в состав другого кольца. (рис.9)