Практикум 5. ProDy-2. ЯМР vs РСА
Задание 1. Вводное
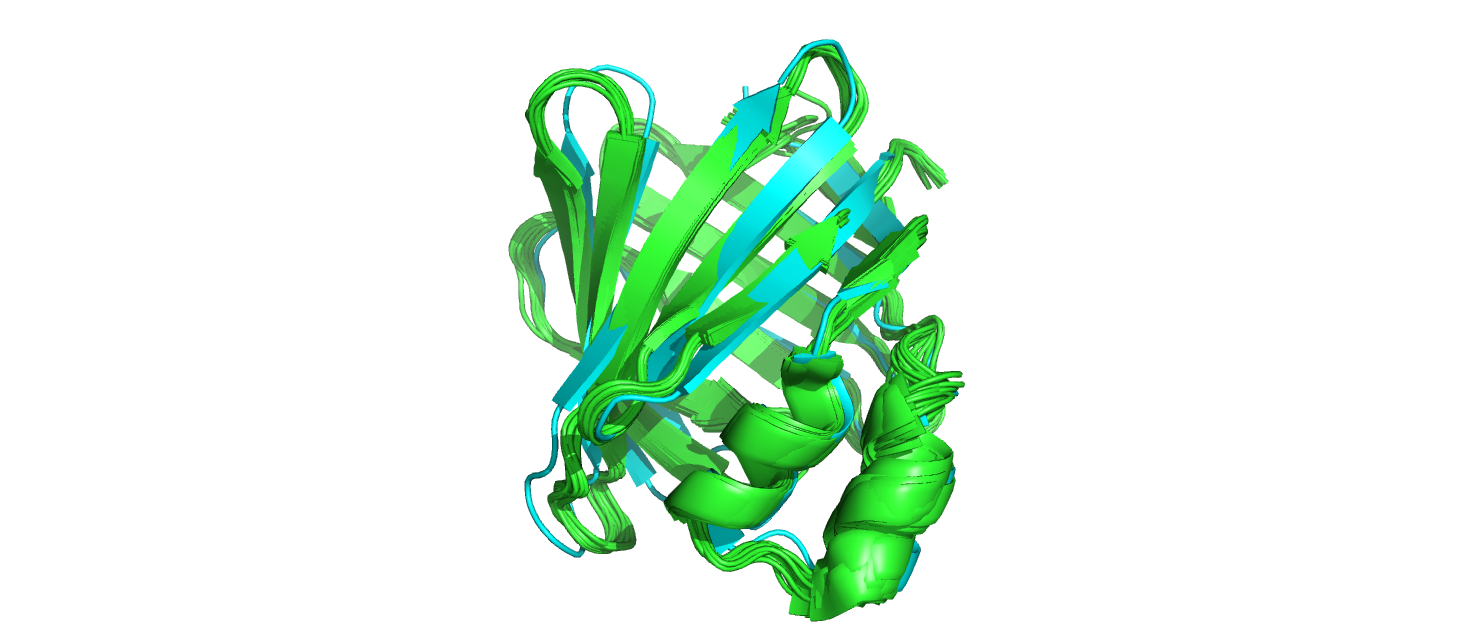
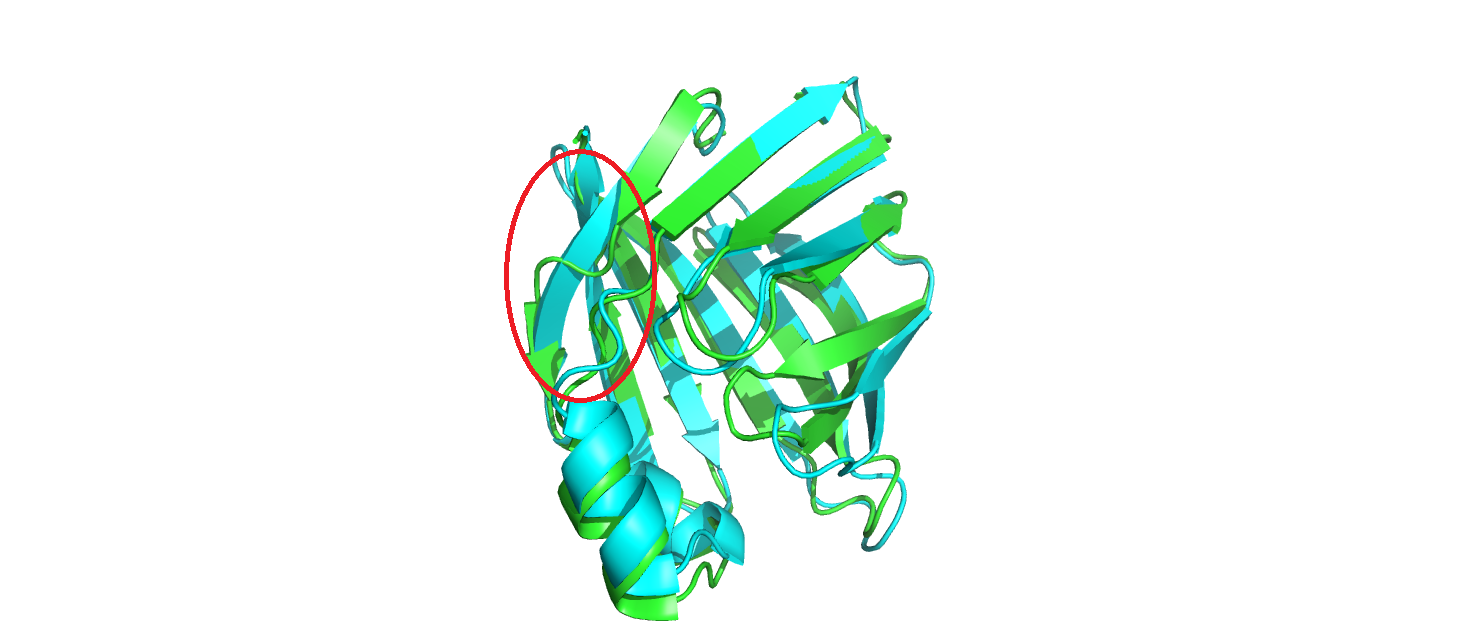
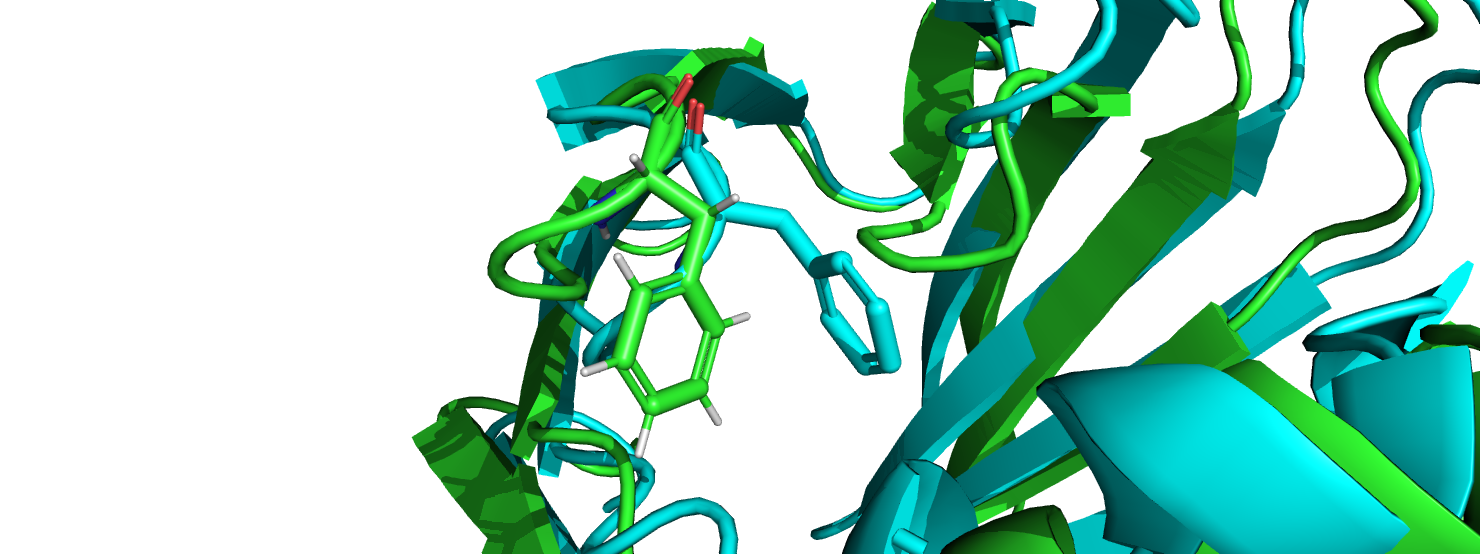
В этом практикуме были даны 2 структуры белка, связывающего жирные кислоты кишечника iFABP. Структура 3AKM получена методом РСА и имела разрешение 1.90 Å, а структура 6L7K – методом ЯМР и для неё в PDB было загружено 20 моделей. На рис.1 показаны выравненные структуры 3AKM (голубым) и 6L7K (зелёным). На макромолекулярном уровне структуры различаются в следующем: 2 бета-листа, соединённых нестрктурированным участком белка из структуры 6L7K(ЯМР), представлены одним длинным бета-листом(отмечено красным на рис.1) в 3AKM(PCA). И в целом многие бета-листы в РСА структуре немного длиннее аналогичных в ЯМР структуре. Также в структурах различаются положение боковых групп аминокислот на поверхности белка (рис.2). В структуре ЯМР присутствуют водороды (поскольку метод способен детектировать сигнал от атомов с половинчатым спином, как например у водорода), а в РСА нет.
Задание 2. RMSF
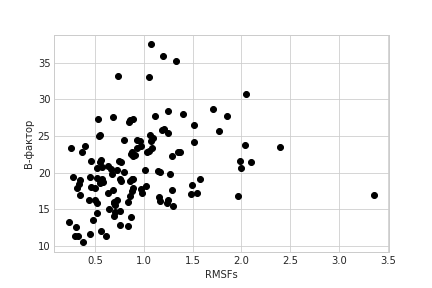
В данном задании изучалось насколько разница между моделями ЯМР структуры 6L7K обусловлена её подвижностью, а не техническим шумом. Для этого была вычислен показатель RMSF, являющийся мерой подвижности отдельных участков (атомов, остатков, петель) структуры. В идеальном случае, когда ансамбль моделей ЯМР отражает подвижности структуры со временем, то по нему можно вычислить значения B-факторов по формуле: Bi=((8*П^2)*RMSFi^2)/3. Средние значения В-фактора были вычислены по модели РСА 3AKM. Scatter-plot зависимости среднего B-фактора остатка от RMSF остатка приведена на рис.3. На рис.4 приведён тот же scatter-plot, но с функцией зависимости В-фактора от RMSF: Bi=((8*П^2)*RMSFi^2)/3. Исходя из рис. 3 и 4 можно сказать, что нужной нам зависимости нет, и различия в моделях ЯМР не обусловлены изменениями системы во времени.
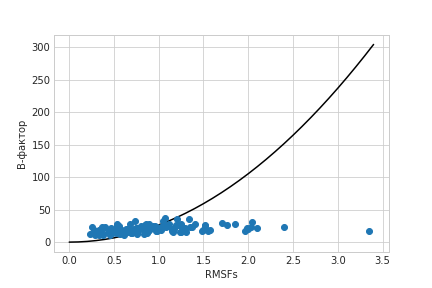
Bi=((8*П^2)*RMSFi^2)/3.
Задание 3.
В структуре, полученной методом РСА, были выбраны 3 водородные связи:
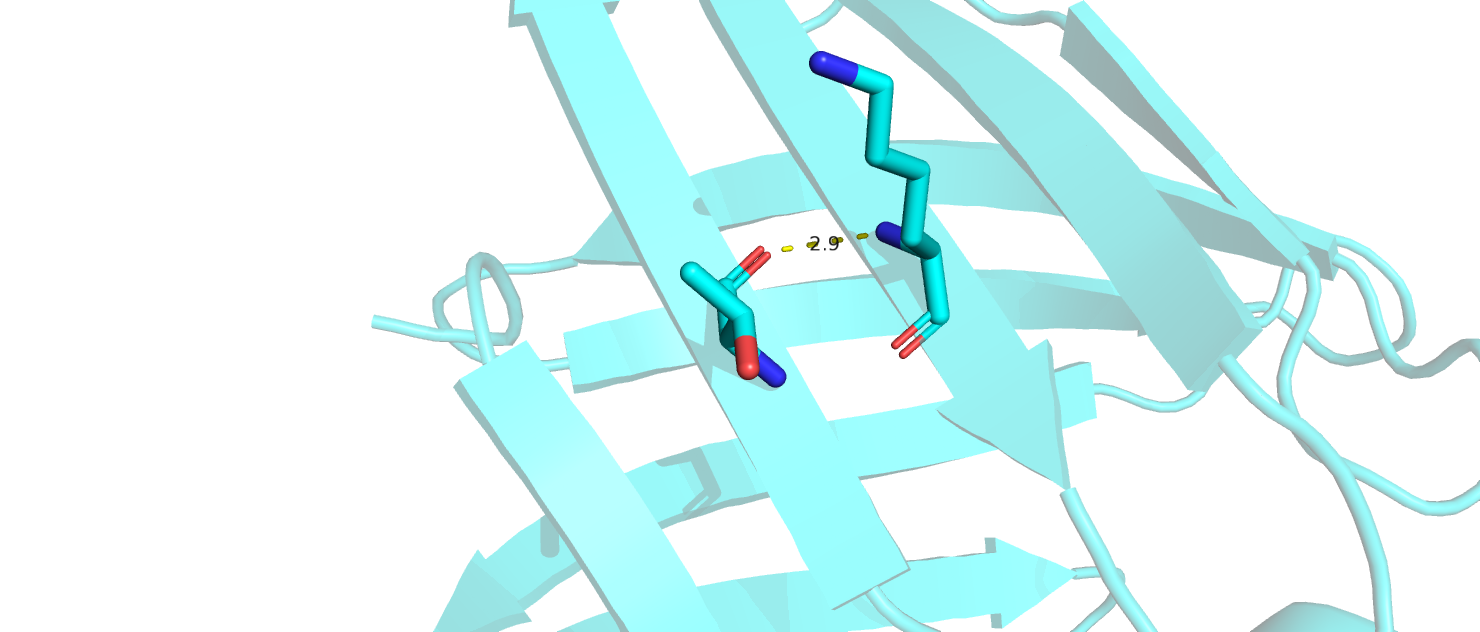
1)между атомами остова в ядре белка в бета-листе (рис.5). Водородная связь образуется между кислородом Thr 39 и азотом Lys50, она присутствует во всех ЯМР моделях.
2)водородная связь боковых цепей в ядре белка между Arg 106 (NE) и GLN 115 (OE1) (рис.6) присутствует только в 15% моделей ЯМР.

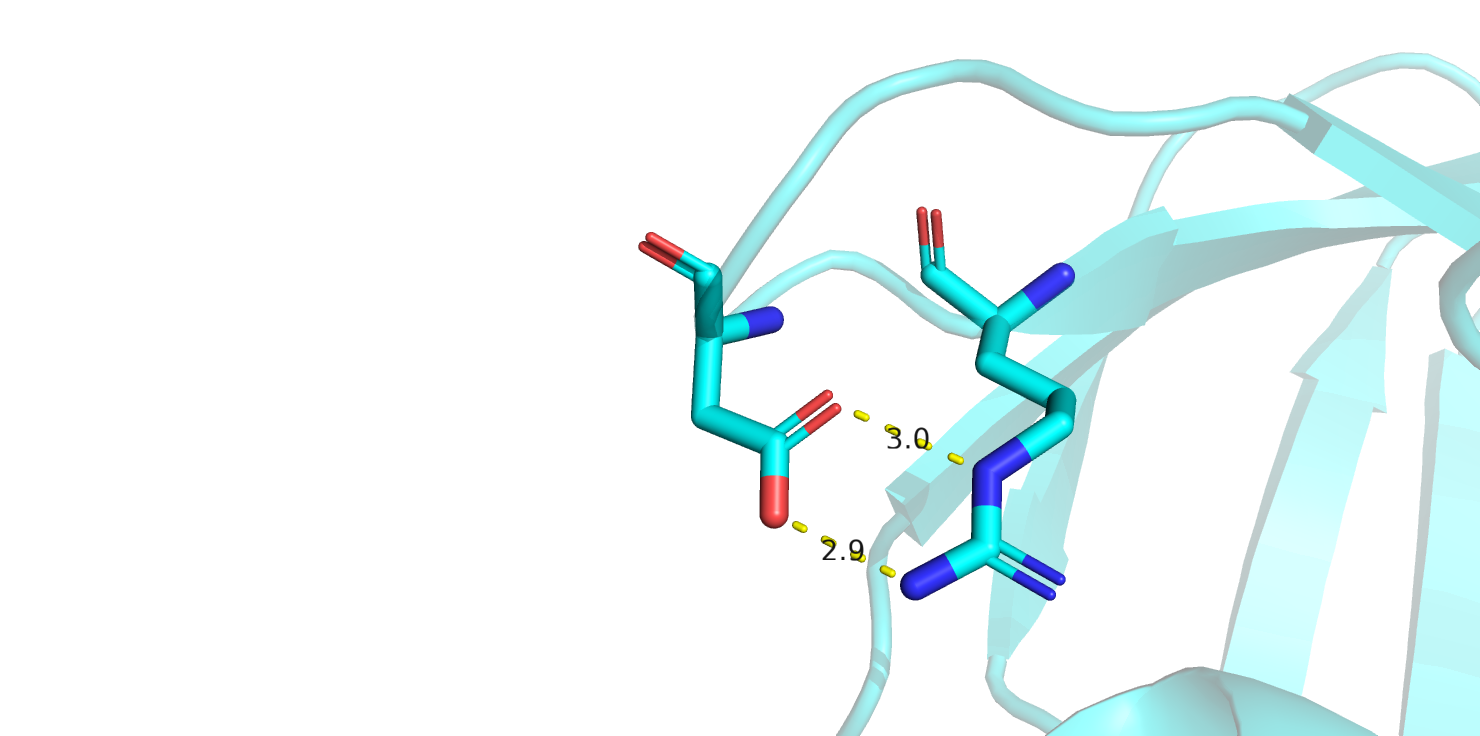
3)Две водородные связи в петле, выходящей на поверхность глобулы, между Arg 95(NH2) и Asp97(OD2) и Arg 95(NE) и Asp97(OD1) (рис.7). Обе связи не встречаются в ЯМР моделях.
В таблице ниже приведена характеристика этих связей.
| Водородная связь между остатками | Расстояние в РСА | % моделей ЯМР | Минимальное расстояние в ЯМР | Максимальное расстояние в ЯМР | Медиана расстояний в ЯМР |
| 1)Thr 39(O) - Lys 50(N) | 2.93709346 | 100 | 2.711099 | 2.87729 | 2.7514827 |
| 2)Arg 106 (NE) - GLN 115 (OE1). | 2.7778 | 15 | 2.4715 | 8.1486 | 4.7781 |
| 3)Arg 95(NH2) - Asp97(OD2) | 2.8867 | 0 | 4.6077 | 8.3903 | 6.7851 |
| 4)Arg 95(NE) и Asp97(OD1)d> | 2.97467 | 0 | 3.62581 | 6.79555 | 5.60947 |
Таким образом, водородная связь между атомами остова в бета-листе сохранялась во всех моделях ЯМР, т.к. там меньше подвижность атомов. Связь между боковыми цепями в ядре белка встречалась всего лишь в 15% моделей, в то время как связь между остатками на поврехности белка не образовалась ни в одной модели. Вероятно это обусловлено большей подвижность остатков по сравнению с РСА, поскольку в ЯМР белок находится в растворе, а не в кристалле.


