Практикум 9. Структура и функция
Введение
Для выполнения данного практикума мне был предложен белок (Uniprot id= M3YQX8) Ras homolog family member A из организма Mustela furo (домашний хорёк).
Рассматриваемый белок принадлежит к семейству ГТФаз. В составе белка имеется
эффекторный домен и четыре отдельных участка связывания гуанозинфосфата.
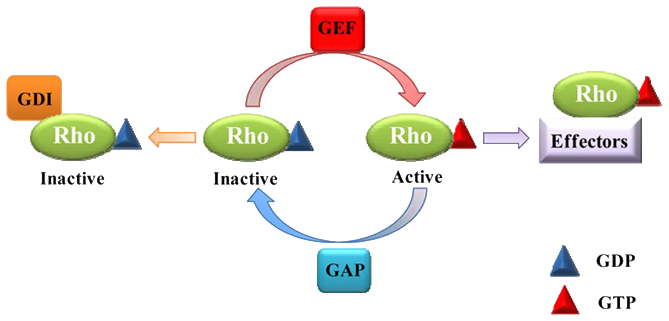
Эффекторный домен участвует в изменении конформации между двумя состояниями :
связанное с GTP и связанное с GDP. Rho GTPазы колеблются между этим двумя
состояниями: с GTP(активное) и c GDP(неактивное). Данный цикл контролируется двумя
типами регуляторных белков: 1)GEFs - guanine nucleotide-exchange factors
(активирует Rho GTPазу за счёт катализа обмена GDP на GTP) и 2)GAPs - GTPase-activating
proteins (инактивирует GTPазу за счёт усиления внутренней GTP гидролазной
активности). Также активность RhoA котролируется ингибитором диссоциации гуаниновых
нуклеотидов (GDI). Активный RhoА действует на свои последующие эффекторные белки,
стимулируя различные клеточные процессы. (рис.1)
Таким образом, в рассматриваемом белке есть несколько участков связывания,
на которые нужно будет в первую очередь обратить внимание при анализе мутаций:
участок связывания GTP/GDP, участок связывания эффекторов, GEFs и GAPs
(судя по литературе находятся в районе позиций 27-40 и 59-78).[источник]
Поиск гомологичной PDB структуры c помощью blast
С помощью protein blast были найдены гомологи исследуемого белка. Находок оказалось много, с только 100% идентичностью – 14 шт, все из homo sapiens. Многие структуры находятся в комплексе с GDI, GEF или GAP, а некоторые имеют в составе GDP. В качестве основной структуры была выбрана 6r3v – это комплекс изучаемого белка RhoA, в активном центре которого находится GDP и Pi, и белка RhoGAP.
Структурный поиск PDBeFold
PDBeFold выдал много структур (1871), некоторых топовых структур не оказалось в выдаче blast, но они не показались мне полезными. Поэтому я решила остановиться только на 6r3v.
Анализ мутаций
Мне было дано 3 мутации K120R, Q65E, C85V. Нумерация остатков структуры Uniprot и 6r3v совпадают, чего не скажешь о нумерации выданных мне мутаций, которая отличается на 2. Т.е. смотрим на такие мутации K118R, Q63E, C83V.
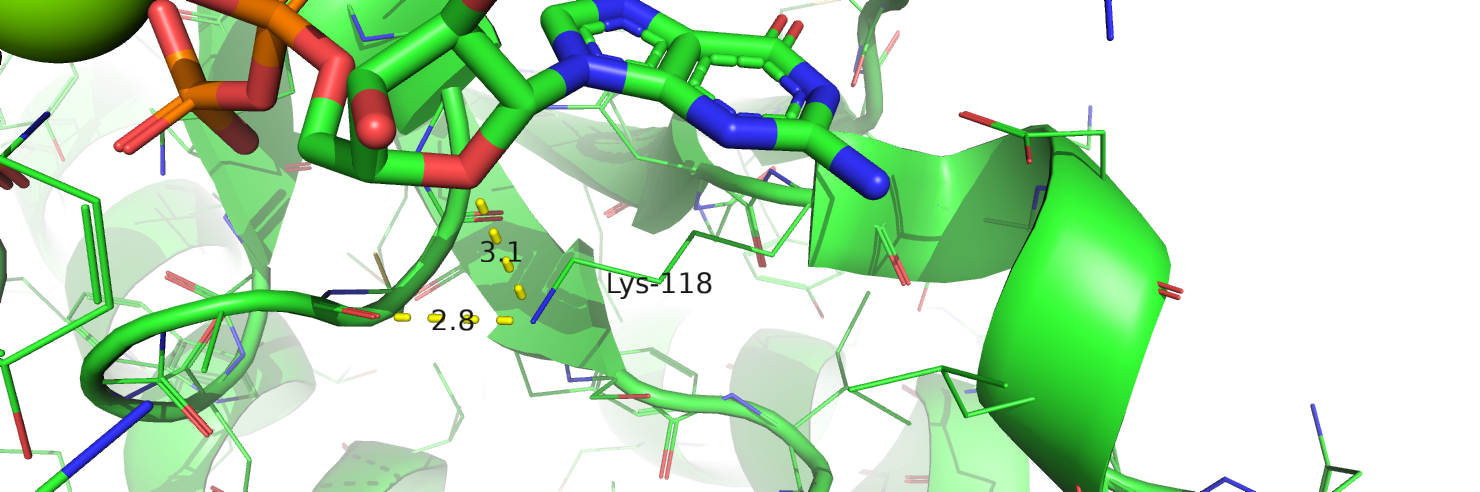
1) K118R (рис.2)
Lys образует две водородные связи: одну с остовом белка, вторую – слабую с ГДФ. Далее была проведена замена на аргинин (strain ~22) и релаксация структуры. В результате обе водородные связи остались, а связь с ГДФ стала даже сильнее (уменьшилось расстояние). Благодаря усиленной связи с ГДФ субстрат будет лучше держаться в активном центре, поэтому, на мой взгляд, рассматриваемая мутация будет иметь положительный эффект.
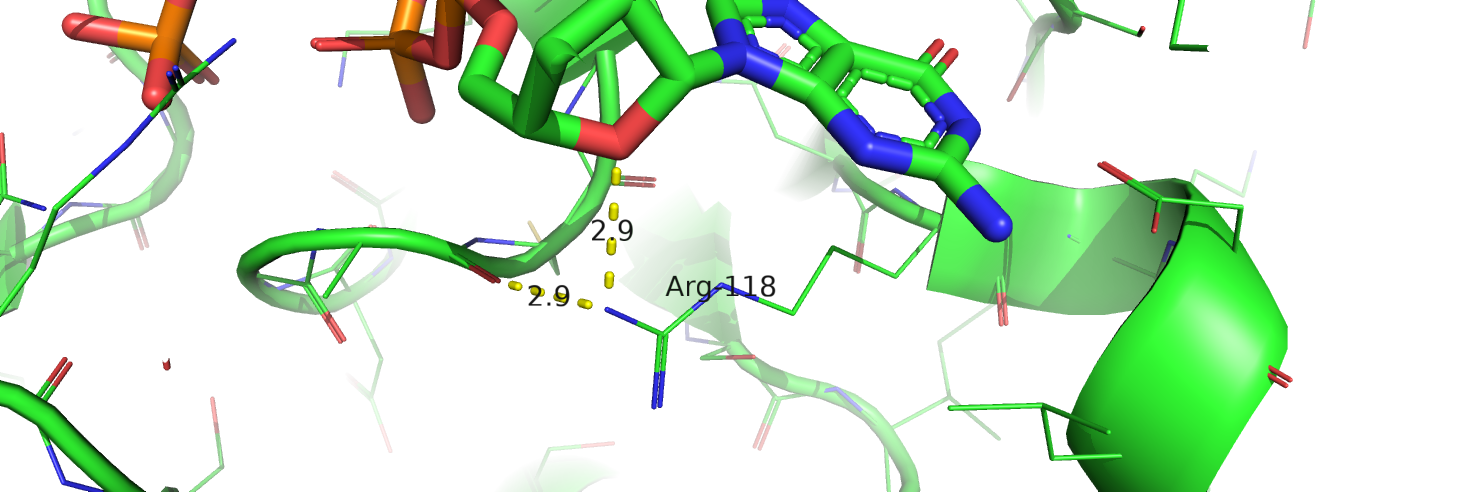
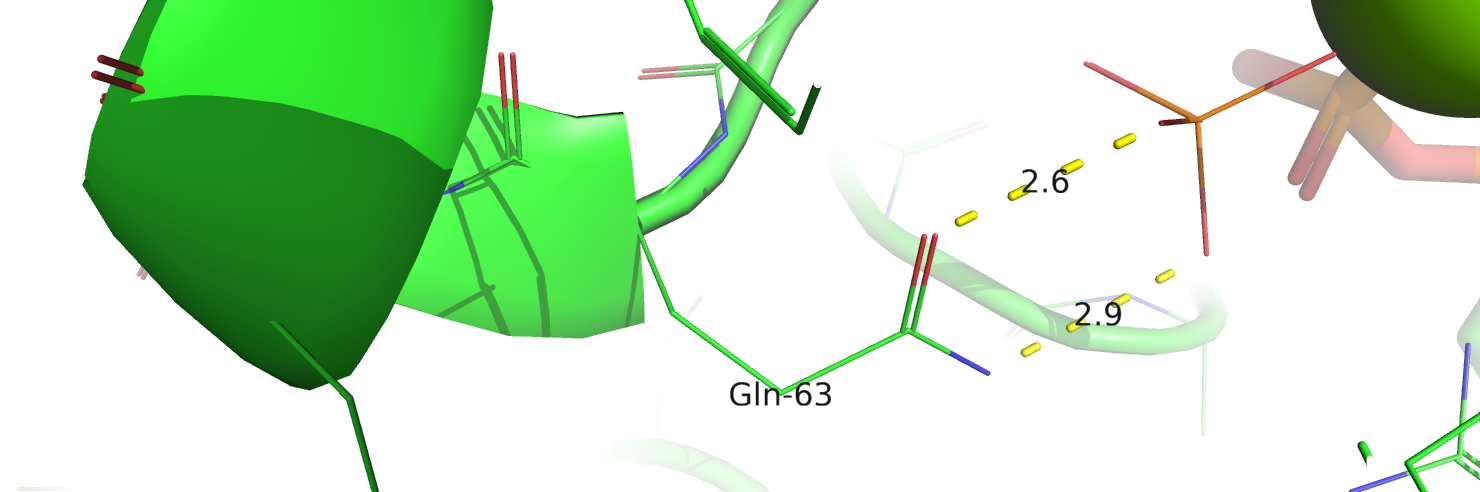
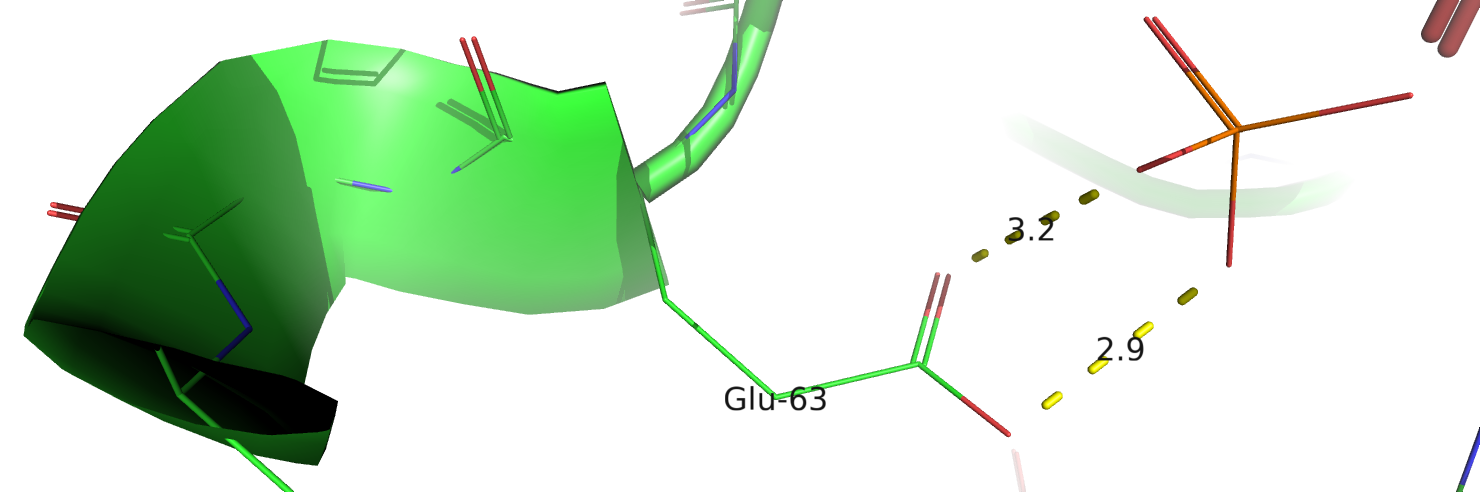
2) Q63E (рис.3)
Глутамин образует две водородные связи с уходящим фосфатом, после замены на глутаминовую кислоту эти связи остаются в случаях, когда остаётся водород на глутамате или фосфате. Получается, что оптимальный диапозон pH уменьшился и сдвинулся в кислую область. Таким образом, эту мутацию нельзя назвать полностью нейтральной, в нейтральных и щелочных pH она будет иметь негативный эффект.
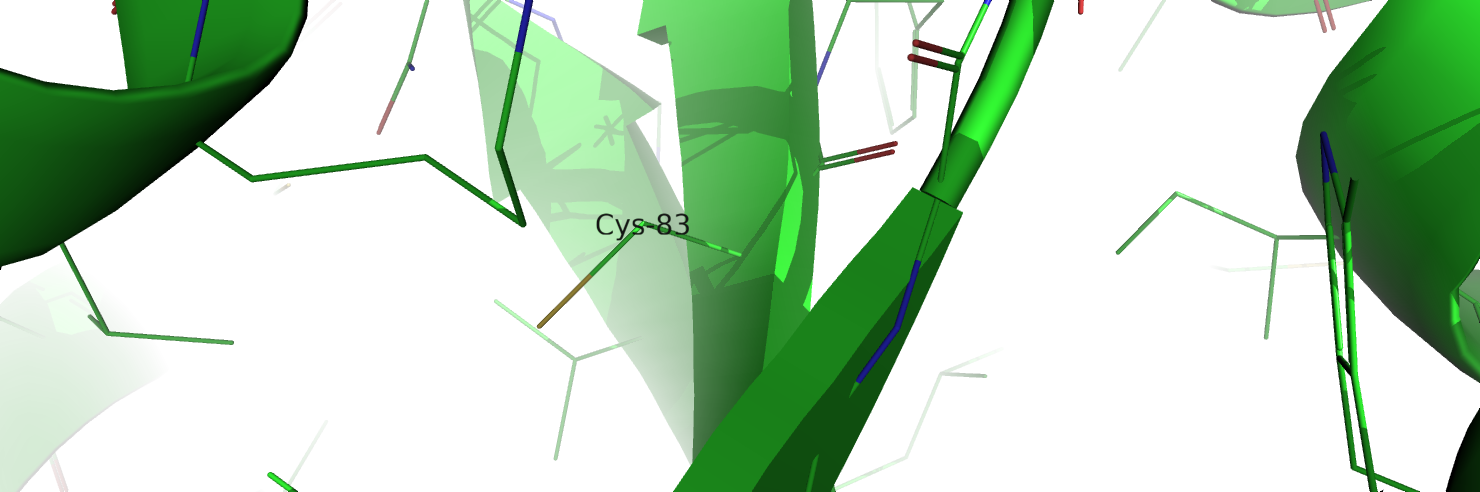
3) C83V (рис.4)
Цистеин не образует связей, просто заполняет пространство.
Замена на неполярный валин не вызывает никаких клэшей. Мутация нейтральная.