Обзор генома Teredinibacter purpureus
Автор:
Муравлев Артём Вячеславович
Резюме:
Teredinibacter purpureus — симбиотическая бактерия корабельного червя Bankia setacea, открытая в 2021 году. Бактерии рода Teredinibacter— важные симбионты этих необычных двустворчатых моллюсков, позволяющие им переваривать целлюлозу. В данном обзоре исследуется длина белков, распределение типов кодирующих последовательностей по репликонам и опероны Teredinibacter purpureus, далее делаются выводы об экспрессии целлюлаз и способности к рекомбинации у данной бактерии.
Введение:
Teredinibacter purpureus— эндосимбиотическая бактерия, обнаруженная на жабрах двустворчатого моллюска Bankia setacea. Bankia setacea принадлежит к таксону Teredinidae — корабельные черви. Teridinidae - известный таксон двустворчатых моллюсков, адаптировавшихся к жизни внутри древесины, попадающей в океан [1]. В отличие от многих двустворчатых моллюсков, заглублящихся в тот или иной твердый субстрат для использования его в качестве укрытия, Teridinidae используют древесину как пищу, таким образом являясь одними из немногих Metazoa, способных на это [1]. Переваривание древесины у корабельных червей происходит в специальном выросте пищеварительного тракта, открывающемся в желудок - цекуме, а также в дивертикулах слюнных желез [1]. Главную роль в переваривании основных компонентов древесины - целлюлозы и лигнина - играют ферменты, выделяемые симбиотическими бактериями [2]. Но сами эти бактерии, что интересно, располагаются не в пищеварительном тракте, а внутри особых клеток — бактериоцитов, располагающихся в специальных компартментах в жабрах моллюска, называемых железами Деэ [2]. По отходящим от них каналам Деэ ферменты попадают в пищеварительный тракт, к местам переваривания древесины [2]. Основными целлюлозоразлагающими симбионтами корабельных червей являются гаммапротеобактерии рода Teridinibacter [2]. Исследуемая в данном обзоре бактерия Teridinibacter purpureus была выделена из жабр корабельного червя Bankia setacea и описана в 2021 году [3]. Ее геном состоит из кольцевой хромосомы(4 643 613 bp) и крупной плазмиды Bs12_MP(249 483 bp) [1]. Плазмида, что интересно, содержит копию гена, кодирующего белок recA, участвующий у многих бактерий в гомологичной рекомбинации ДНК при репарации и трансформации [3]. Обычно ген recA находится в бактериальной хромосоме, но, что необычно, в данном случае он располагается в плазмиде. Данный ген наиболее похож на ген recA Marinobacter confluentis, грамотрицательной липолитической бактерии, обитающей на стыке пресных вод и океана. Предполагается, что Teridinibacter purpureus получила свою плазмиду с помощью горизонтального переноса генов [3]. В данном обзоре изучались некоторые характеристики Teredinibacter purpureus, а именно длины синтезируемых белков и распределение различных типов кодирующих последовательностей по репликонам. Также были предсказаны возможные опероны данной бактерии. Исходя из данных оперонов были сделаны предположения о возможных механизмах регуляции экспрессии целлюлаз у Teredinibacter purpureus и о значении плазмиды Bs12_MP для рекомбинации этой бактерии.
Систематическое положение объекта: Bacteria Pseudomonadota Gammaproteobacteria Cellvibrionales Cellvibrionacea Teredinibacter purpureus
Материалы и методы
Данные
Таблица особенностей генома бактерии Teredinibacter purpureus была загружена из базы данных NCBI Genome (https://ftp.ncbi.nlm.nih.gov/genomes/all/GCF/014/217/335/GCF_014217335.1_ASM1421733v1/GCF_014217335.1_ASM1421733v1_feature_table.txt.gz). Таблица была импортирована в Google Sheets (С1), где проводилась дальнейшая работа с данными. Данные с результатами исследований содержатся на соответствующих страницах(указано ниже). На странице feature_table содержатся изначальные данные. На страницах protein_cds и tmp производились промежуточные операции. Страница comments оставлена под комментирование.
1)Получение гистограммы длин белков
Для получения гистограммы длин белков был взят столбец product_length исходной таблицы. Далее на отдельной странице в таблице были сгенерированы числа, служащие границами диапазонов длин белков. Туда же был скопирован столбец, содержащий длины продуцируемых бактерией белков. Далее на основании полученных чисел с помощью соединения текстов были сгенерированы диапазоны длиной 100 аминокислотных остатков. После этого с помощью метода гугл-таблиц COUNTIFS были подсчитаны количества белков, попадающих в каждый диапазон, на основании чего в той же таблице была построена гистограмма, в которой ось абсцисс - диапазоны длин белков, а ось ординат - количество таких белков. Данная гистограмма приведена ниже в разделе “Результаты”, также она, как и данные, использовавшиеся при ее построении, представлена на странице proteins-length-hist.
2)Исследование распределения кодирующих последовательностей по репликонам
На отдельную странице в таблице были скопированы столбцы, характеризующие репликоны(названия и идентификаторы). Далее были созданы столбцы для каждого из типов продуктов, кодируемых генами бактерии. После этого в каждом из этих столбцов были записаны значения количества продуктов того или иного типа для каждого из оперонов, полученные с помощью метода COUNTIFS, примененного к данным с основной страницы таблицы(feature_table). Результаты представлены в таблице на странице per-replicones.
3)Предсказание оперонов на + и - цепях хромосомы и плазмиды для белок-кодирующих последовательностей
На четыре отдельные страницы(для + и - цепи хромосомы и плазмиды соответственно) в таблице были скопированы столбцы с идентификаторами, названиями белков, координатами начала и конца в геноме, цепью и репликонами. В данном исследовании рассматривались только последовательности, имеющие белок. Далее значения координат начала и конца у идущих подряд генов сравнивались. Значением, выбранным достаточным для того, чтобы можно было считать гены данных белков входящими в один оперон, было выбрано 50 нуклеотидов. Если разность между концами соседних генов была меньше или равна 50, они считались гипотетически принадлежащими к одному оперону. Сравнение проводилось с помощью метода гугл-таблиц IFS, результаты выводились в отдельный столбец. Если ген не входил ни в один гипотетический оперон, ему присваивалось значение n. Если ген входил в оперон, но не был первым или последним в нем, ему присваивалось значение y. Если ген был первым в своем опероне, ему присваивалось значение by, а если последним — значение yb. Полученные результаты представлены в таблице на страницах operone+_chromosome, operone-_chromosome, operone+_plasmid и operone-_plasmid соответственно.
Далее найденные опероны были проанализированы с использованием информации о белках, синтезируемых с них, из открытых источников. Часть из них описана в разделе “Результаты”.
Результаты
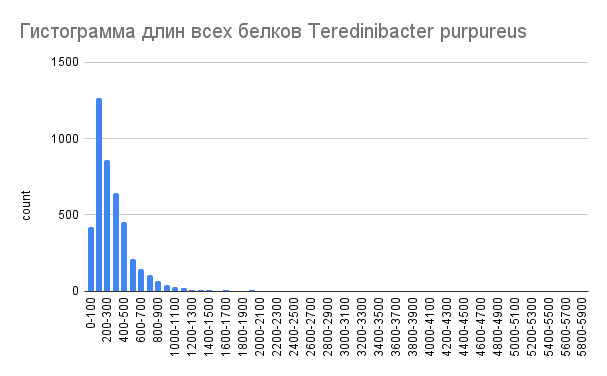
1)Гистограмма длин белков
Была получена гистограмма длин белков(рис.1) Из гистограммы можно видеть, что наиболее распространены белки длины 100-200 аминокислот. Длину в 1800 аминокислот превысили 15 белков.
2) Подсчет различных типов кодирующих последовательностей в репликонах
Результаты подсчета различных типов генов в репликонах представлены в таблице 1. На плазмиде нет генов, кодирующих различные РНК, и гораздо меньше белок-кодирующих последовательностей, нежели на хромосоме(266 против 4090), что является обычным для бактерий. На хромосоме найдены 6 генов рРНК, 38 генов тРНК, 1 ген тмРНК и 3 гена некодирующих РНК.
Таблица 1. Кодирующие последовательности репликонов Teredinibacter purpureus
| genomic_accession | seq_type | chromosome | CDS | ncRNA | rRNA | tRNA | tmRNA |
|---|---|---|---|---|---|---|---|
| NZ_CP060092.1 | chromosome | 4090 | 3 | 6 | 38 | 1 | |
| NZ_CP060092.1 | plasmid | Bs12_MP | 266 | 0 | 0 | 0 | 0 |
3) Предсказание оперонов
Было предсказано 725 оперона, многие из них содержали только два гена. Со всеми предсказанными оперонами можно ознакомиться в гугл-таблице на страницах, указанных в разделе “Материалы и методы”. Подробно будут обсуждаться только некоторые опероны, которые приведены в отдельном перечне(C2).
Опероны хромосомы(плюс-цепь)
Было обнаружен оперон, содержащий гены гликозилтрансфераз или родственных им белков(C2, Таблица 2 ). На этой цепи обнаружен один из трех в этой хромосоме оперонов, содержащих в себе целлюлазу, вместе с ней в опероне присутствует ген белка 50S-рибосомы L28(С2, Таблица 1).
Опероны хромосомы(минус-цепь)
На минус-цепи найдены два оперона, содержащих гены целлюлаз. Вместе с ними в одном случае в том же опероне располагаются ген субъединицы RND-транспортера и ген эпимеразы/изомеразы системы AGE(С2, Таблица 3), а в другом - ген белка семейства YceD(С2, Таблица 7). Были опероны, содержащие гены гликозид-гидроксилаз и эндо-1,4-бета ксиланаз(С2, Таблица 4 и Таблица 5). Был обнаружен локус с подряд идущими генами целлюлаз, других гликозил-гидроксилаз и гликозид-гидроксилаз, из которых, однако, только один ген гликозид-гидроксилазы входил в состав оперона(с геном белка с доменом VWA)(С2, Таблица 6).
Обсуждение результатов исследования хромосомы
Опероны в хромосоме нередко содержат гены белков одного метаболического пути(либо же субъединиц одного белка). Обнаружено несколько оперонов, содержащих гены целлюлаз, гликозил-гидроксилаз, гликозид-гидроксилаз и ксиланаз, а также локус с генами целлюлаз и гликозид-гидроксилаз, не соединенных в опероны. Все это позволяет предположить возможность тонкой регуляции экспрессии данных ферментов, вероятно участвующих в разложении древесины, и соответственно возможность подстраивать переваривание древесины корабельным червем под те или иные условия.
Опероны плазмиды(плюс-цепь)
На плюс-цепи найдено два оперона, содержащих ген белка с мотивом “спираль-поворот-спираль” и ген неизвестного белка(C2, Таблица 8 и Таблица 9). Обнаружен крупный оперон, содержащий ген ДНК-топоизомеразы III, транс-гликозилазы и несколько неизвестных белков(C2, Таблица 10). Ген, кодирующий белок RecA находится на плюс-цепи, но не входит ни в один оперон.
Опероны плазмиды(минус-цепь)
Обнаружено несколько оперонов, содержащих гены ферментов, использующих ДНК или РНК как субстрат, а именно: DEAD/DEAH box хеликазы(C2, таблица 11), сайт-специфичной интегразы(в одном опероне с белком с HNH мотивом, обычным для эндонуклеаз)(C2, таблица 12), термонуклеазы(C2, таблица 11).
Обсуждение результатов анализа плазмиды
Плазмида Bs12_MP содержит несколько оперонов с белками, скорее всего связанными с взаимодействием с ДНК, в частности, вероятно, с рекомбинацией(оперон, содержащий термонуклеазу; оперон, содержащий сайт-специфическую интегразу и белок с мотивом HNH). Также, вероятно, опероны с белками, имеющие домены “спираль-поворот-спираль”, тоже имеют своим предназначением взаимодействие с ДНК(так как это один из самых распространенных ДНК-связывающих мотивов). К тому же, как было известно и ранее, плазмида содержит копию гена белка RecA, участвующего в гомологичной рекомбинации. К сожалению, немалая часть белков, закодированных в данной плазмиде, не определена. Дальнейшее исследование данной плазмиды может дать много информации о механизмах рекомбинации Teredinibacter purpureus.
Заключение
Teredinibacter purpureus — интересная, открытая недавно бактерия, дальнейшее исследование генома и протеома которой может дать много информации как о самой этой бактерии и всем роде Teridinibacter, так и об их необычных хозяевах — корабельных червях Teridinidae и их редкой среди Metazoa способности переваривать древесину.
Сопроводительные материалы
С1)Таблица Google Sheets с расчетами. https://docs.google.com/spreadsheets/d/18LrqXL8Kx6MsKmwFjescez2odG5XP5yytkybCSR1gQo/edit#gid=614562386
С2)Перечень оперонов, найденных в геноме бактерии Teredinibacter purpureus https://docs.google.com/document/d/1dYl-MOW0ZI6Zfdu8_9TWUxSJb1r-1OZXJT-AJd4-xnc/edit
Список литературы
1)Зоология беспозвоночных: Функциональные и эволюционные аспекты : учебник для студ. вузов : в 4 т. Т. 2. Низшие целомические животные / Эдвард Э. Рупперт, А.И.Грановича, Н.В.Ленцман, Е.В.Сабанеевой; под ред. А.А.Добровольского и А. И. Грановича. — М. : Издательский центр «Академия», 2008. — 448 с.
2) Marvin A. Altamia, J. Reuben Shipway, David Stein, Meghan A. Betcher, Jennifer M. Fung, Guillaume Jospin, Jonathan Eisen, Margo G. Haygood, and Daniel L. Distel; Teredinibacter haidensis sp. nov., Teredinibacter purpureus sp. nov. and Teredinibacter franksiae sp. nov., marine, cellulolytic endosymbiotic bacteria isolated from the gills of the wood-boring mollusc Bankia setacea (Bivalvia: Teredinidae) and emended description of the genus Teredinibacter; Int J Syst Evol Microbiol. 2021 Feb; 71(2): 004627.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8346767/3)Marvin A. Altamia; Transport of symbiont-encoded cellulases from the gill to the gut of shipworms via the enigmatic ducts of Deshayes: a 174-year mystery solved; Proc Biol Sci. November 9, 2022; 289(1986): 20221478. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9653257/