Электронная плотность
ЭП: хорошая и плохая расшифровки
В этом задании мне предстояло сравнить две кристаллографические расшифровки с PDB ID 7JKY и 6X7C. Они соответствуют структуре бромдомена 1 бромдоменсодержащего белка 4. В таблице ниже приведено сравнение характеристик этих расшифровок.
| 7JKY | 6X7C | |
|---|---|---|
| Разрешение | 1.16 Å | 2.70 Å |
| Размер домена | 15.76 kDa (127 а.к.) | 16.36 kDa (134 а.к.) |
| Количество альфа-спиралей | 4 длинные + 3 короткие | 4 длинные + 2 короткие |
| Количество цепей | 1 | 1 |
Ниже представлены изображения структур:
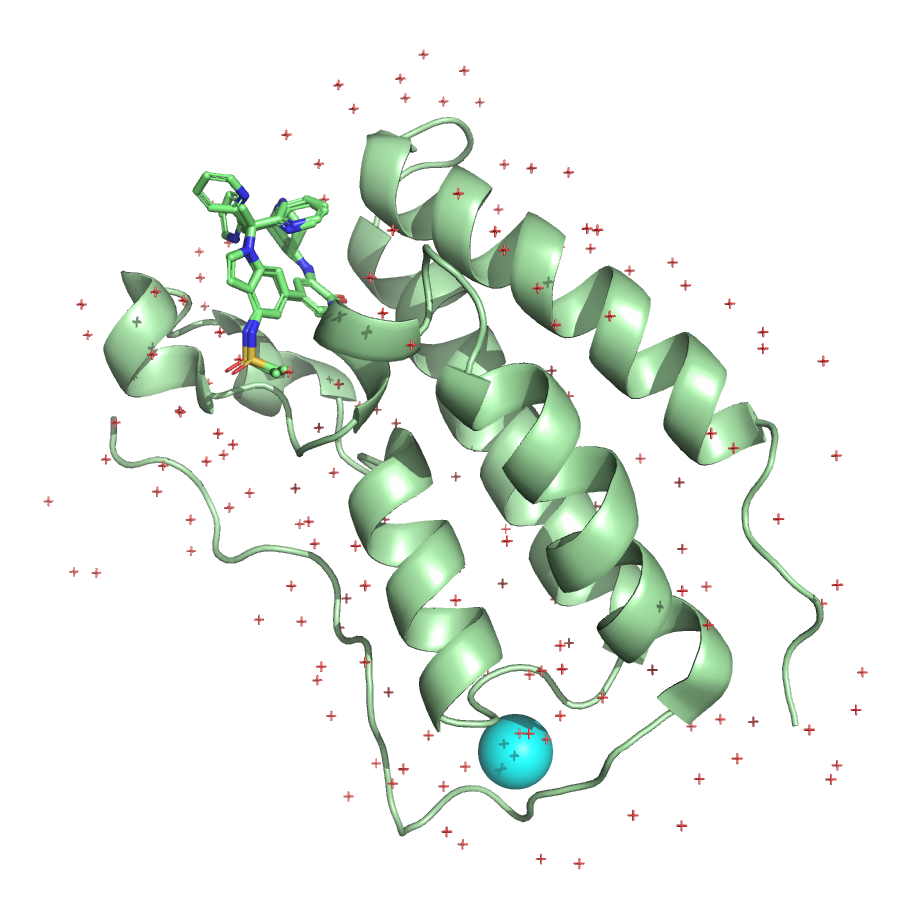
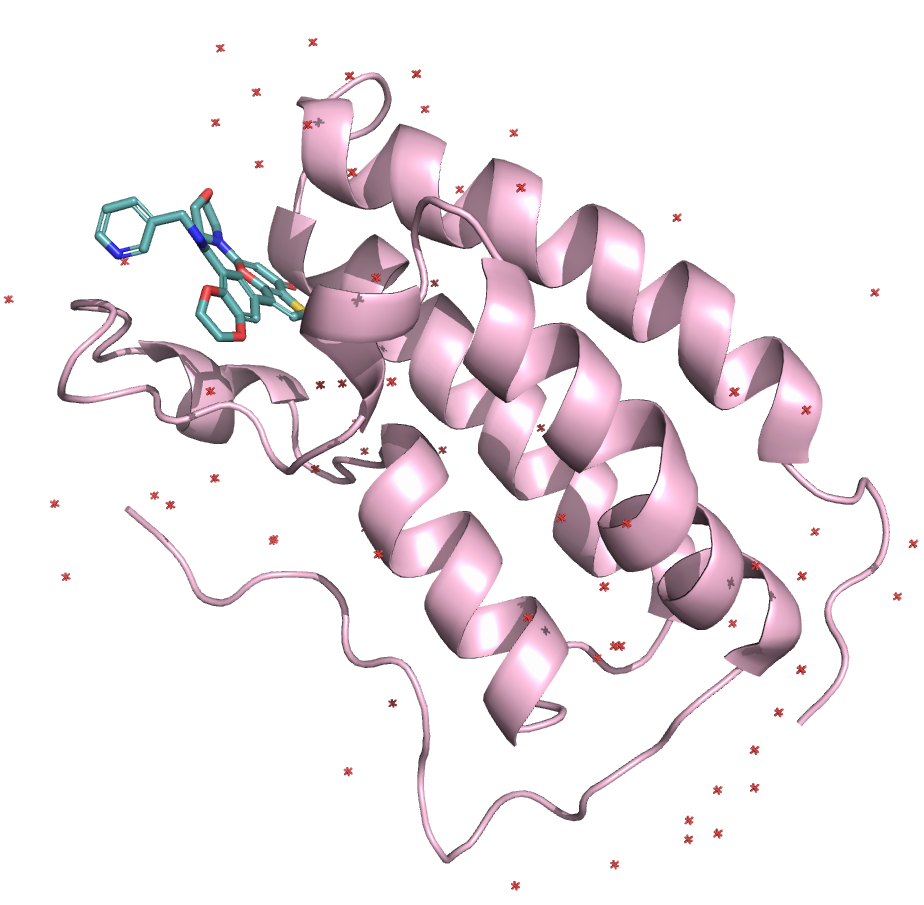
Чтобы лучше оценить соответствие структур, были построены выравнивания полных структур, а также без молекул воды и лигандов.
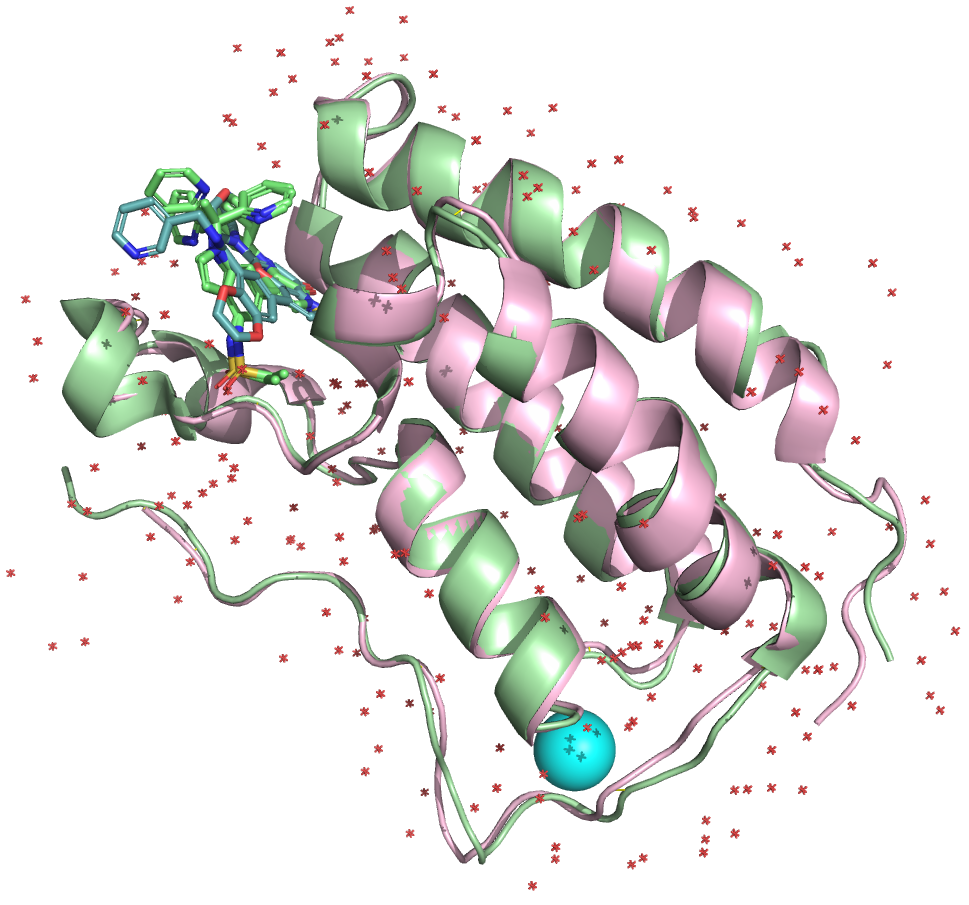
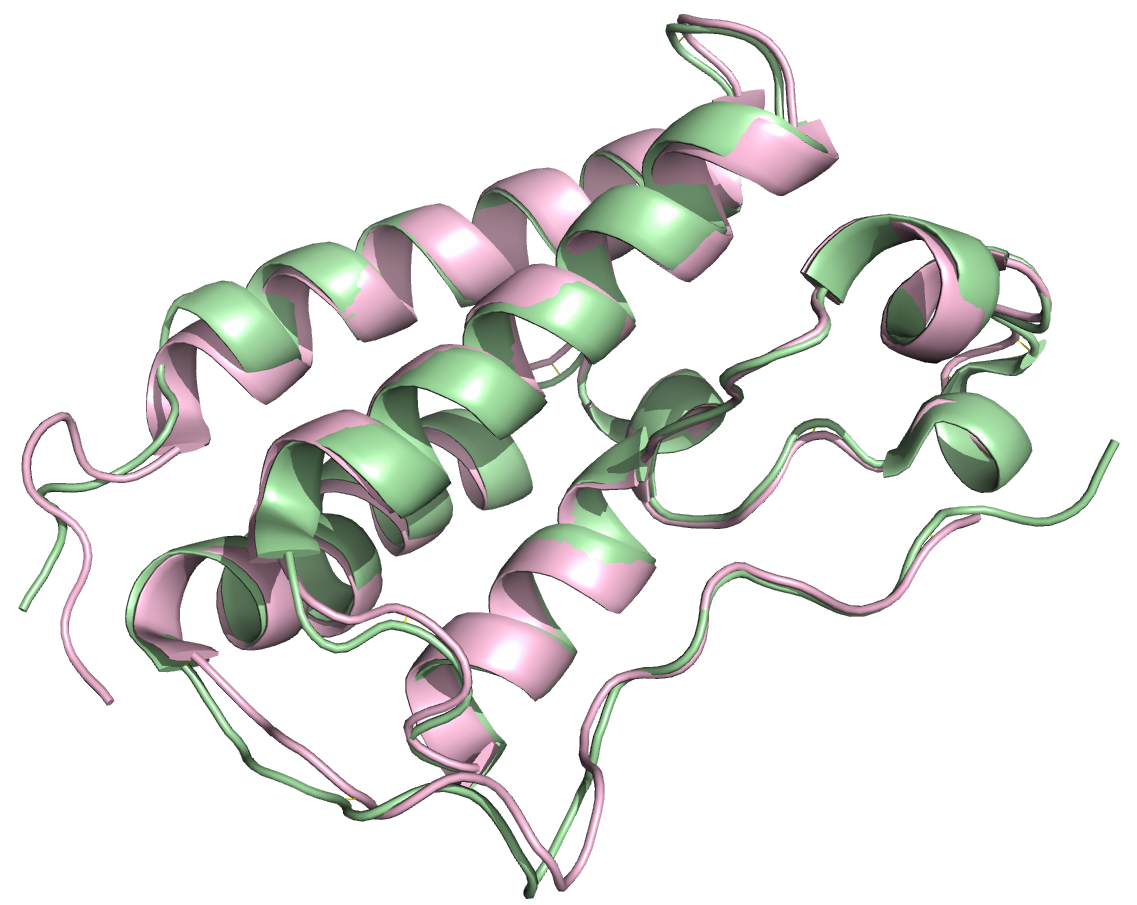
Из рисунка 3 видно, что расшифровки довольно неплохо выравниваются, в том числе и по расположению лигандов, за исключсением некоторых участков. Например, на рисунке 4 справа виден несовпадющий участок: у расшифровки с более высоким разрешением там находится короткая альфа-спираль, в то время как у расшифровки с более низким разрешением на этом месте петля. Ниже приведены изображения аминокислот, входящих в данный участок.
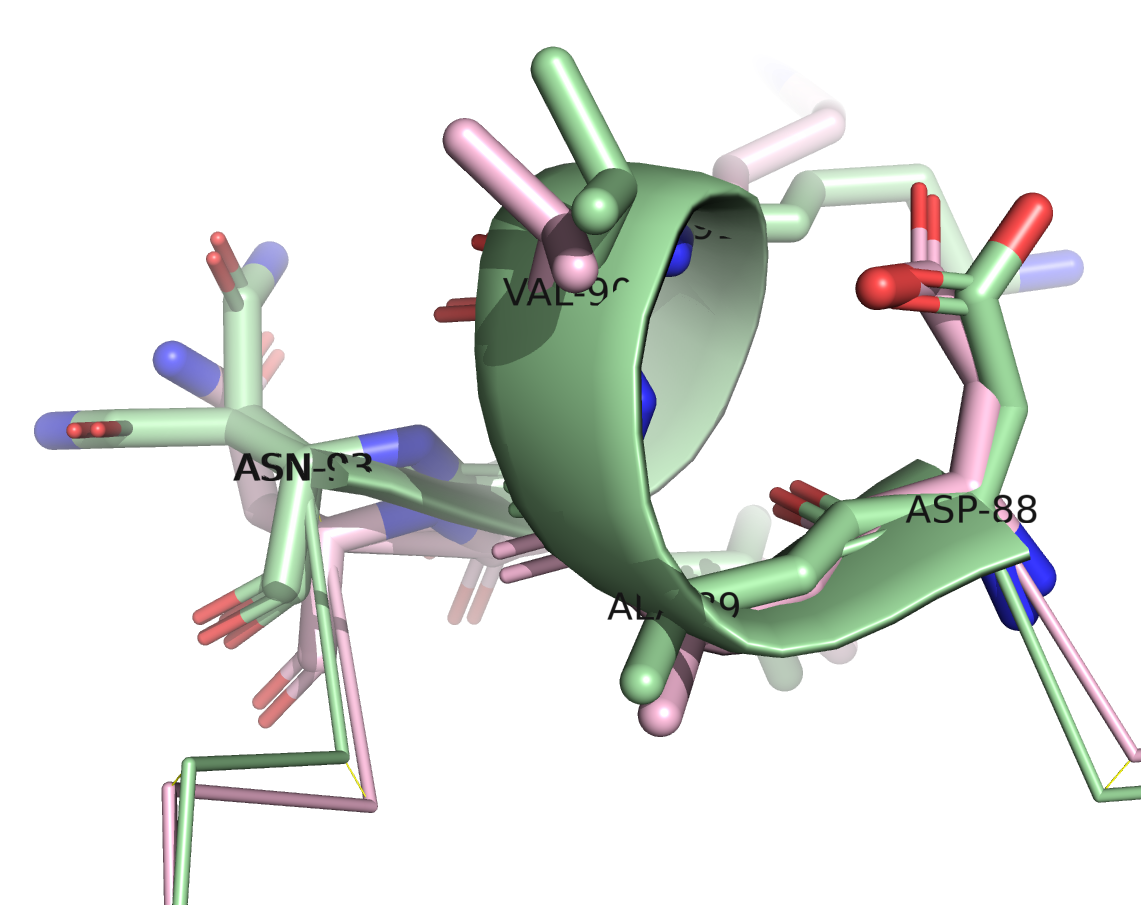
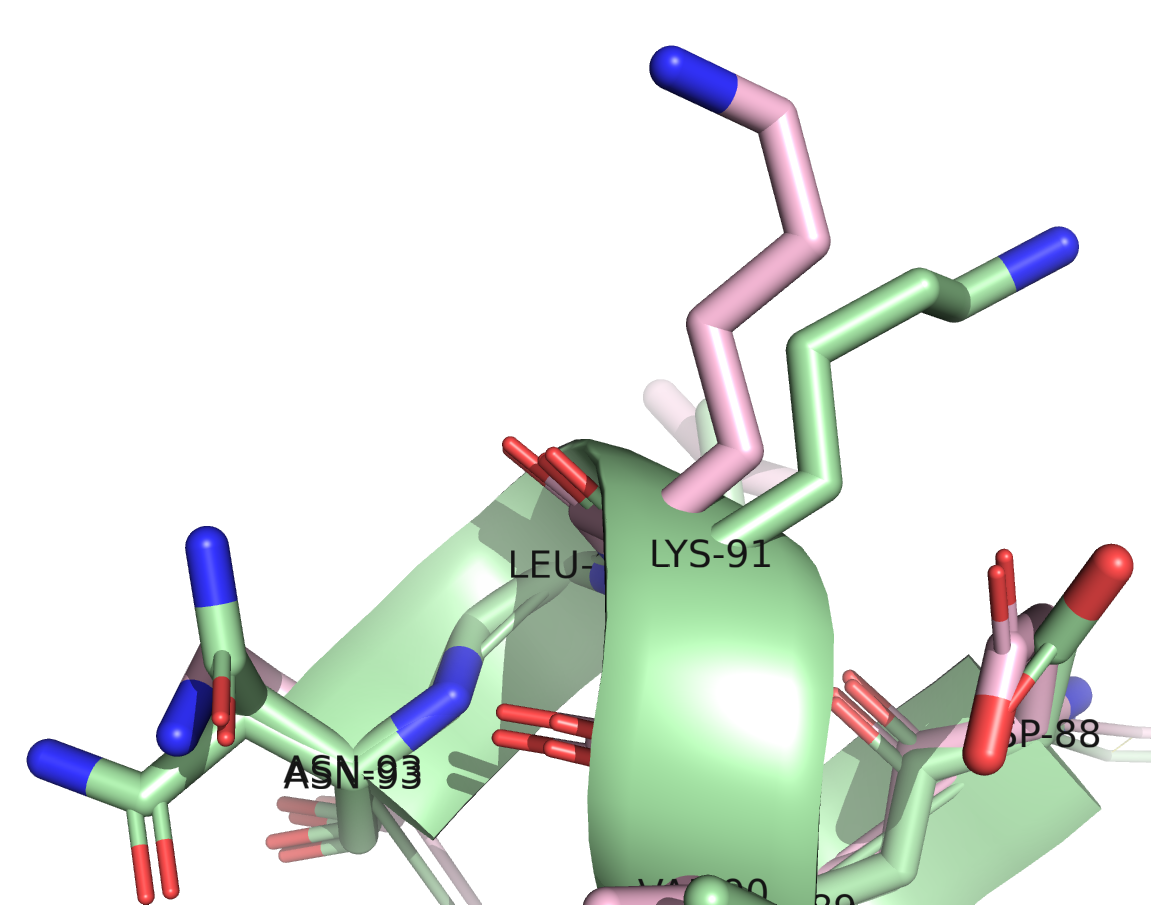
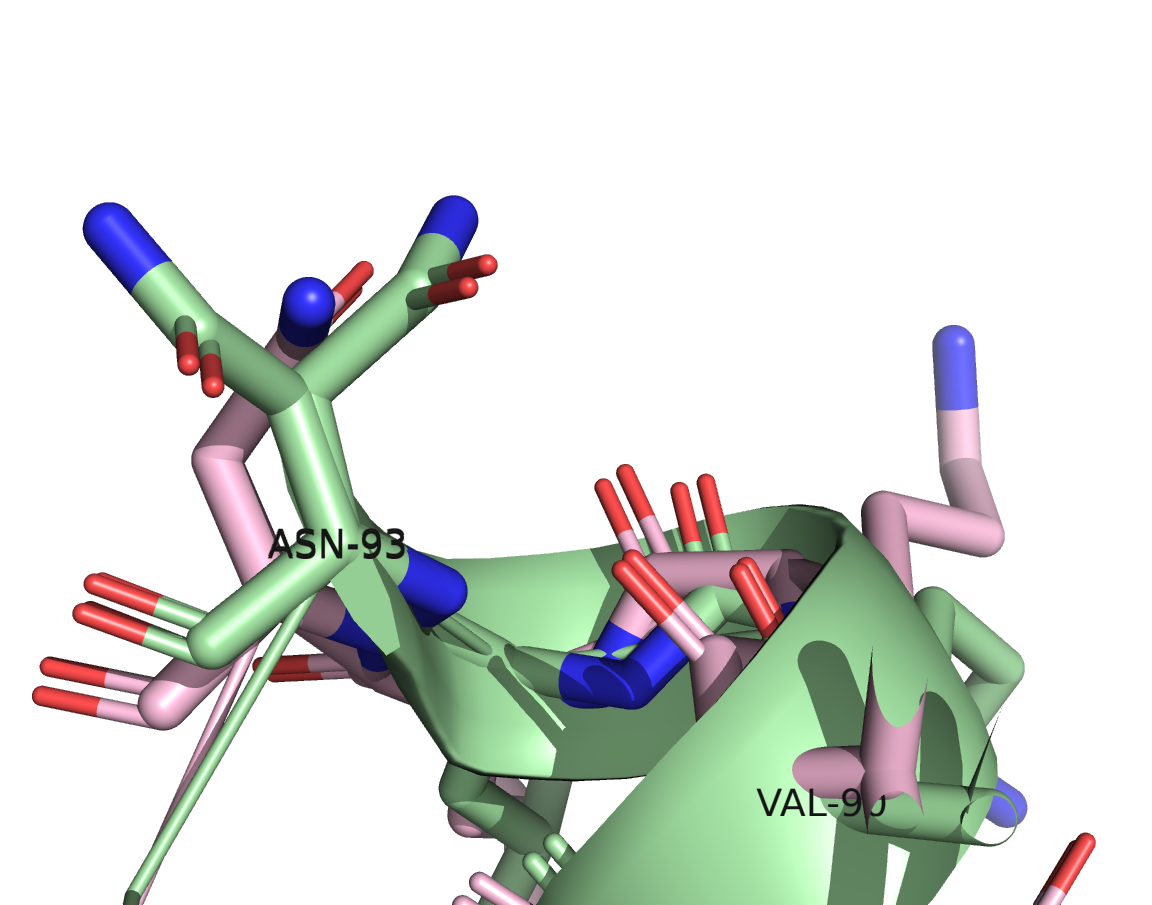
На изображениях представлены все аминокислоты, входящие в несовпадающий участок. Четыре из шести аминокислот (ASP-88, ALA-89, VAL-90, LEU-92) относительно неплохо согласуются по расположению. Их боковые радикалы немного смещены друг относительно друга. Хуже согласуются расположения LYS-91: боковые радикалы смотрят совсем в разные стороны. Самый неоднозначный остаток ASN-93 показан на правом изображении. В расшифровке 7JKY с более высоким разрешением для него есть два альтернативных варианта расположения, при этом ни один из них не совпадает с расположением в расшифровке 6X7C.
Ниже приведены изображения электронной плотности для остова этого участка на уровнях подрезки 1, 2 и 3.
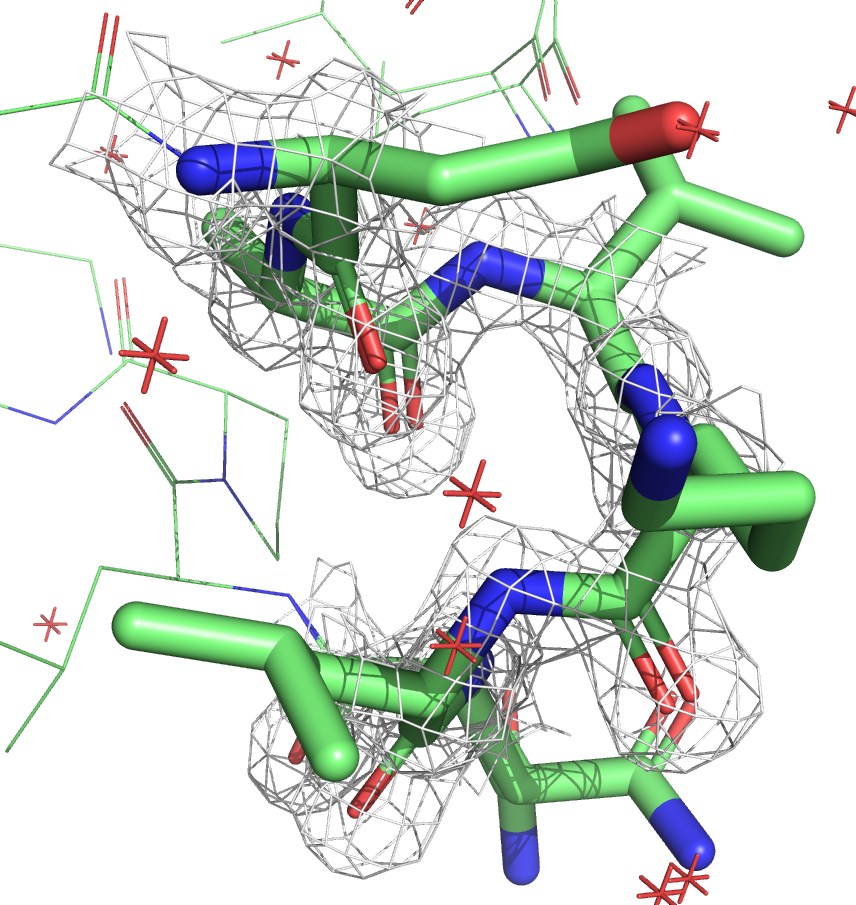
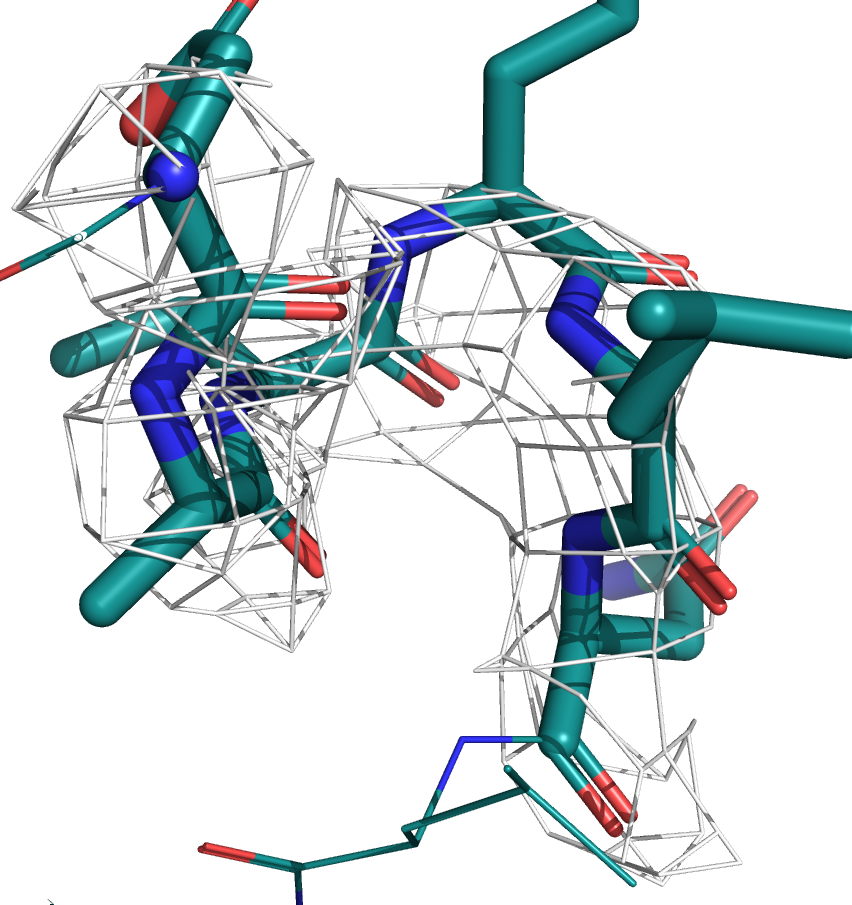
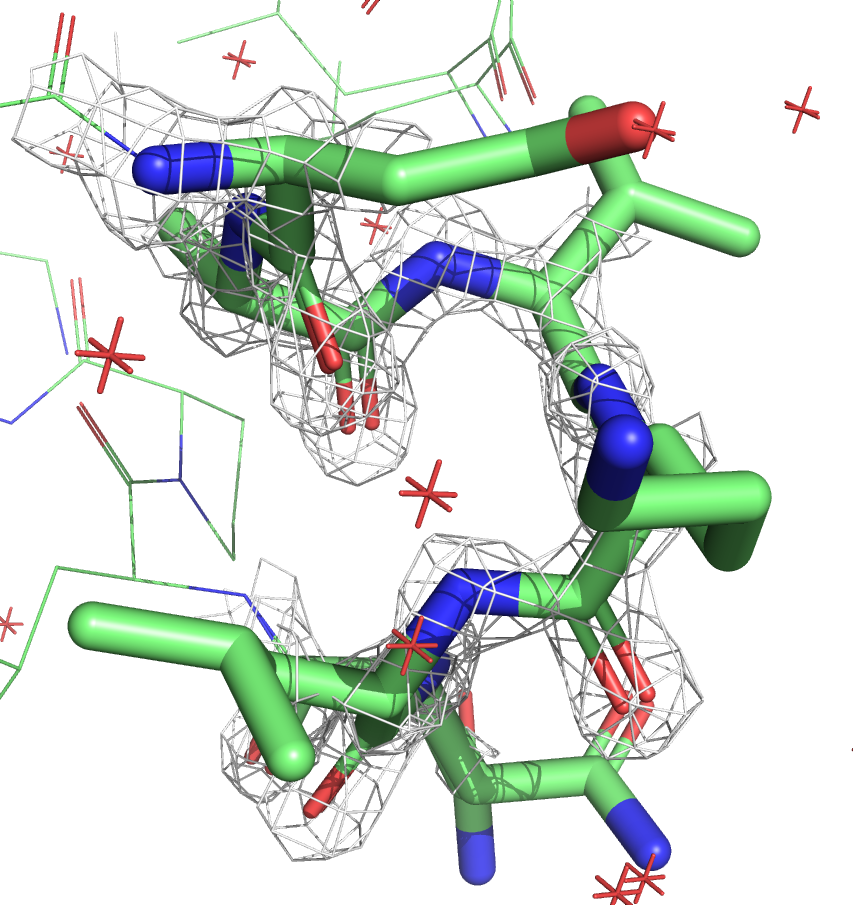
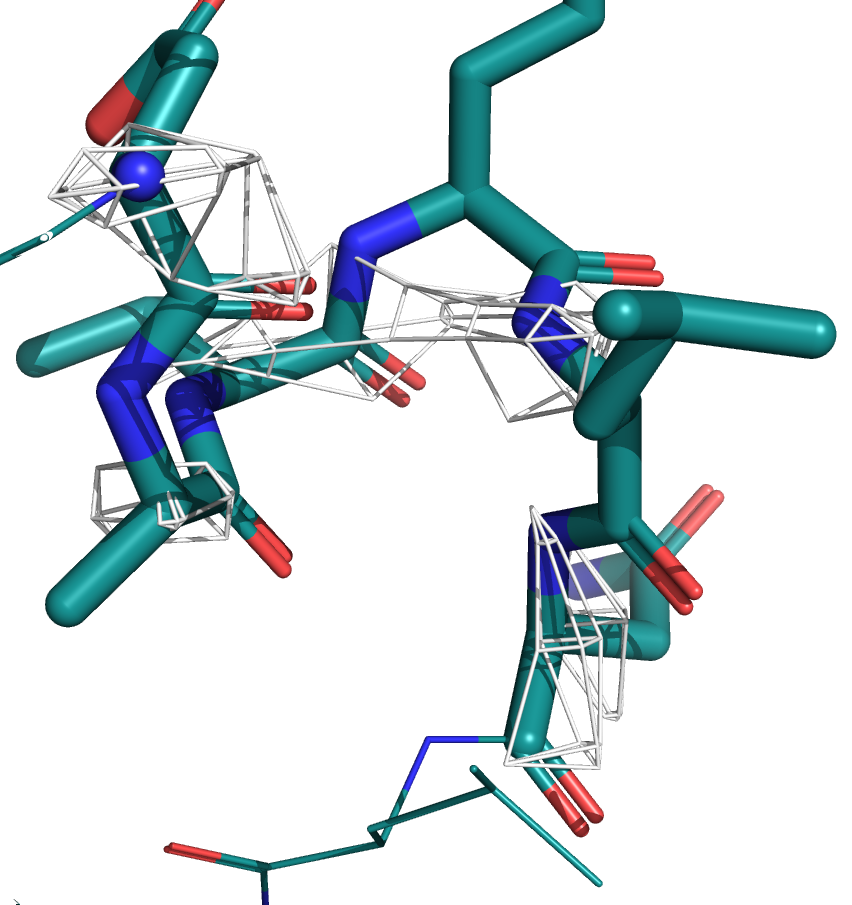
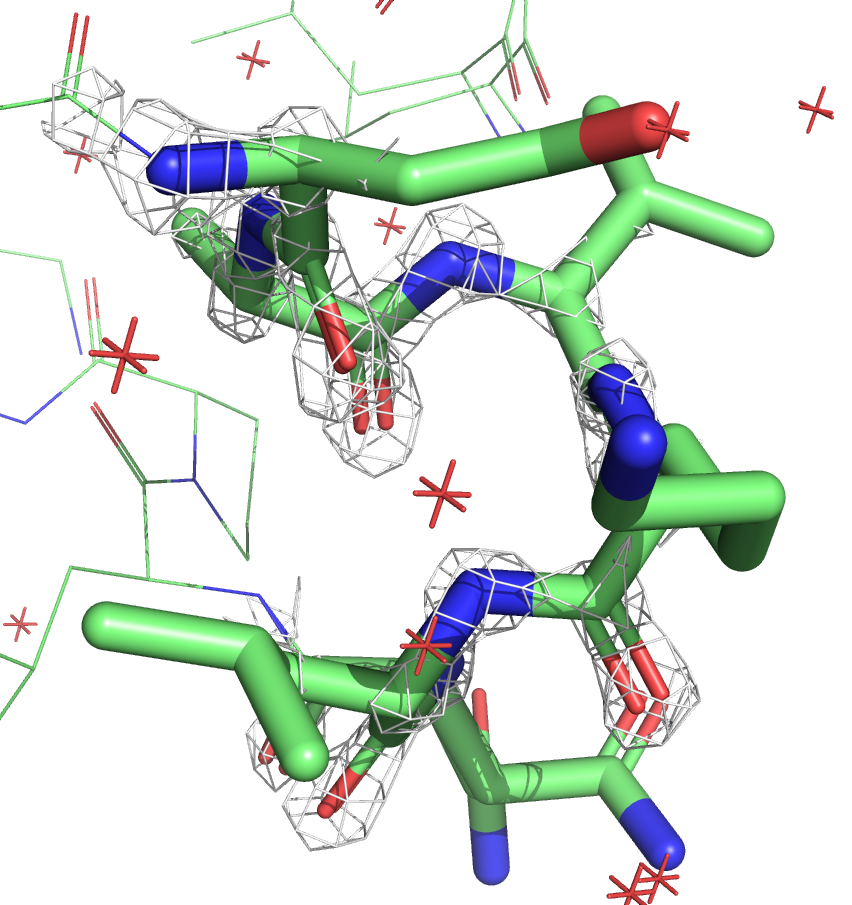
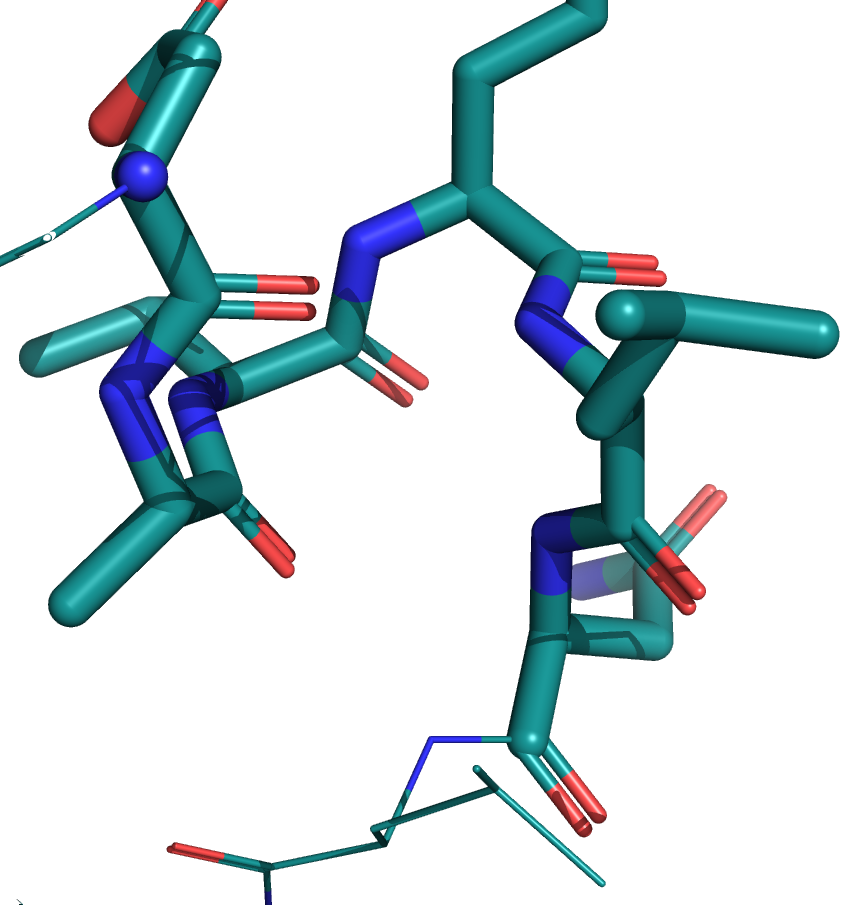
Видно, что в случае со структурой с более высоким разрешением (7JKY, слева) электронная плотность очень хорошо ложится на остов. У структуры с более низким разрешением (6X7C, слева) электронная плотность менее детальная, скорее показывает примерную область. На уровне подрезки 3 для структуры JKY можно восстановить структуру остова, плотность идеально окружает атомы. У структуры же 6X7C на всех уровнях плотность более угловатая.
По распределению электронной плотности очевидно, что у структуры 7JKY более высокое разрешение, что согласуется с данными из PDB.
ЭП и положение в структуре
В данном задании я работала со структурой 6F2Q. Это расшифровка структуры галектина-3C в свободной от лигандов форме. Разрешение расшифровки составляет 1.03 Å, размер белка – 15.7 kDa.

Посмотрим на электронную плотность, построенную с помощью mesh на уровнях подрезки 1, 2 и 3.

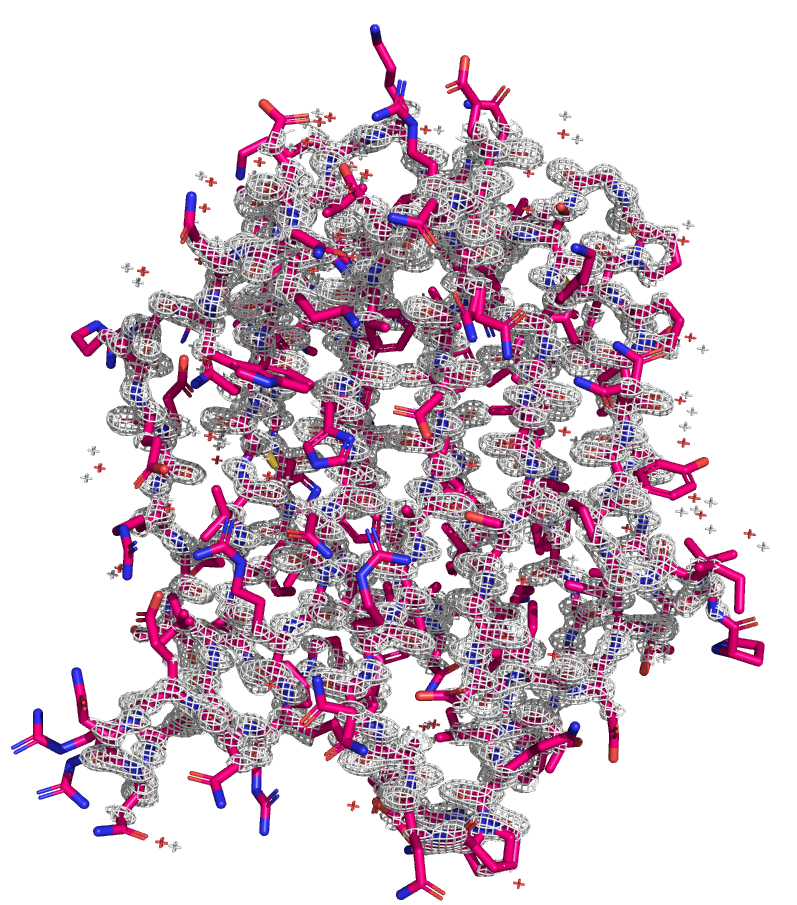
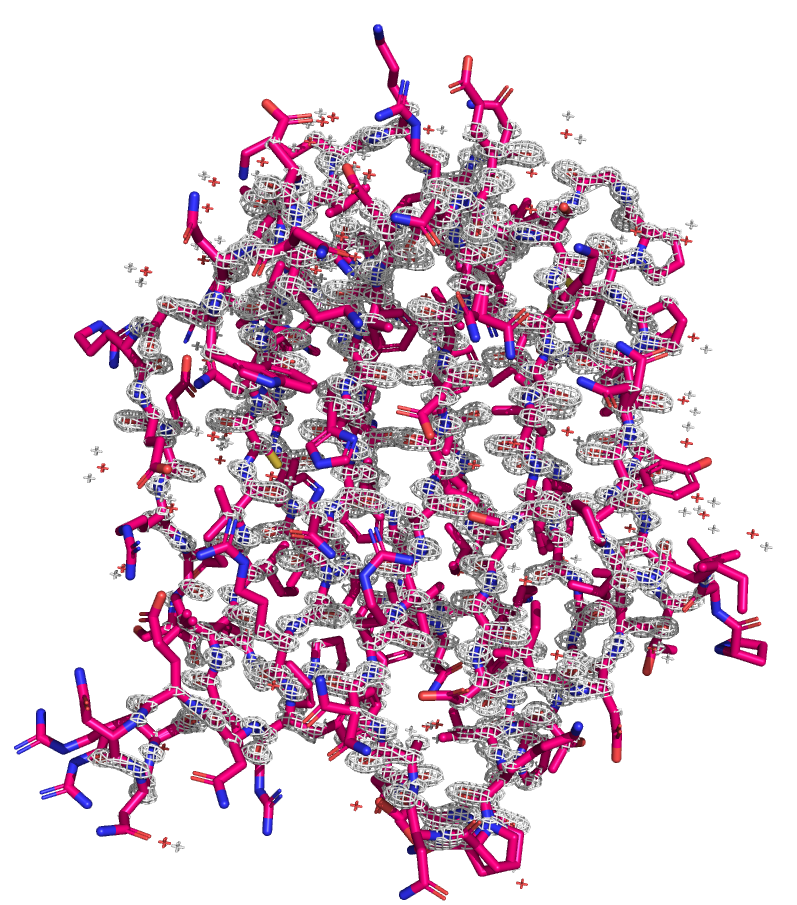
Видно, что по мере увеличения уровня подрезки структура становится менее покрытой ЭП. На 3 уровне ЭП сохраняется ближе к центру молекулы, а по краям покрытие меньше.
Альтернативные положения
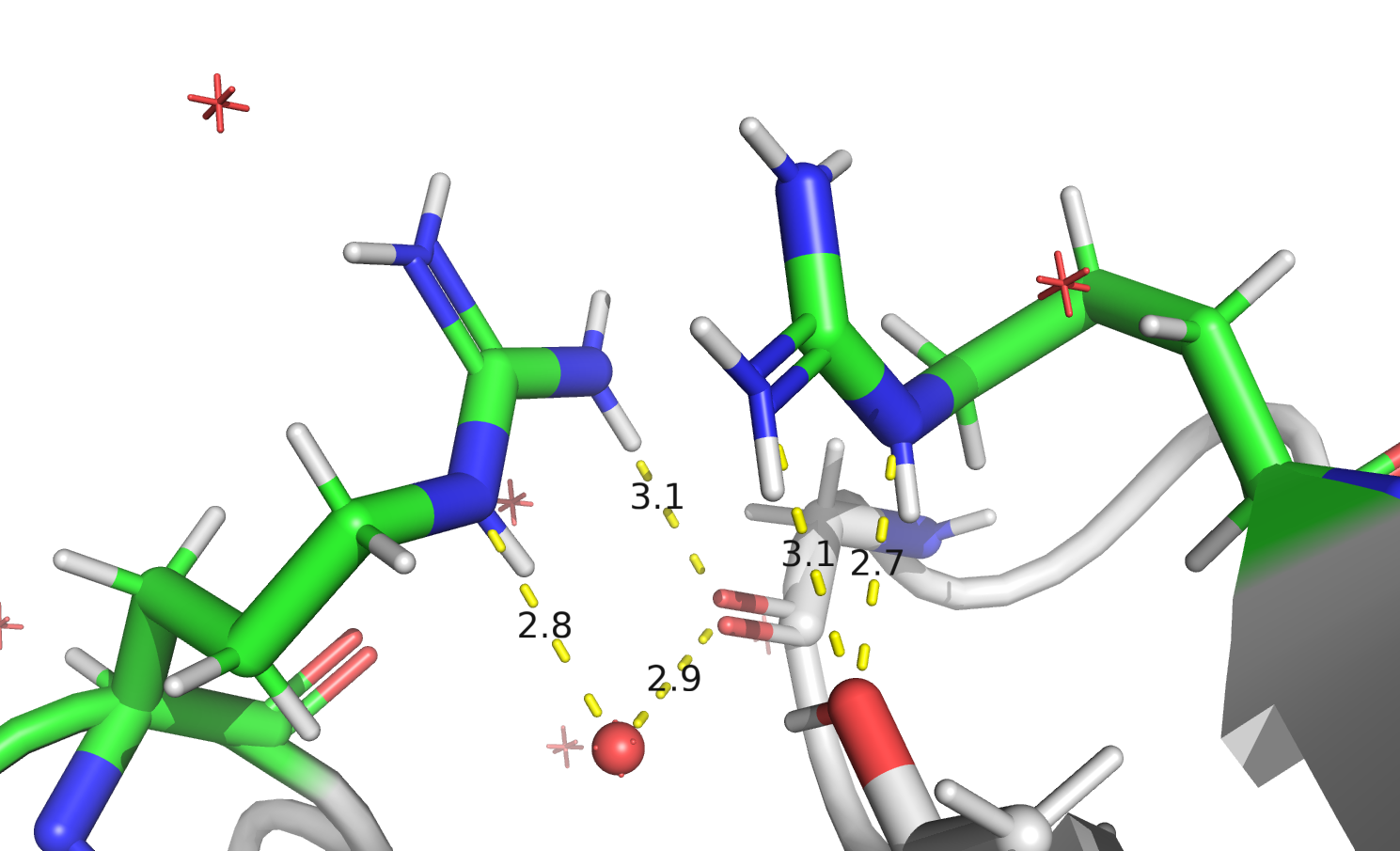
Мне была дана структура 6RT3 (лизоцим) c двумя аминокислотными остатками, для которых показаны альтернативные положения: ARG-45 и ARG-68. Выяснилось, что возможны сочетания, когда оба аргинина находятся либо в положении А, либо в положении В.
| ARG-68 "A" | ARG-68"B" | |
|---|---|---|
| ARG-45 "A" | Возможно | Невозможно из-за перекрытия Ван-дер-Ваальсовых радиусов (см. Рисунок 15) |
| ARG-45 "B" | Невозможно из-за перекрытия Ван-дер-Ваальсовых радиусов (см. Рисунок 15) | Возможно |
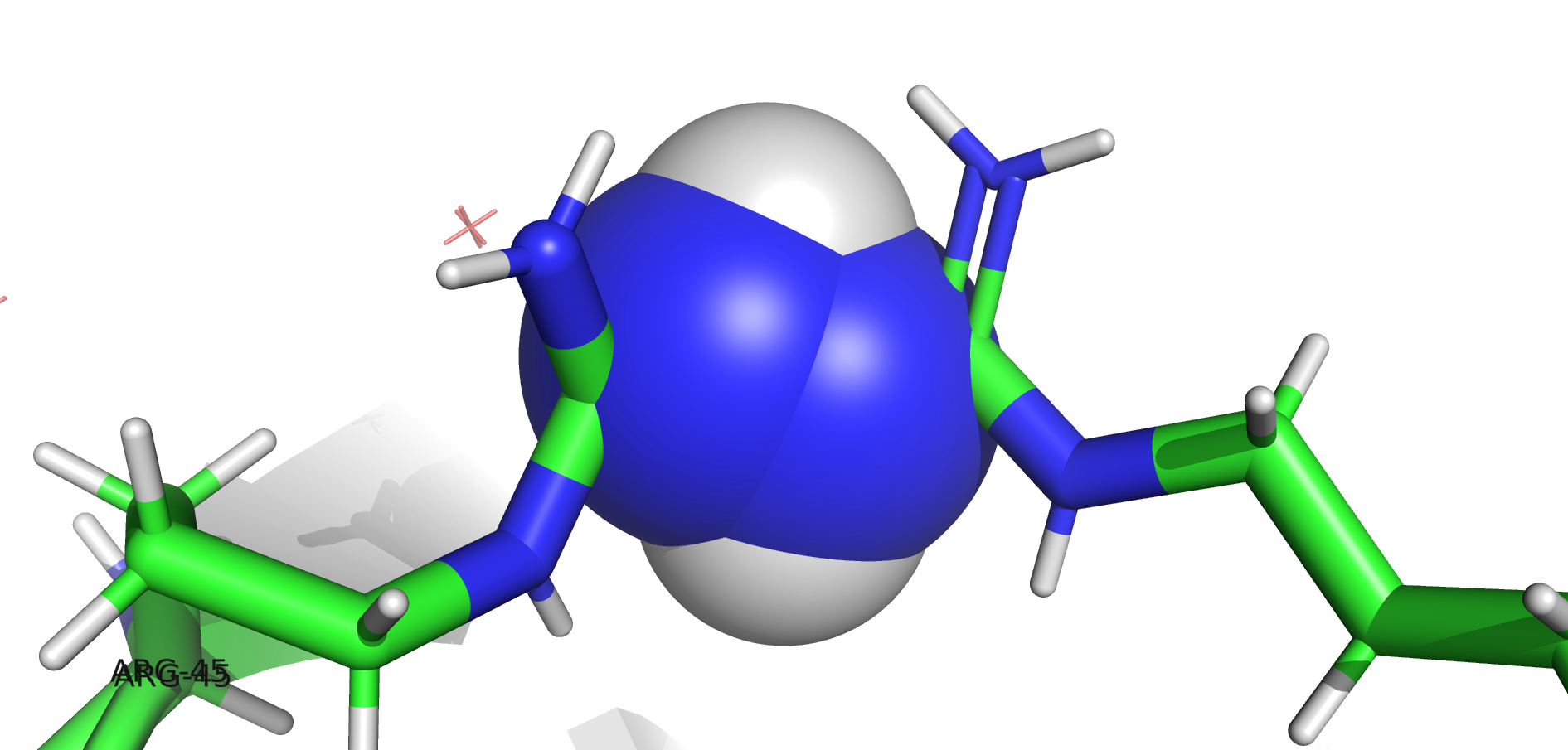
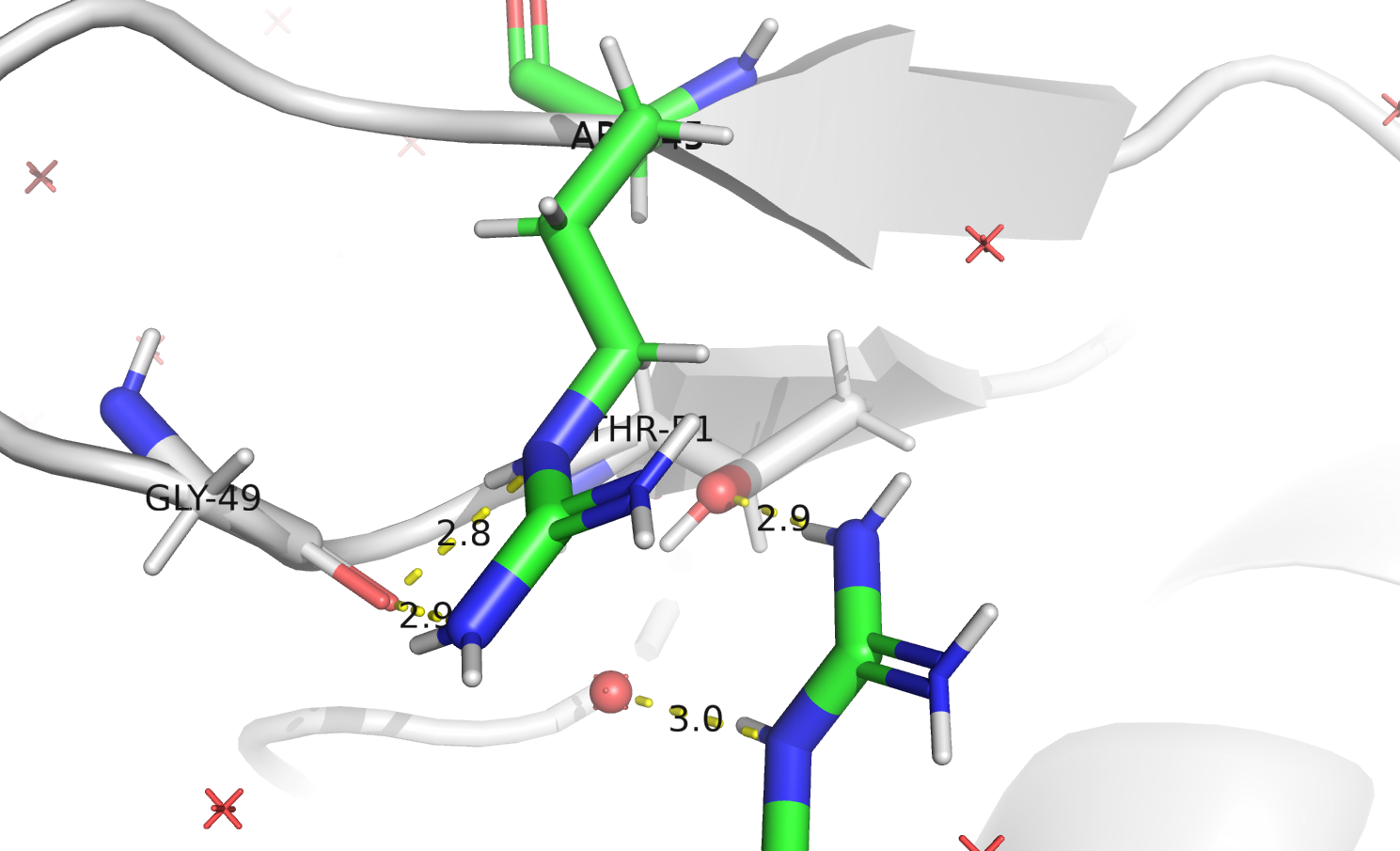
Стабилизация сочетаний АА и BB осуществляется за счёт водородных связей. Возможные взаимодействия представлены на Рисунке 16. В образовании водородных связей участвуют остатки THR-51 и GLY-49. В случае сочетания AA могут образовываться две водородные связи между ARG-45 и THR-51 и одна между ARG-68 и GLY-49. При альтернативном положении ARG-45 может образовать две водородные связи с GLY-49, а ARG-68 – одну с THR-45.
B-фактор
В этом задании я продолжаю работать со структурой 6RT3. Покрасила по B-фактору сначала остов (Рисунок 17), а потом и весь белок (Рисунок 18).
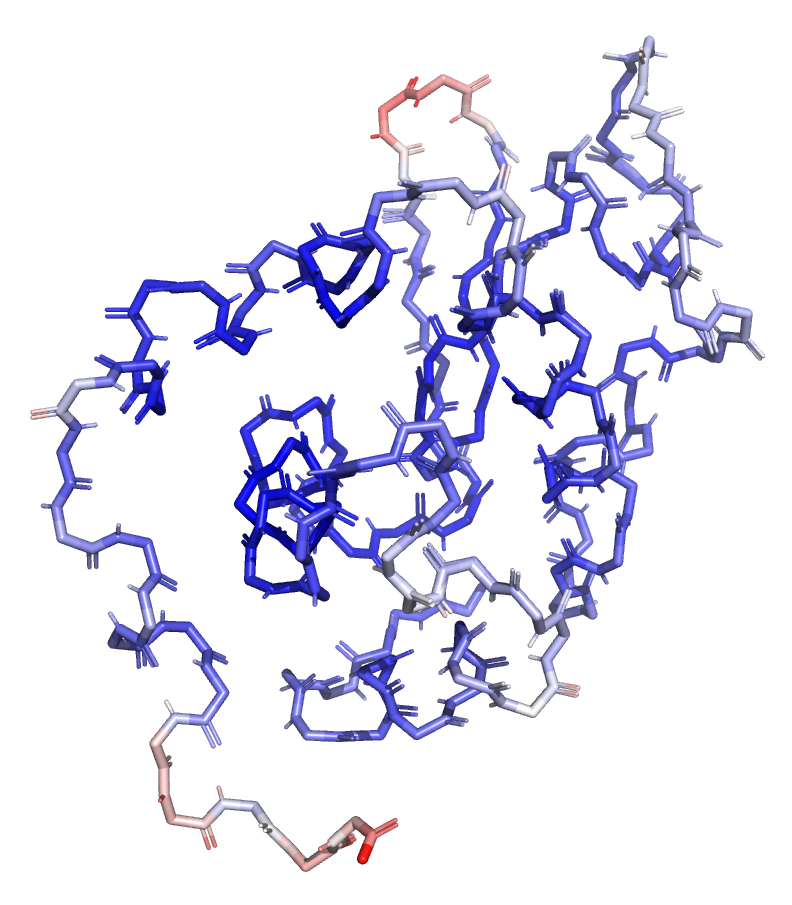
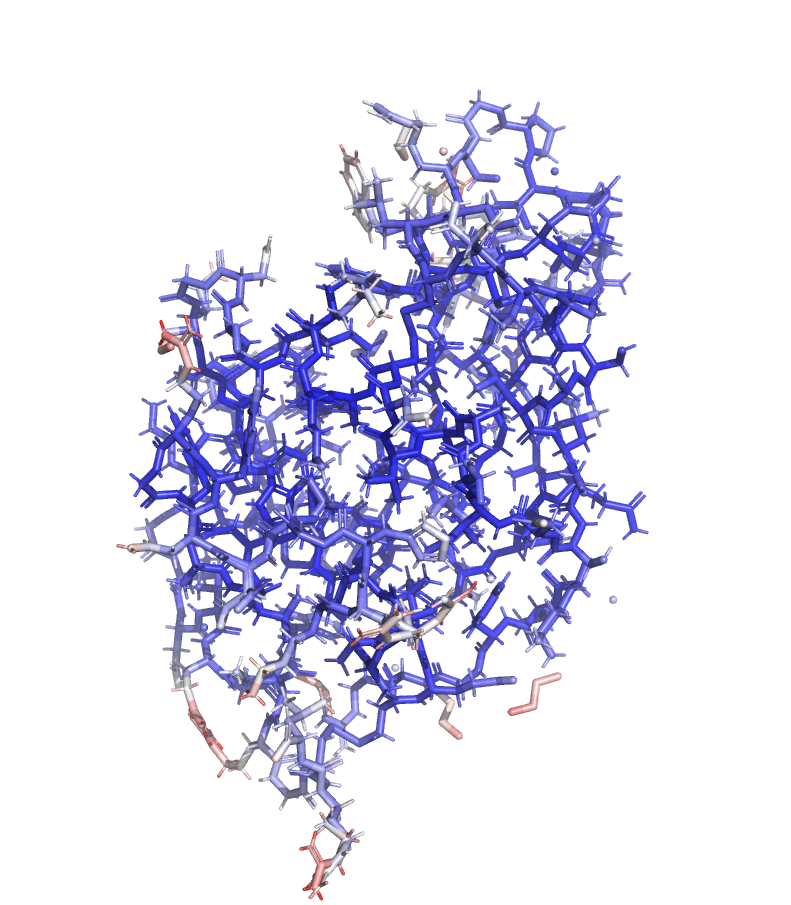
По Рисунку 17 видно, что более высокие значения B-фактора наблюдаются у атомов, расположенных на периферии молекулы. Это ожидаемо, так как для наружных участков белка характерна большая подвижность.
Для детального рассмотрения я выбрала остаток ARG-21. Его атомы заметно краснеют при продвижении от Сα атома к концу боковой группы.

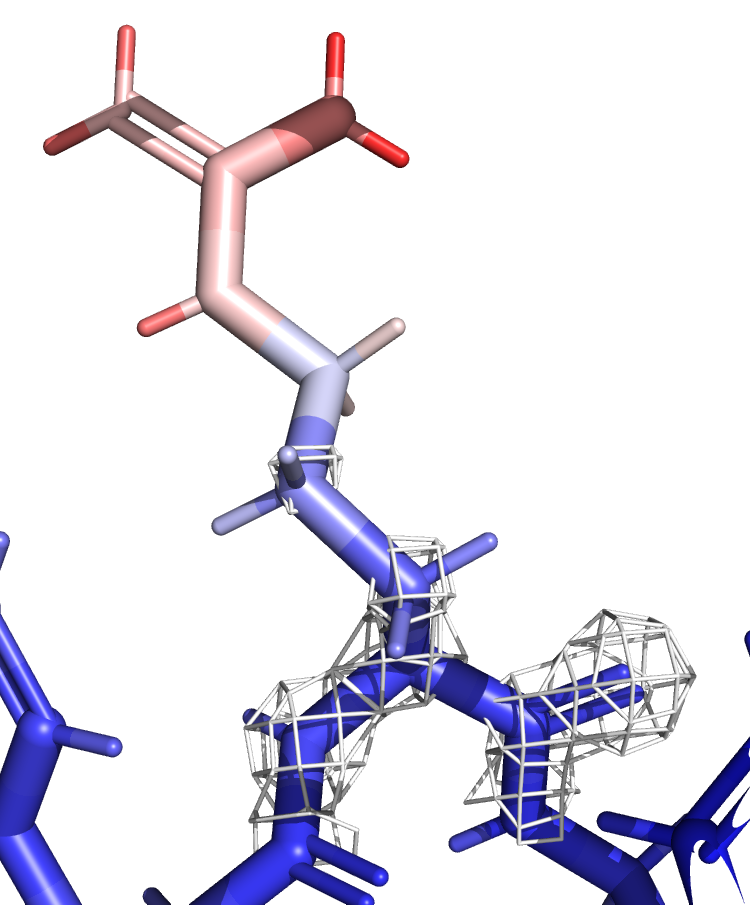
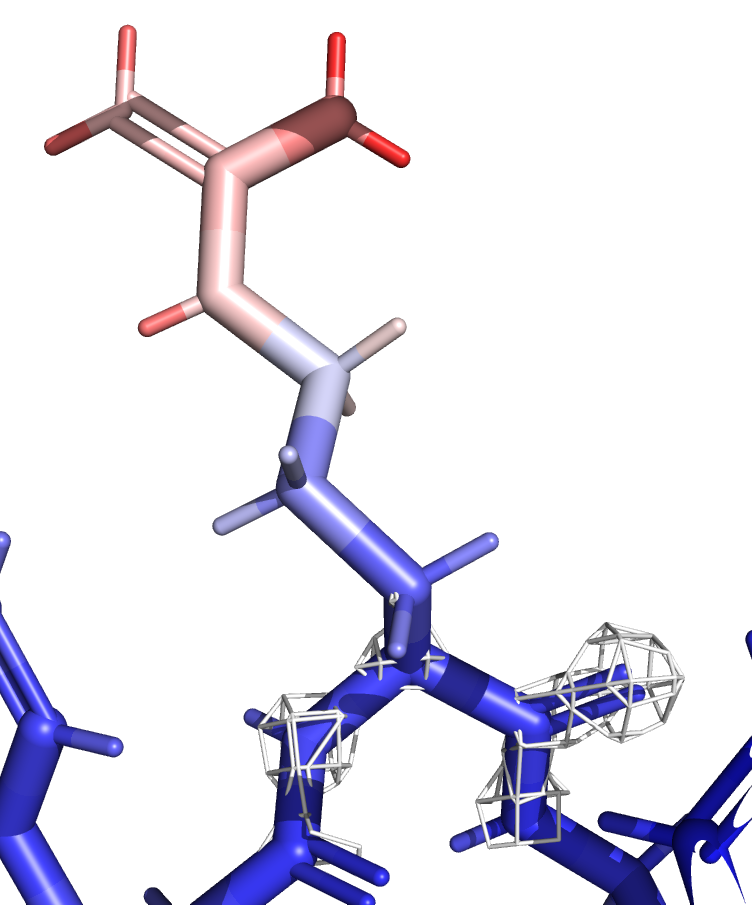
Можно сделать следующий вывод: там, где B-фактор больше, ЭП ниже. ЭП атомов с красной окраской видно только на уровне подрезки 1. Следовательно, можно сказать, что B-фактор является мерой подвижности атома, а значит неопределённости его положения.