Протонирование
PROPKA
В данном задании я работала со структурой 7C4N. Кристаллизация происходила при pH = 3.5
Эту структуру я проанализировала с помощью сервиса PDB2PQR. Скачала файлы с расширением .pqr и .log, во втором после строчки "SUMMARY OF THIS PREDICTION" находится информация, в которой представлена информация о предсказанных значениях pKa для 44 остатков ASP, 38 GLU, 9 HIS, 4 CYS, 25 TYR, 30 LYS и 21 ARG. Среди ASP, GLU и HIS были выбраны остатки с самыми высокими значениями pKa, которые также выше, чем pH кристаллизации. Информация о них представлена в таблице:
| Позиция | pKa | model-pKa | |
|---|---|---|---|
| ASP | 580 | 8.39 | 3.80 |
| GLU | 573 | 9.61 | 4.50 |
| HIS | 467 | 7.18 | 6.50 |
HIS 467
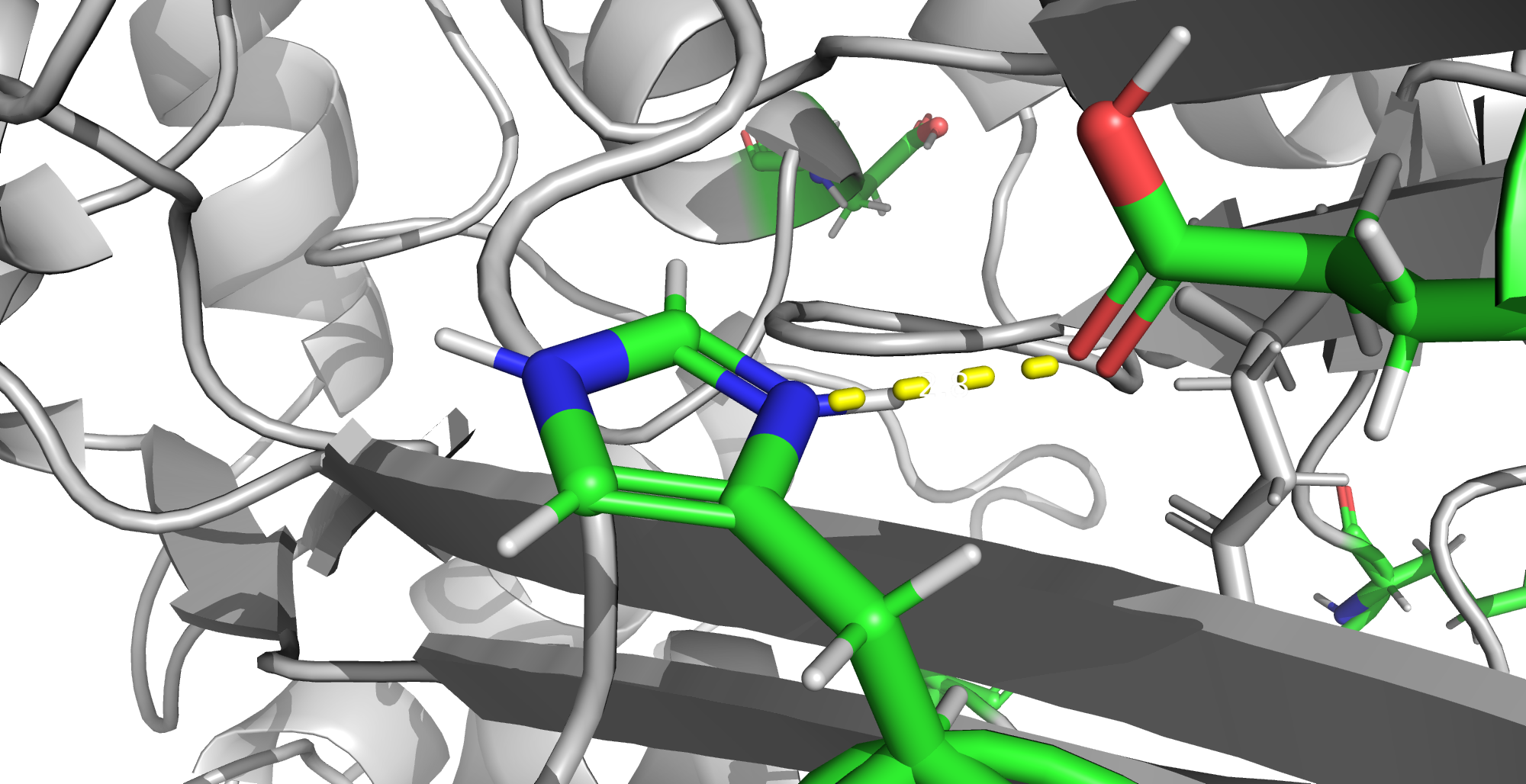
Здесь имеется одна возможная позиция для протонирования. Думаю, PROPKA права с фактором протонирования, так как в данном случае может образовываться водородная связь с карбонильной группой глутамата 471
ASP 580
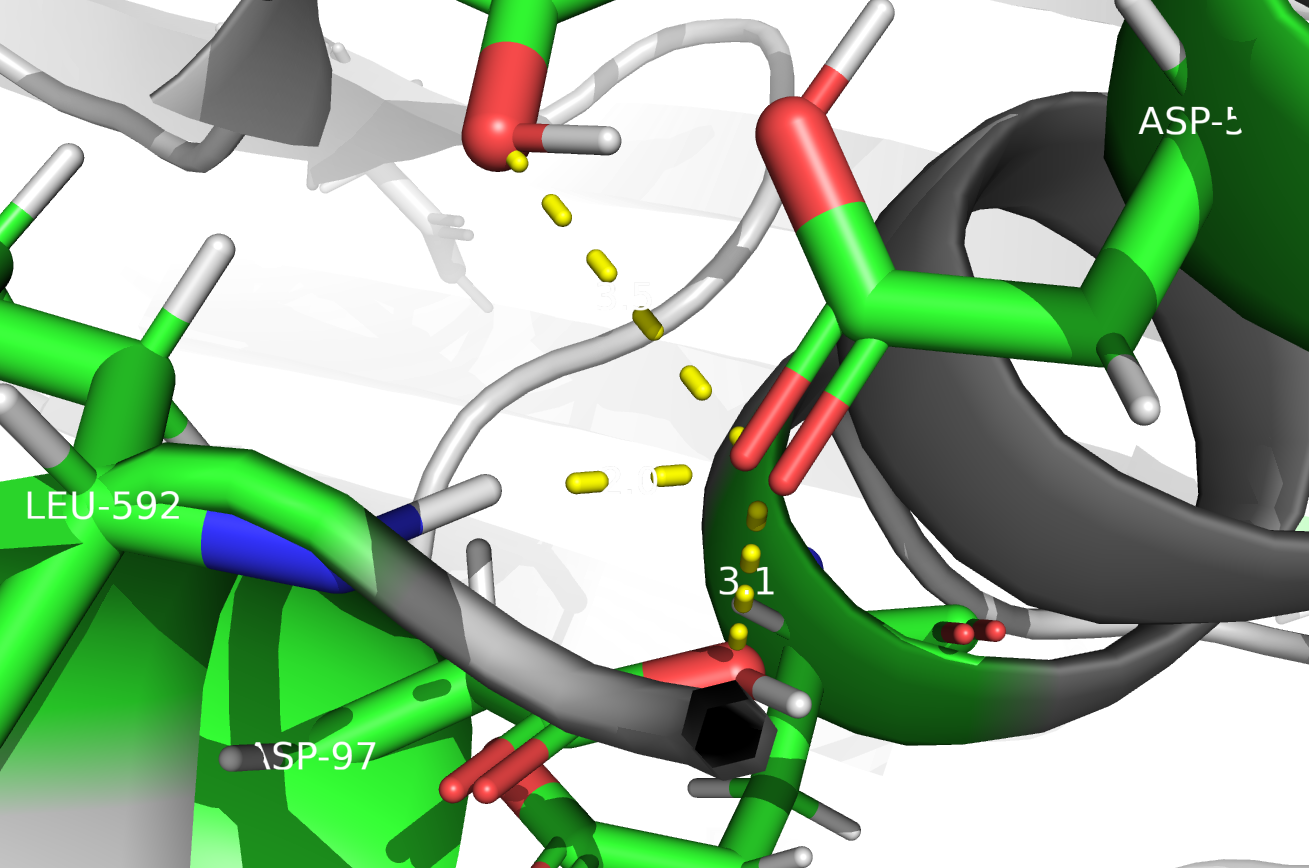
Теперь рассмотрим остаток ASP 580. На рисунках показаны остатки, с которыми он теоретически может образовывать водородные связи. На левом рисунке представлена ситуация согласно предсказанию PROPKA. В этом случае ASP 580 может выступать только в роли акцептора водородной связи. Все связи, которые я отметила на рисунке, оптимальной длины и выглядят правдоподобными.
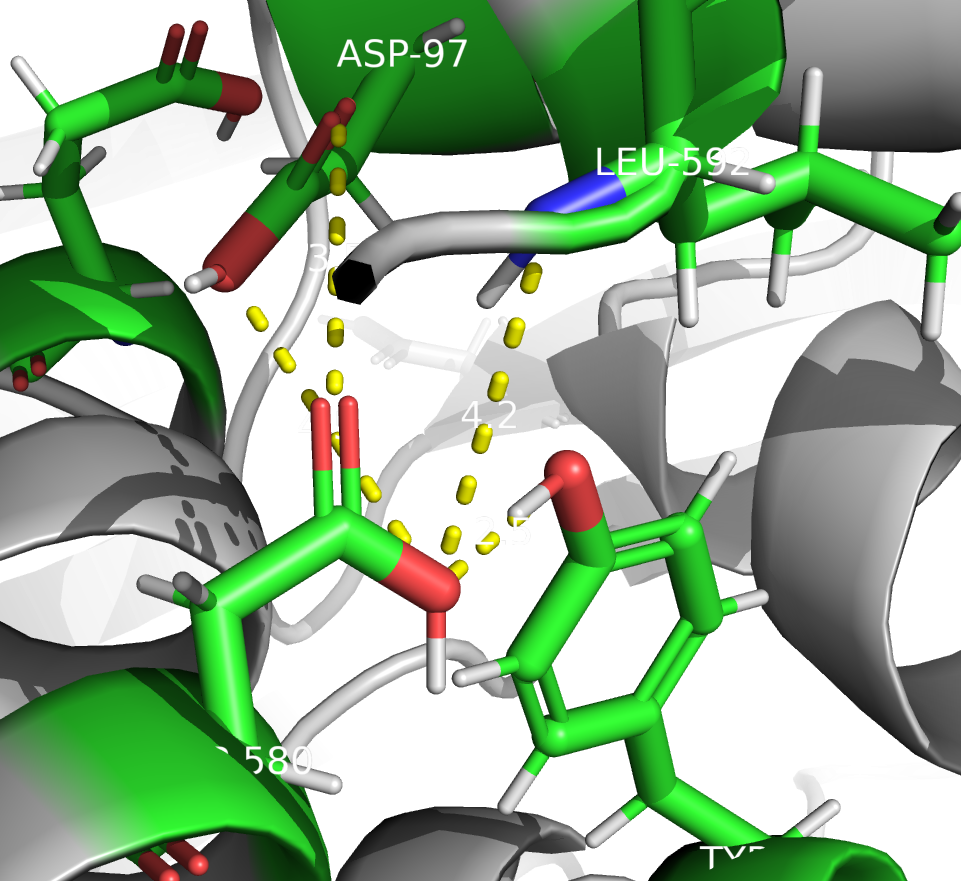
Рассмотрим другой вариант: если PROPKA права с фактором протонирования, но протон находится на другом атоме кислорода (Рис 3). В таком случае в образовании водородных связей принимают участие те же остатки. ASP так же в основном выступает в роли акцептора (за исключением одной связи с карбонильной группой ASP 97), но при этом более правдоподобной, чем в предыдущем случае, выглядит только связь с атомом кислорода тирозина. Остальные связи слишком длинные. Так что я бы сказала, что алгоритм верно предсказал положение водорода.
GLU 573
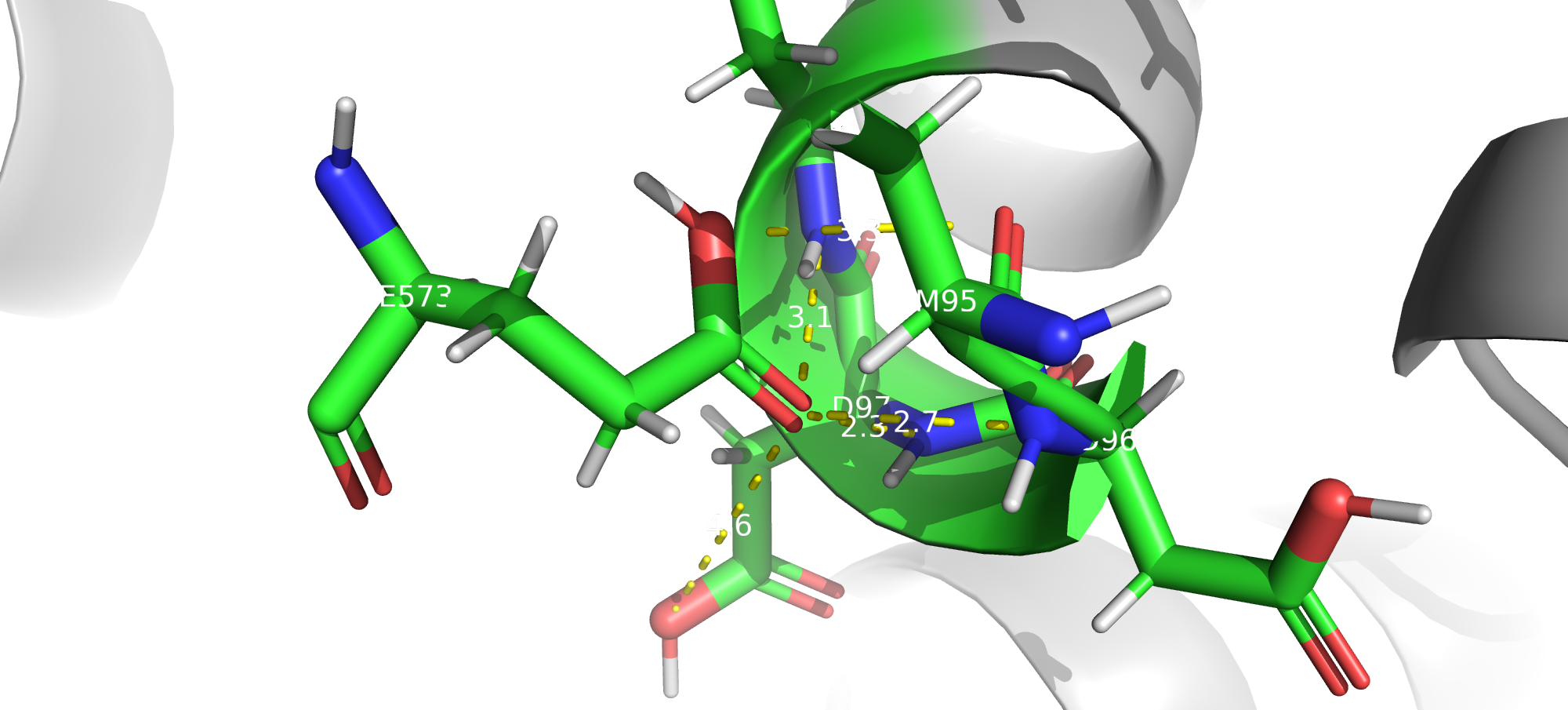
Для этого остатка тоже возможны несколько водородных связей, в которых он может выступать и в роли донора, и в роли акцептора. На мой взгляд водород в правильном положениии, при альтернативном положении количество возможных водородных связей не увеличилось бы.
PROTOSS
Ниже представлены изображение тех же остатков согласно предсказанию PROTOSS
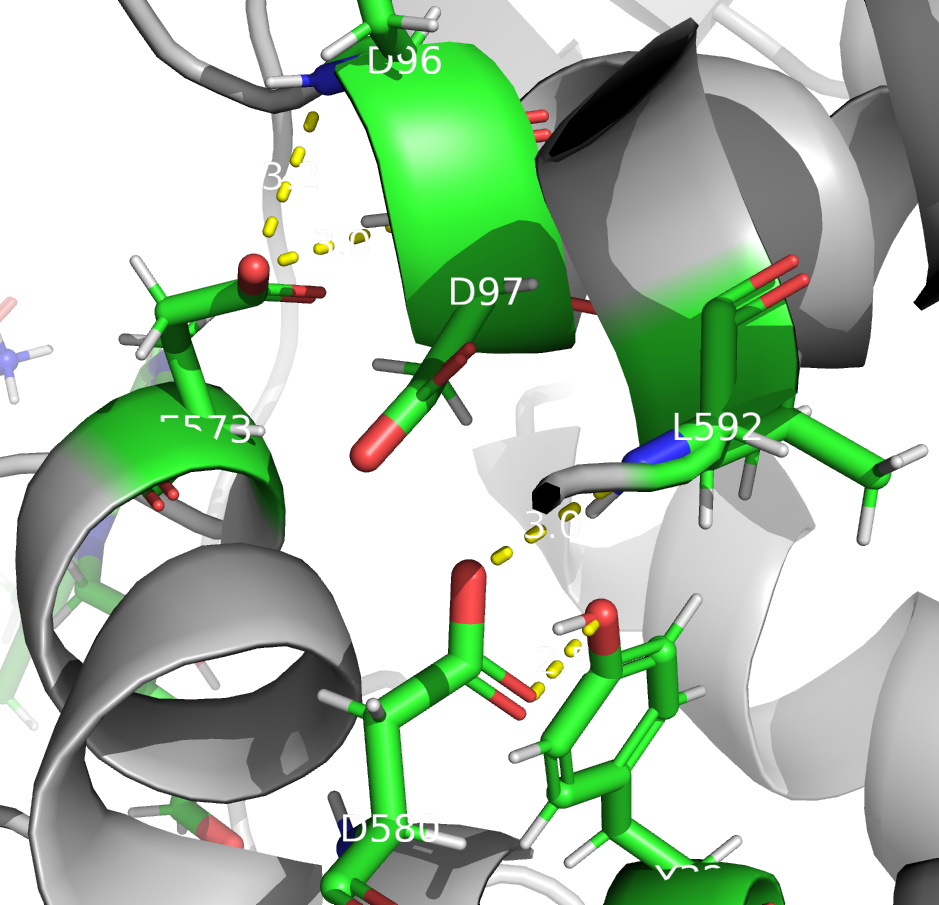
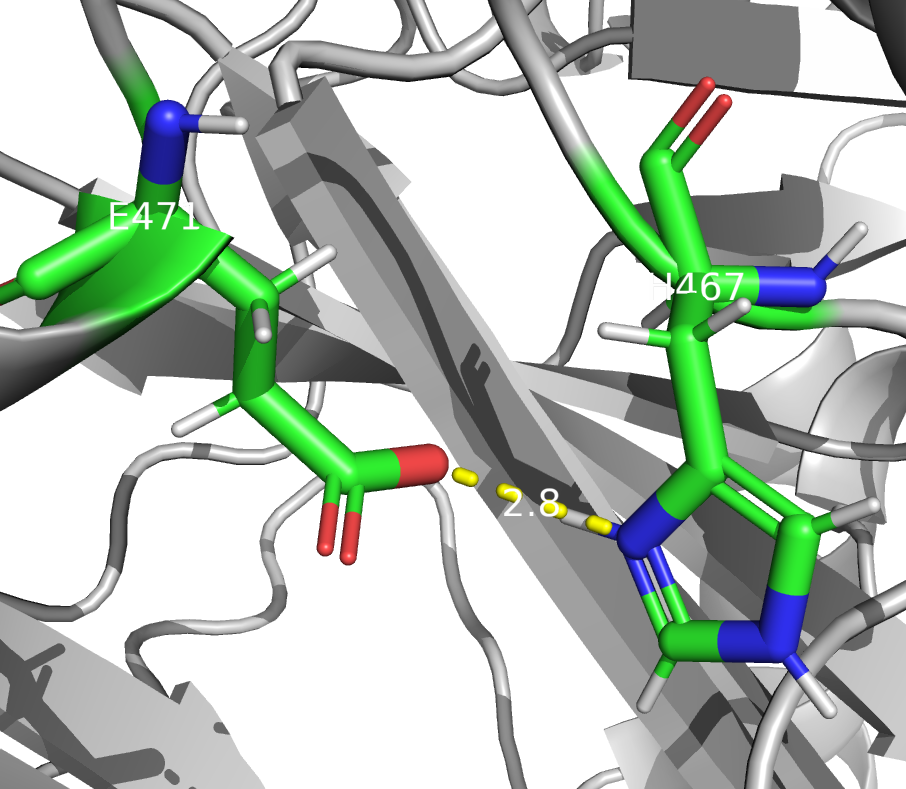
Согласно предсказанию PROTOSS, ASP 580 и GLU 573 депротонированы, что не согласуется с результатами PROPKA. Возможно, такой результат объясняется тем, что эти остатки являются в основном акцепторами водородной связи, и в таком случае они могут образовыват те же связи кроме связи с ASP 97, так как в предсказнии PROTOSS он тоже депротонирован. Что касается остатка HIS 467, для него предсказания двух алгоритмов согласуются, в обоих он протонирован и выступает донором водородной связи.
Вывод
Для двух из трёх остатков предсказания программы различаются, так как PROTOSS не учитывает pKa, а ориентируется на оптимизацию графа контактов остатков друг с другом. Почти все возможные контакты с этими остатками обеспечиваются за счёт того, что они выступают в роли акцепторов водородной связи, поэтому PROTOSS не протонировал их. Образующиеся связи нужны для поддержания третичной структуры белка, а именно для сближения нескольких альфа-спиралей и стабилизации их концов.