Мембранные белки
Для выполнения данного практикума был использован белок 4RWS. Это белковый комплекс хемокинового рецептора человека CXCR4 и вирусного антагониста хемокинов vMIP-II.
База данных OPM
В базе данных OPM можно получить предсказание расположения белка в мембране. Исследуемый белок находится в плазматической мембране эукариотических клеток (в данном случае - в мембране клеток человека). Толщина гидрофобного слоя мембраны составляет 33.8 ± 1.5 Å. Трансмембранный домен состоит из 7 α-спиралей, каждая из которых в среднем состоит из 25.3 аминокислотных остатков. На рисунке 1 изображено расположение исследуемой структуры в мембране.
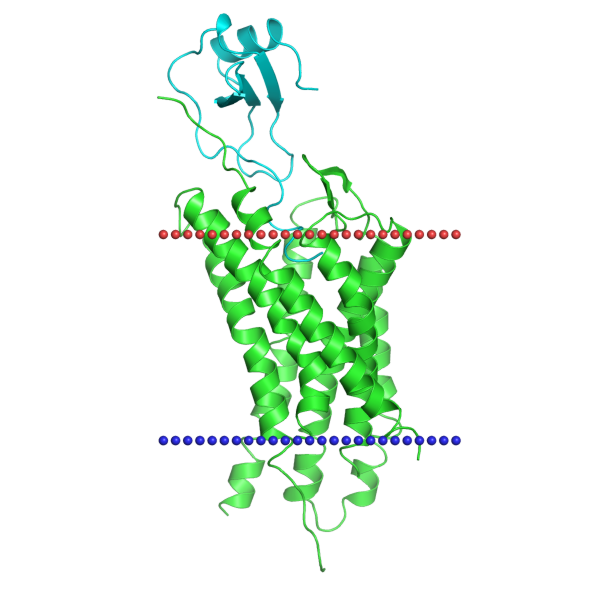
Рисунок 1. Расположение белка 4RWS в мембране, красными шариками обозначена внешняя поверхность, а синими шариками - внутренняя поверхность мембраны. Рисунок взят из БД OPM.
Рисунок 2. Расположение белка 2IXX в мембране, красными шариками обозначена внешняя поверхность, а синими шариками - внутренняя поверхность мембраны. Рисунок взят из БД OPM.
Анализ множественного выравнивания
Цели задания: проверить корректность предсказания сервиса TMHMM и проверить консервативность различных частей трансмембранных белков.
Запись в PDB содержит посследовательность двух полипептидных цепей: последовательности для рецептора хемокинов CXCR4 и для вирусного белка. Так как мембранным белком является рецептор, дальнейшую работу я проводила только для рецептора, а не для всего комплекса. Поиск гомологичных белков с помощью BLAST (protein blast, алгоритм psi-blast по базе данных nr), не обнаружил гомологичные белки у архей. При поиске исключались организмы типа хордовые. В результате поиска была составлена репрезентативная выборка гомологичных белков, содержащая 10 эукариотических, 10 бактериальных и 1 вирусный белок. Последовательности выбранных белков были объединены в один файл и выравнены с помощью MUSCLE.
Полученное выравнивание было открыто в программе Jalview. К исследуемому белку была привязана структура, которая была раскрашена по гидрофобности аминокислотных остатков (рисунок 3). Для добавления к выравниванию дополнительной аннотации положения трансмембранных спиралей, было создано две строки аннотации: "TM_REAL" (отражает реальные трансмембранные участки по данным БД OPM) и "TM_PREDICTED" (отражает предсказание трансмембранных спиралей, выдаваемых программой TMHMM, для найленного гомолога - somatostatin receptor type 4 [Melipona quadrifasciata]). По полученным аннотациям в проекте Jalview видно, что предсказанные трансмембранные участки не совпадают с реальными. Это связано с тем, что у всех найденных гомологов в выравнивании отсутствует участок, гомологичный трансмембранному домену, а сходство белки иемют только во внутриклеточном домене (рисунок 4).
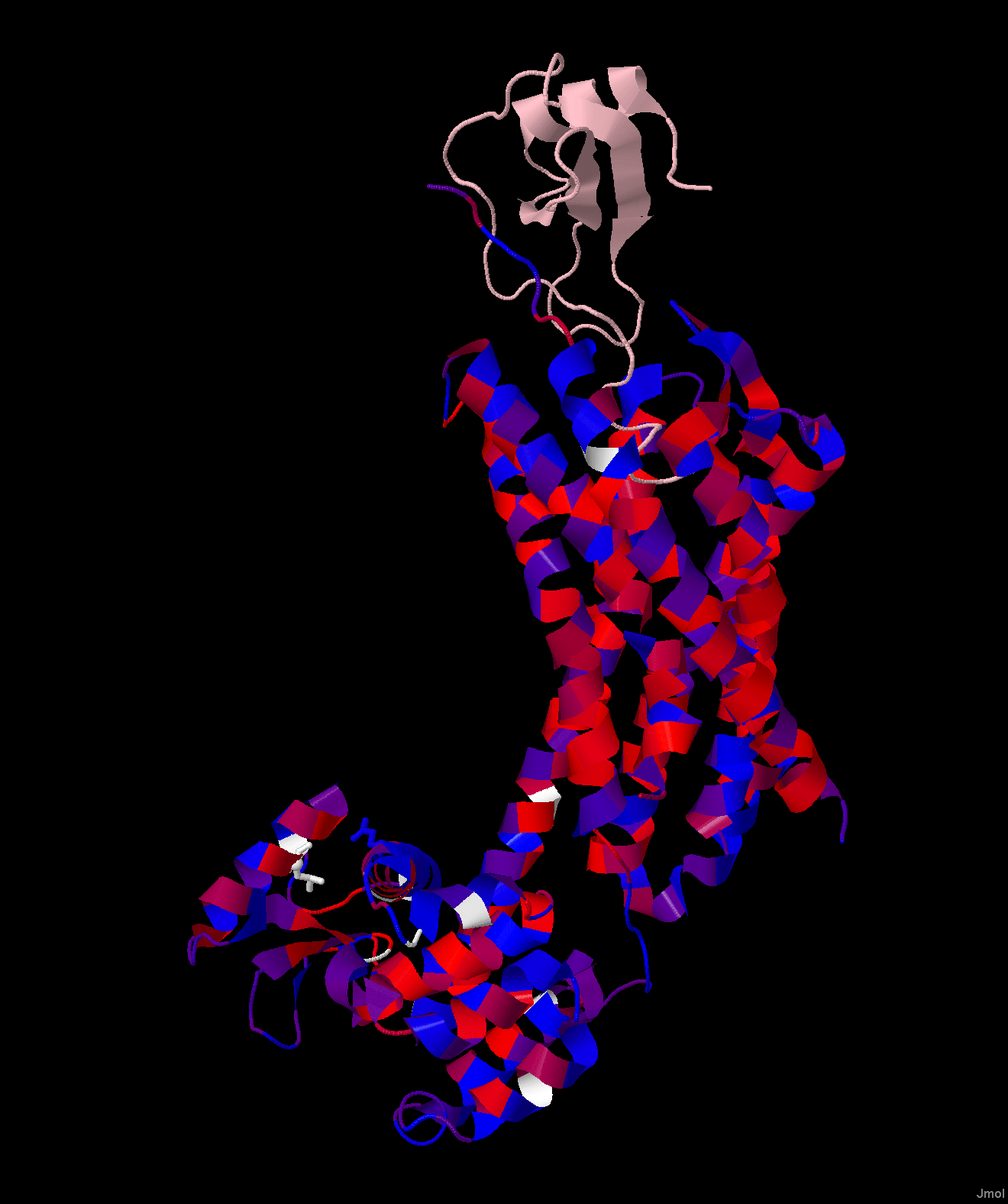
Рисунок 3. Белок 4RWS, раскрашенный по гидрофобности (Hydrophobicity). Розовым цветом показан вирусный белок, входящий в состав комплекса с рецептором.
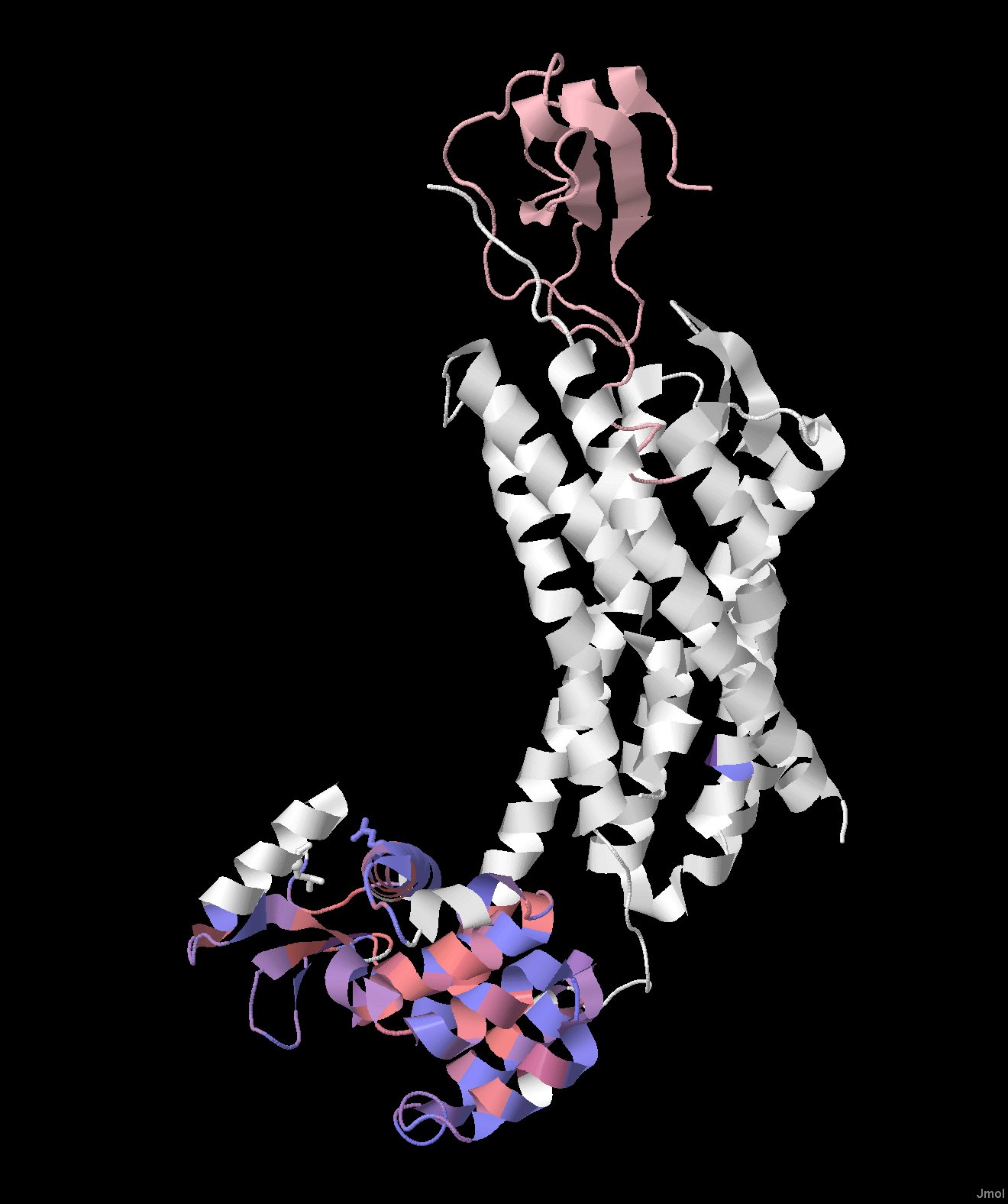
Рисунок 4. Белок 4RWS, раскрашенный по степени консервативности последовательности в выравнивании. Видно, что консервативной является внутриклеточная чать белка, а не трансмембранный участок.
Исследуемый белок относится к семейству рецепторов, сопряженных с G-белками. Такие рецепторы встречаются только у эукариот, и для них характерно наличие семи трансмембранных α-спиралей. Полученный результат можно попытаться объяснить тем, что, видимо, трансмембранный домен для рецепторов, сопряженных с G-белками, не является консервативным, в отличие от внутриклеточного домена, ответственного за взаимодействие с G-белками.
© Наталья Ланина
e-mail: n.lanina@fbb.msu.ru
последний раз обновлялось: 24.11.15