Восстановление окружения молекулы белка в кристалле.
Восстановление кристалла.
Расположение белковых цепей в структуре ДНК-белкового комплекса 3HDD.
PDB структура 3HDD представляет структуру комплекса гомеодомена engrailed с ДНК. Разрешение для данной структуры 2.2 Å. На рисунке 1 изображен данный комплекс.
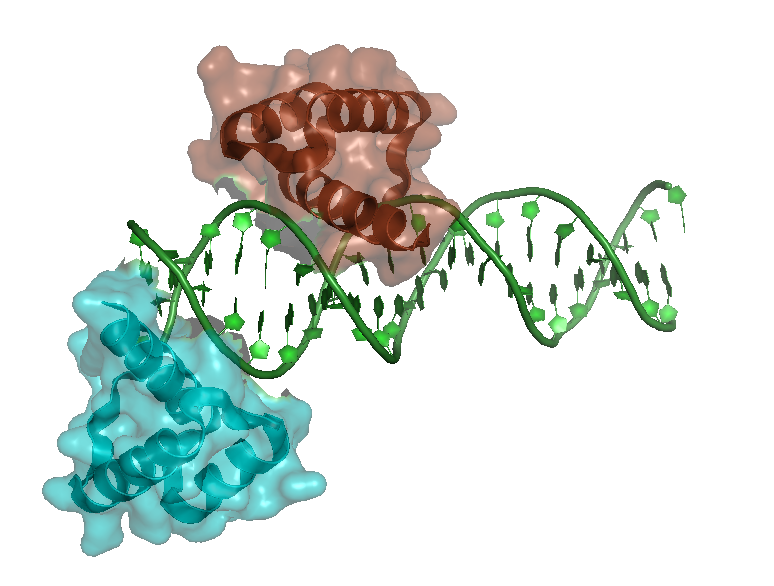
Рисунок 1. Изображение ДНК-белкового комплекса 3HDD. Цепи белка изображены голубым и коричневым цветом, ДНК - зеленым.
symexp sym, 3hdd, chain b, 4Таким образом было получено изображение всех молекул, расположенных на расстоянии 4 Å от белковой цепи B (рисунок 2).
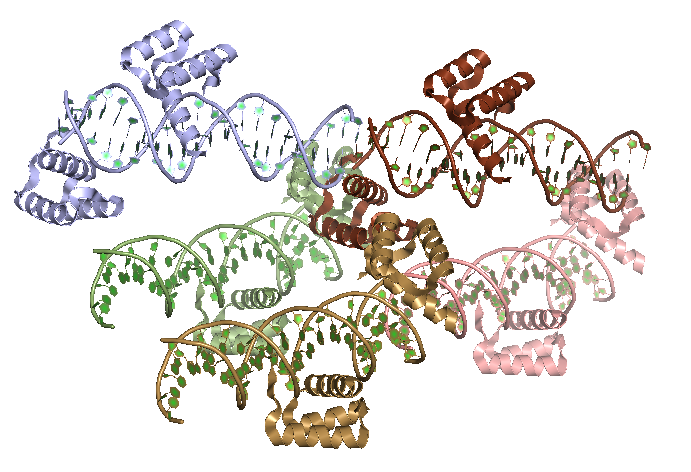
Рисунок 2. Изображение соседних кристаллографических ячеек. Исходная структура изображена коричневым цветом.
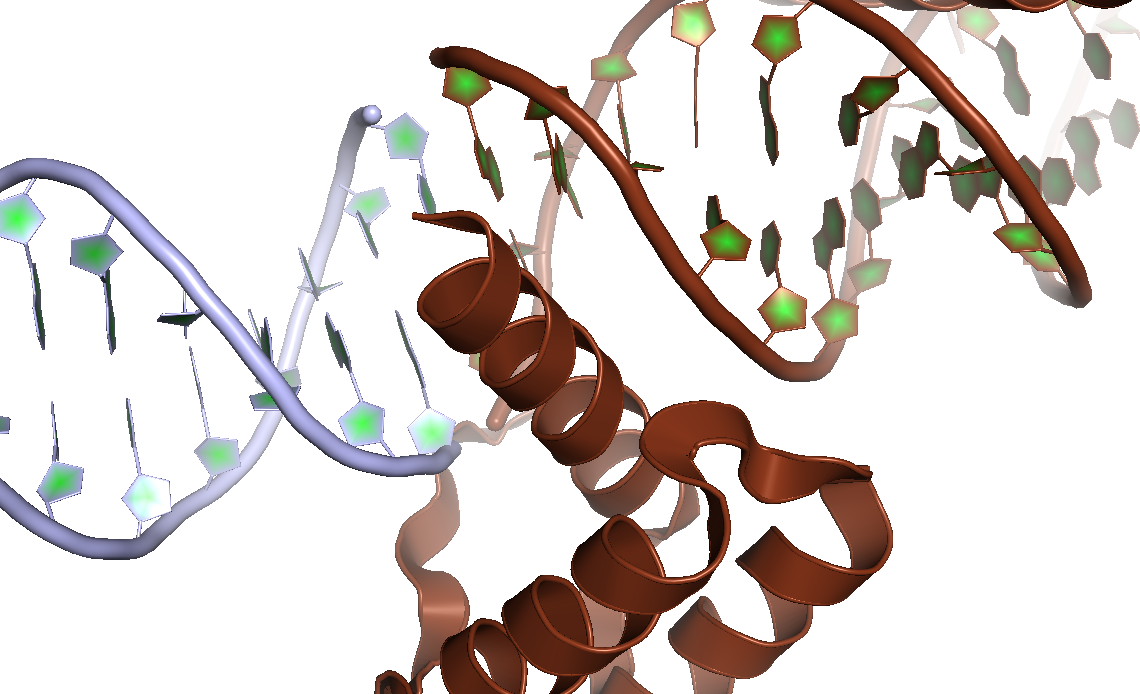
Рисунок 3. Контакт α-спирали цепи B с большой бороздкой ДНК соседней ячейки (изображена голубым цветом).
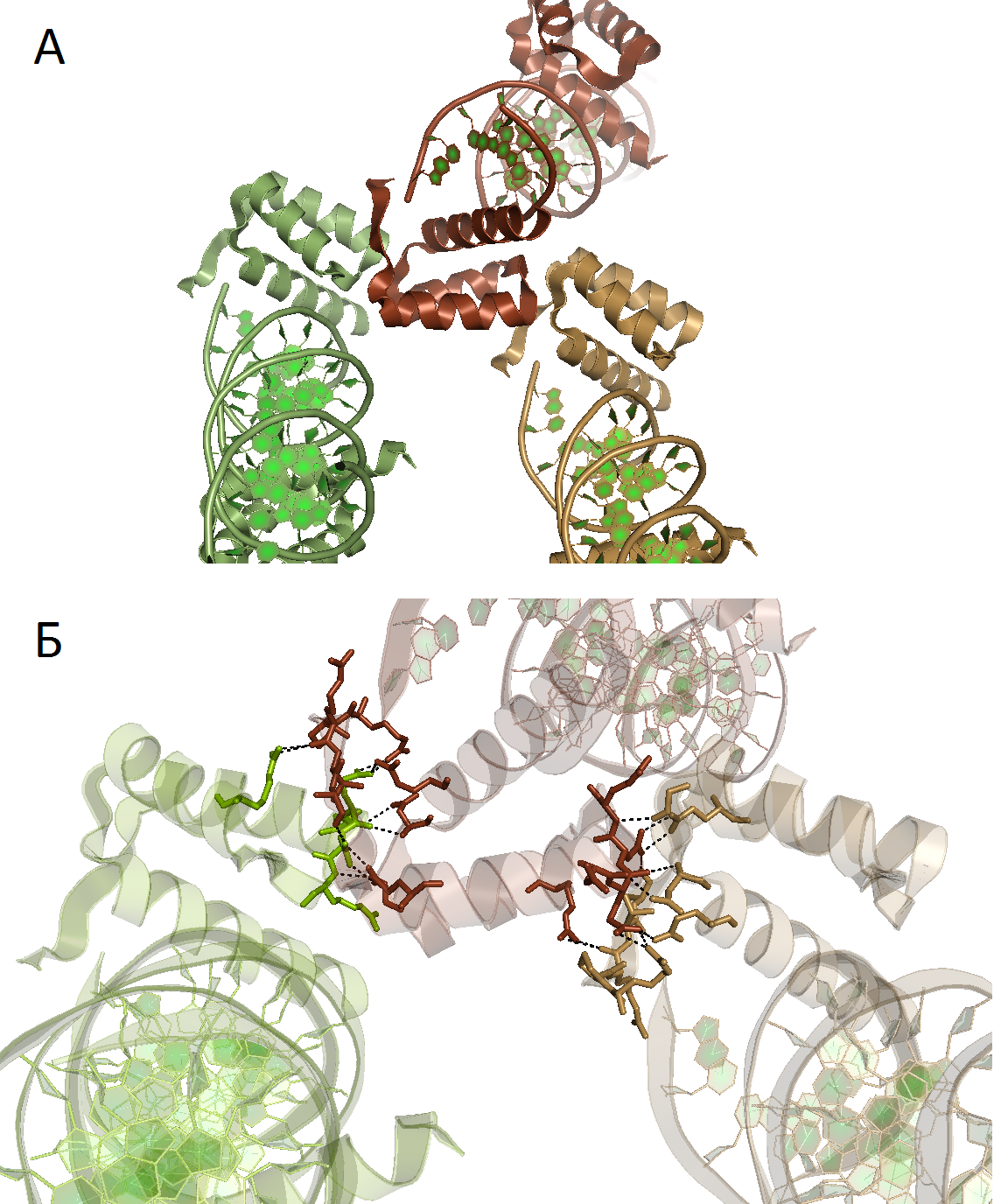
Рисунок 4. Контакт цепи B с цепями B двух соседних кристаллографических ячеек; А) общий вид контакта; Б) водородные связи, образующие контакты между соседними ячейками.
select Bres, byres (chainB within 3.5 of sym*) select DNAres, byres (sym* within 3.5 of chainB) distance hbonds, Bres, DNAres, 3.5, 2В результате было получено изображение водородных связей между цепью B исходного комплекса с двойными спиралями ДНК соседних ячеек (рисунки 5, 6, 7).
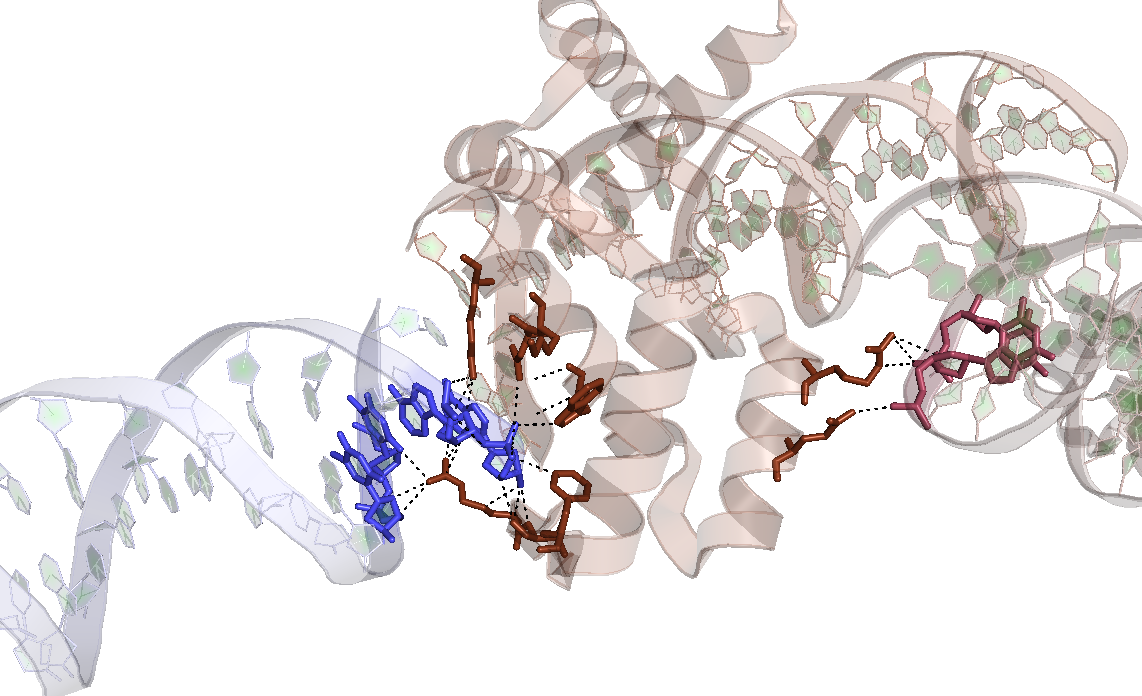
Рисунок 5. Водородные связи, образующие контакт цепи B белка исходного комплекса с двумя молекулами ДНК соседних ячеек.
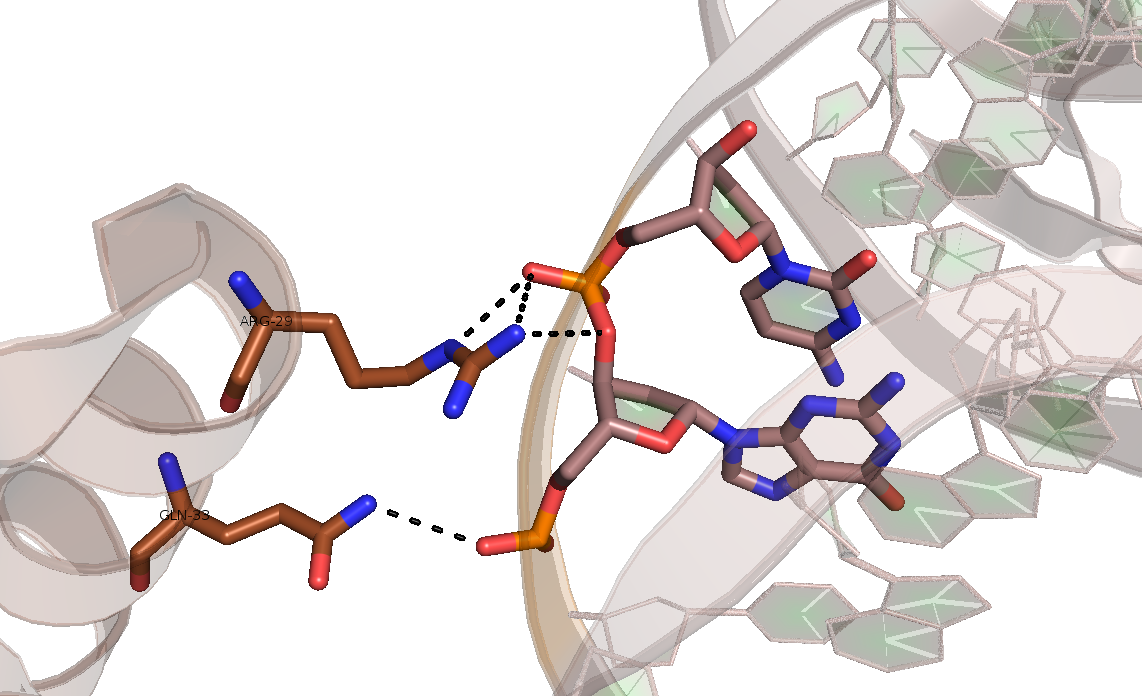
Рисунок 6. Водородные связи, образованные Arg-29 и Gln-33 и фосфатами остова ДНК.
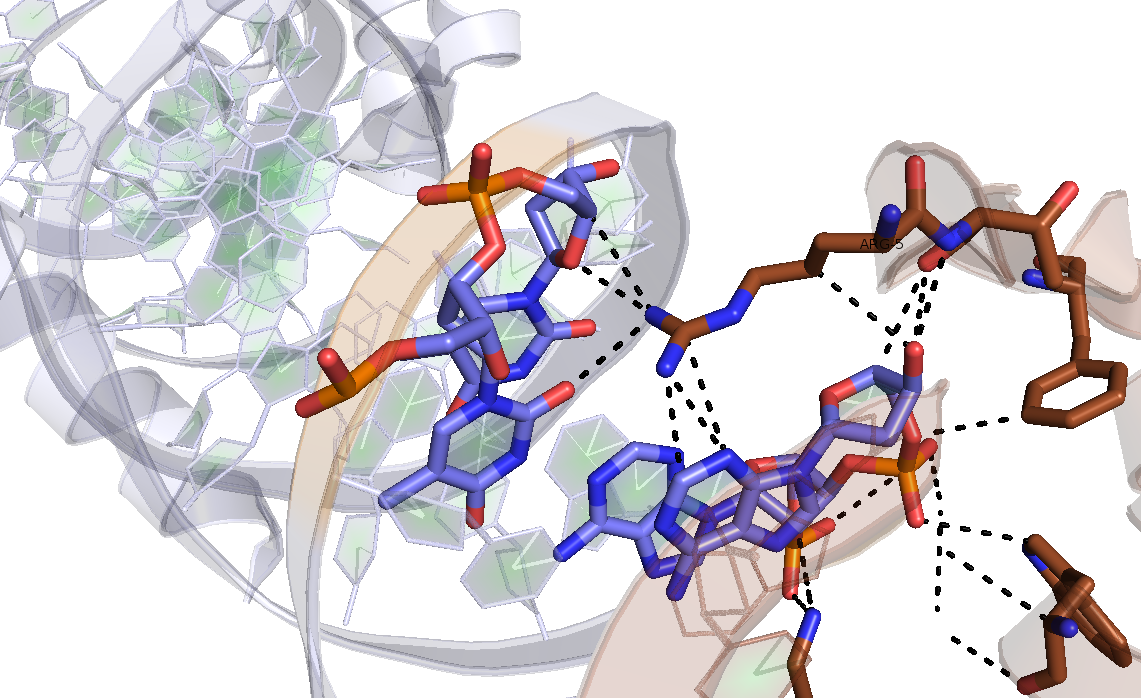
Рисунок 7. Водородные связи, образованные Arg-5 азотистыми основаниями ДНК.
Вывод:
Таким образом, странное расположение белка, находящегося "на краю" цепи ДНК объясняется тем, что в кристалле присутствуют другие молекулы ДНК и белков, которые влияют на его положение. Для полного анализа структуры может быть недостаточно одной ячейки, так как молекулы соседних ячеек могут влиять на положение молекул в рассматриваемой ячейке.Контакты молекул, поддерживающие структуру кристалла белка 4IP7.
Белок 4IP7 - печеночная пируваткиназа человека. Ассиметрическая единица представлена гомотетрамером (рисунок 8).
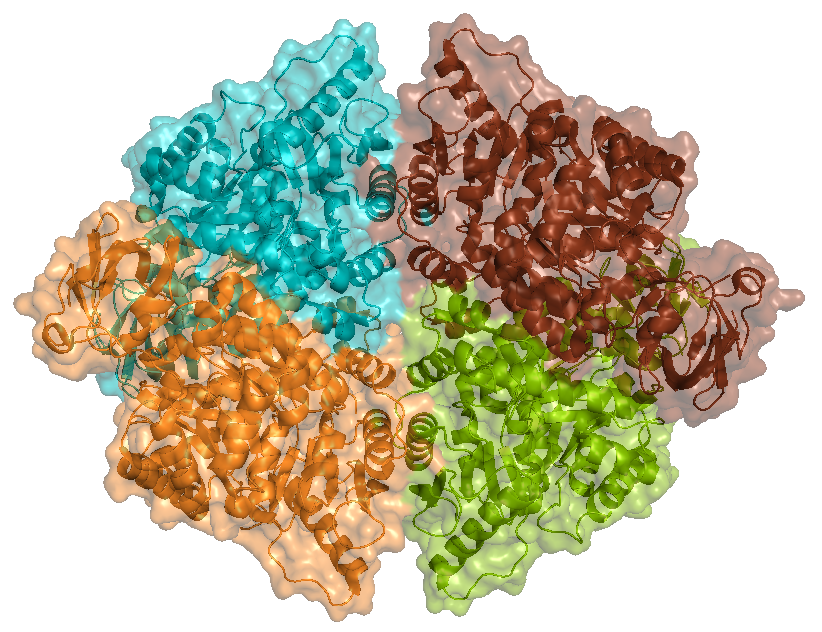
Рисунок 8. Ассиметрическая единица белка 4ip7, представленная гомотетрамером. Каждая белковая цепь покрашена своим цветом.
CRYST1 130.620 45.520 72.930 90.00 118.32 90.00 C 1 2 1 8Первые три числа задают размер ячейки (длины направляющих векторов), следующие три числа соответствуют углам между векторами. Число молекул в ячейке равно 8. Название кристаллографической группы C 1 2 1 означает, что элементарная ячейка 4IP7 – моноклинной сингонии (углыα и γ - прямые, а β - тупой), с примитивной решёткой Бравэ. В файле .pdb заданы следующие операторы симметрии:
X, Y, Z -X, Y, -Z X+1/2, Y+1/2, Z -X+1/2, Y+1/2, -ZДля того, чтобы проанализировать внутрикристаллические связи, было построено изображение соседних белковых молекул. Для этого в PyMOL использовалась команда:
symexp sym, 4ip7, 4ip7, 5, 1На рисунке 9 изображены 8 соседних молекул. Видно, что 6 молекул окружают белок в одной плоскости, и еще 2 расположены как бы сверху и снизу.
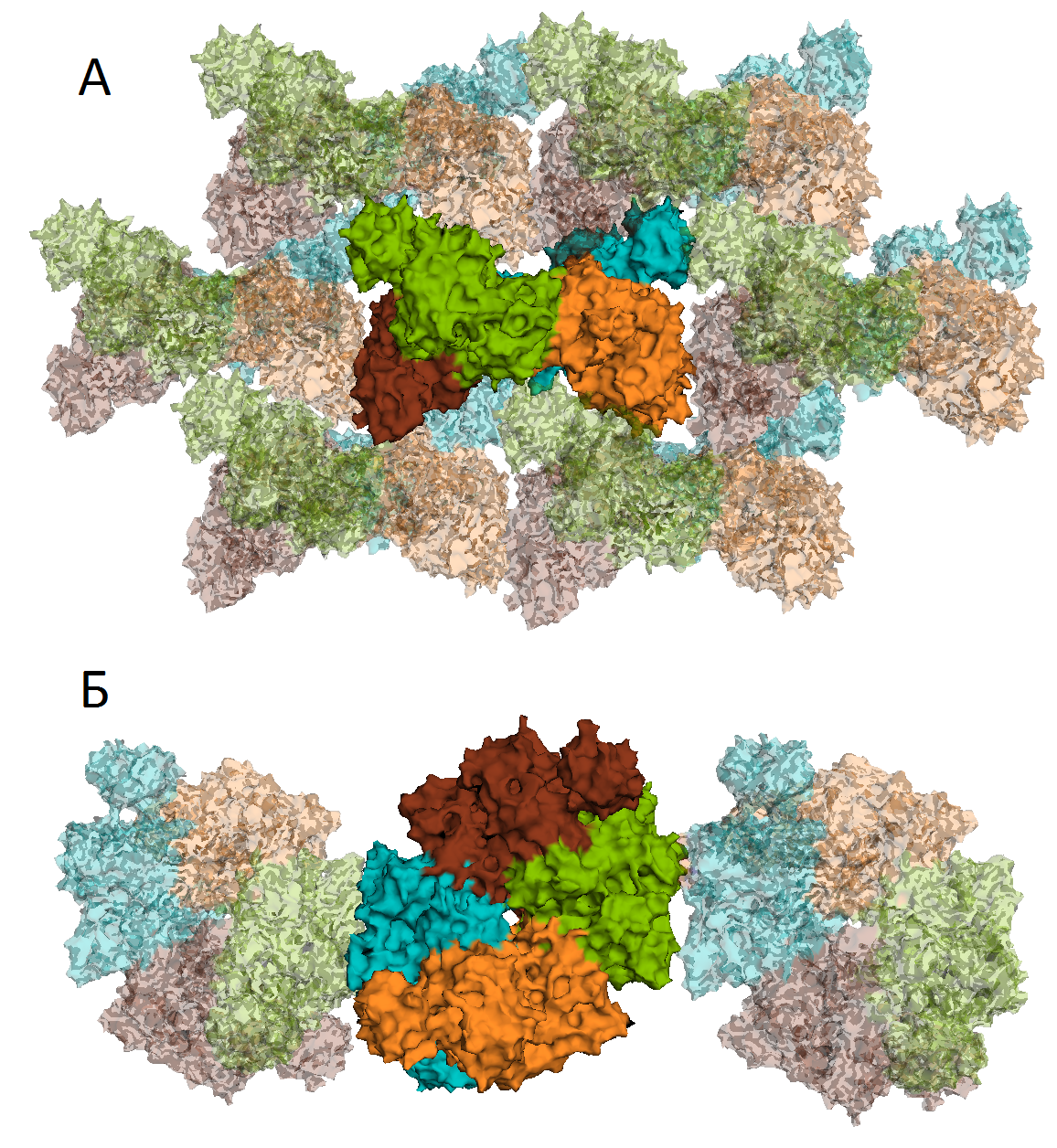
Рисунок 9. Изображение соседних молекул белка, расположенных на расстоянии 5 Å от исходной молекулы. На рисунке показаны две различные проекции.
select Ares, byres (chainA within 3.5 of sym*) select symAres, byres (sym* within 3.5 of chainA)В результате было выделено 5 различных типов контактов. На рисунке 10 отмечены четыре типа контактов между белковыми цепями, которые видны в проекции рисунка 9 А. Пятый тип контакта виден на рисунке 9 Б - контакт между зеленой и голубой субъединицами.
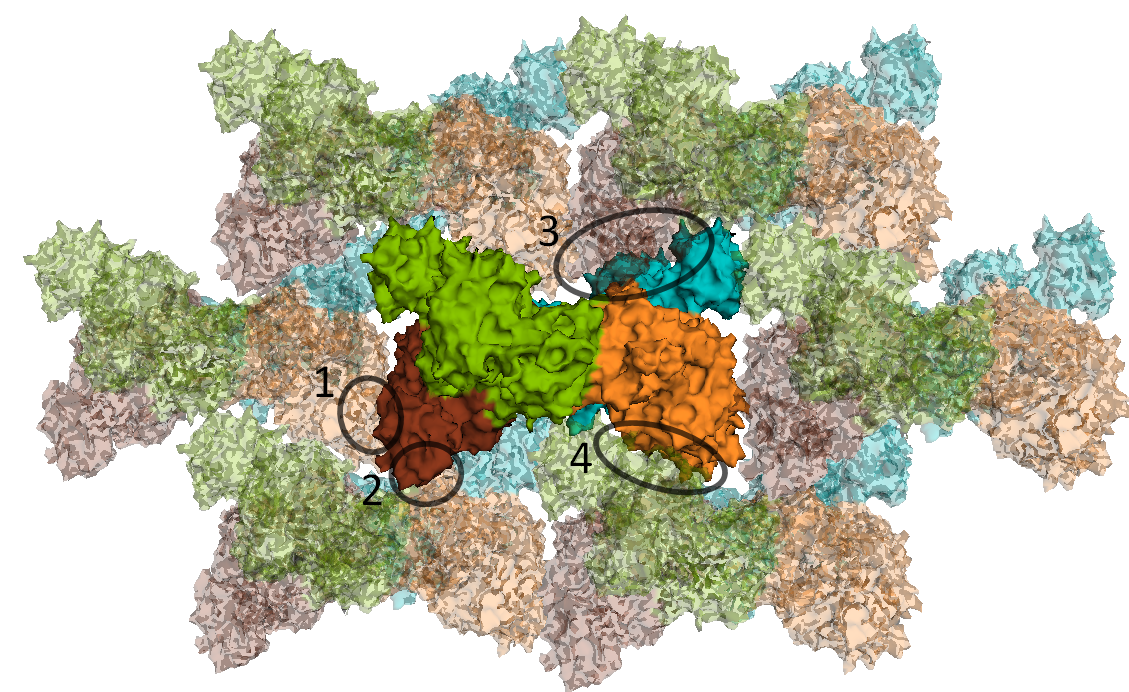
Рисунок 10. Четыре различных типа контакта с белками соседних ячеек.
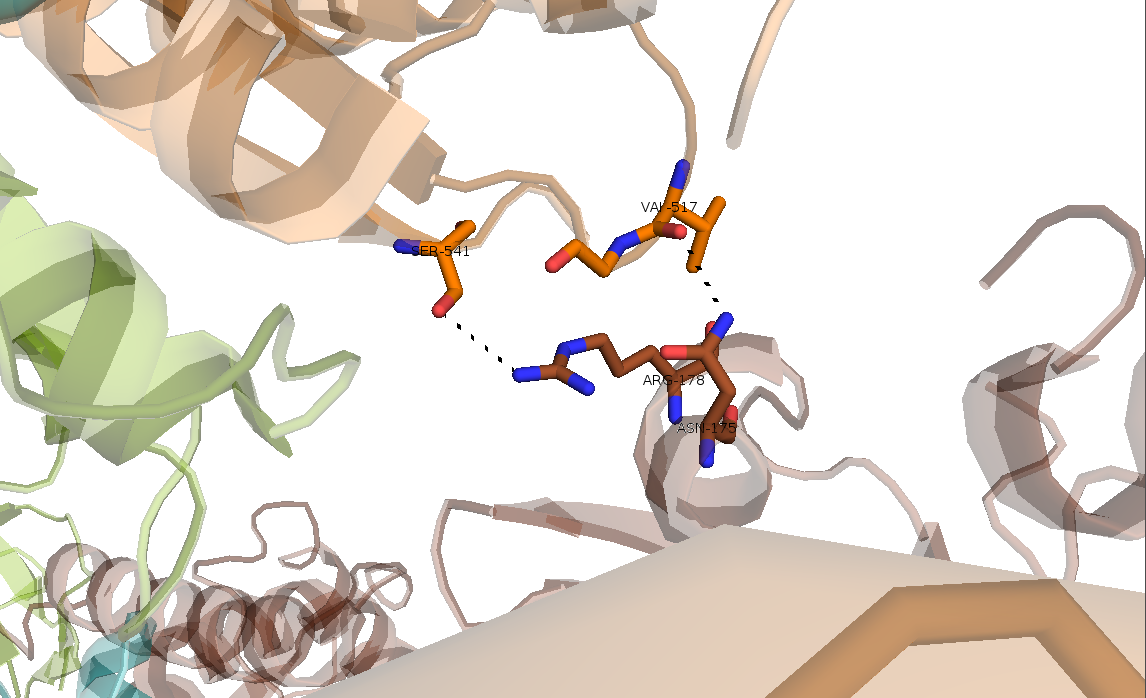
Рисунок 11. Первый тип контакта, образованный водородными связями Arg-178..Ser-541 и Asn-175..Val-517.
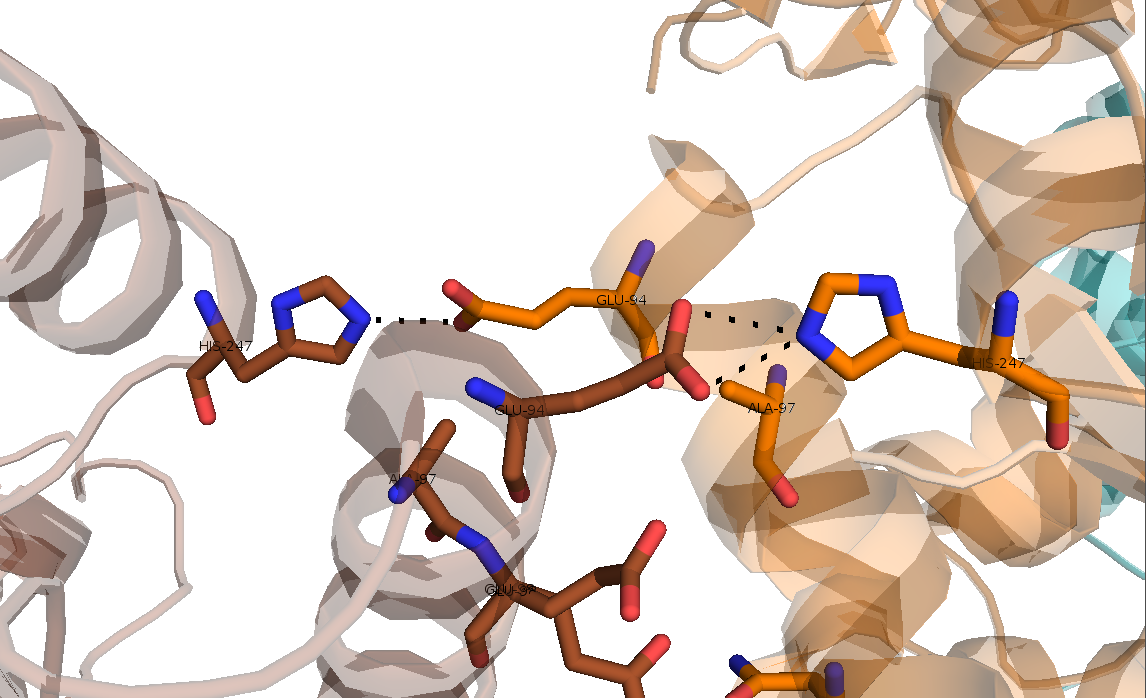
Рисунок 12. Второй тип контакта, образованный водородными связями His-247..Glu-94 и Glu-94..His-247.
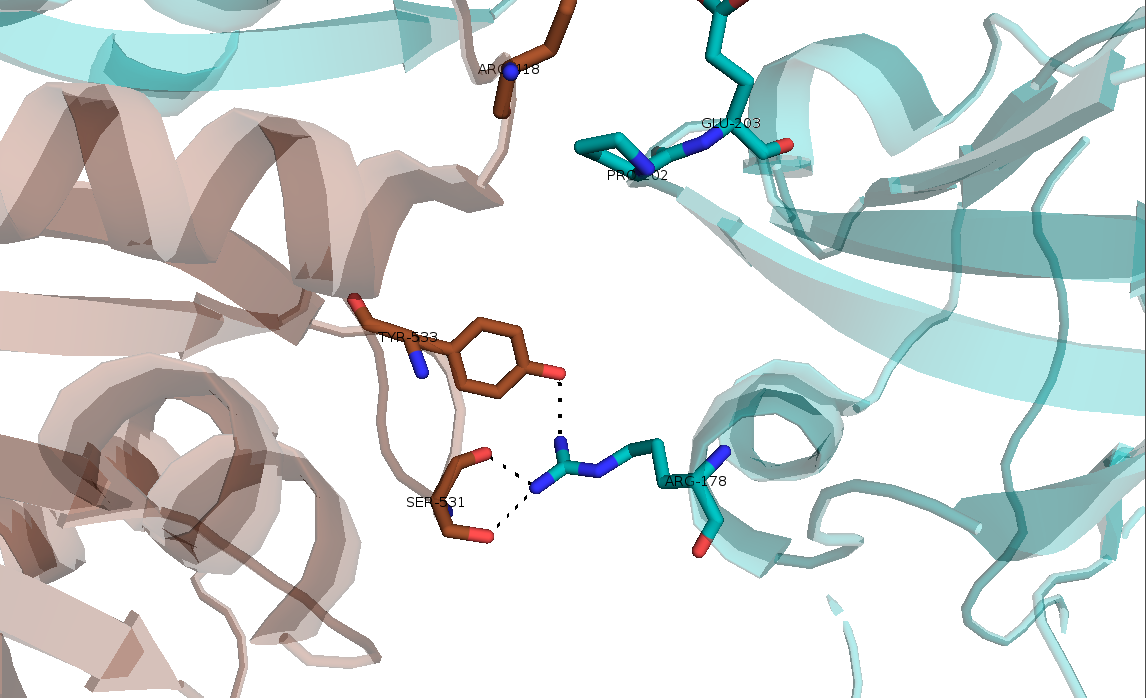
Рисунок 13. Третий тип контакта, образованный водородными связями Arg-178..Tyr-533 и Arg-178..Ser-531.
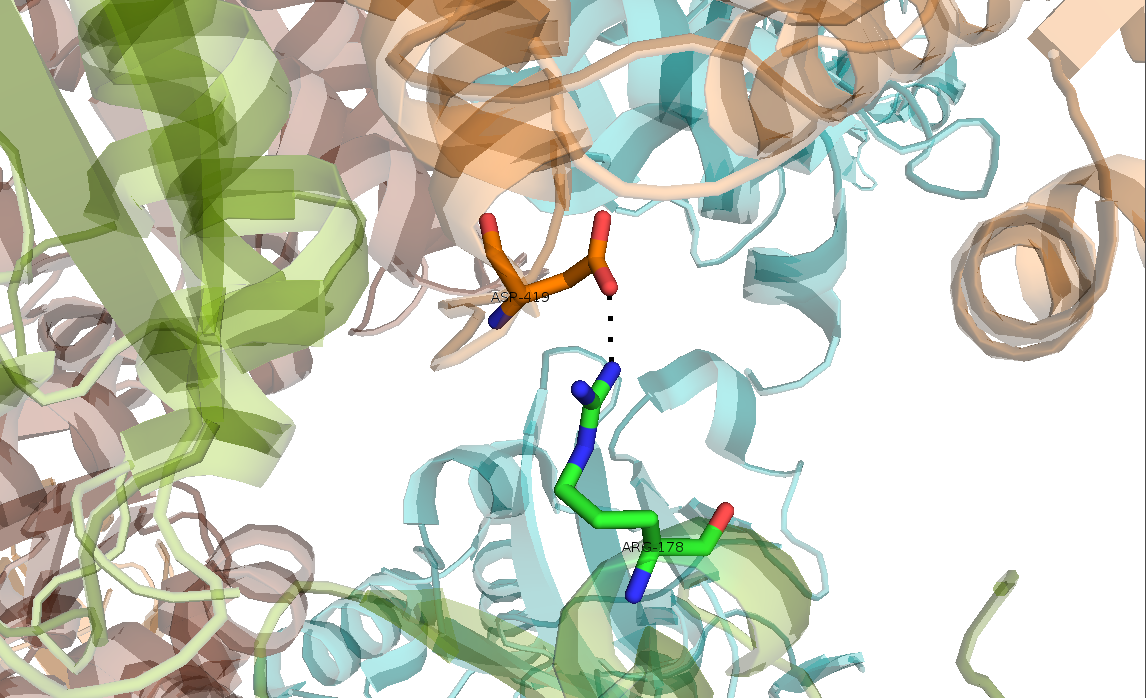
Рисунок 14. Четвертый тип контакта, образованный водородными связями Asp-419..Arg-178.
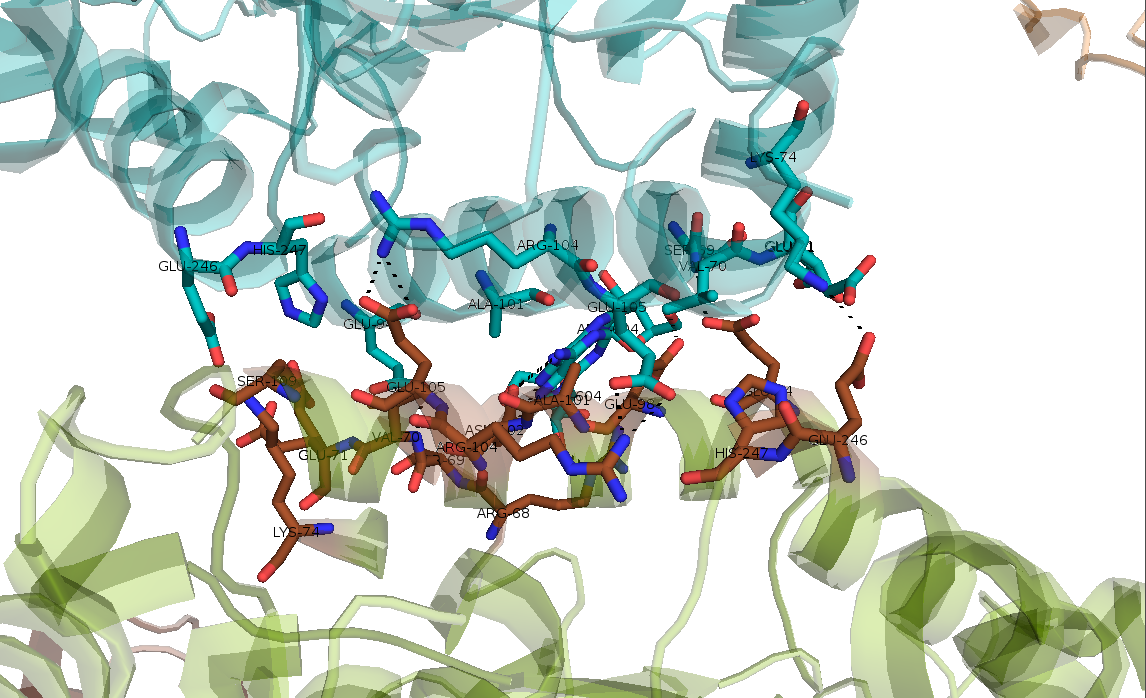
Рисунок 15. Пятый тип контакта, образованный водородными связями Lys-74..Glu-246, Glu-105..Arg-104, Val-70..Glu-94, Glu-94..Val-70 и Arg-104..Glu-105.
select phob, resn leu+ile+val+phe+trp+met distance phobcont, byres(phob and 4ip7), byres(phob and sym*), 4 select phobres1, byres((phob and 4ip7) within 4 of (phob and sym*)) select phobres2, byres((phob and sym*) within 4 of (phob and 4ip7))Последние две команды выдали пустое множество. Таким образом, видимо, гидрофобные взаимодействия не участвуют в подддержании структуры кристалла. На рисунке 16 изображен фрагмент контакта белков, раскрашенных по гидрофобности, он иллюстрирует отсутствие гидрофобных взаимодействий, так как на поверхности белков нет крупных гидрофобных участков, и все небольшие участки расположены на напротив друг друга.
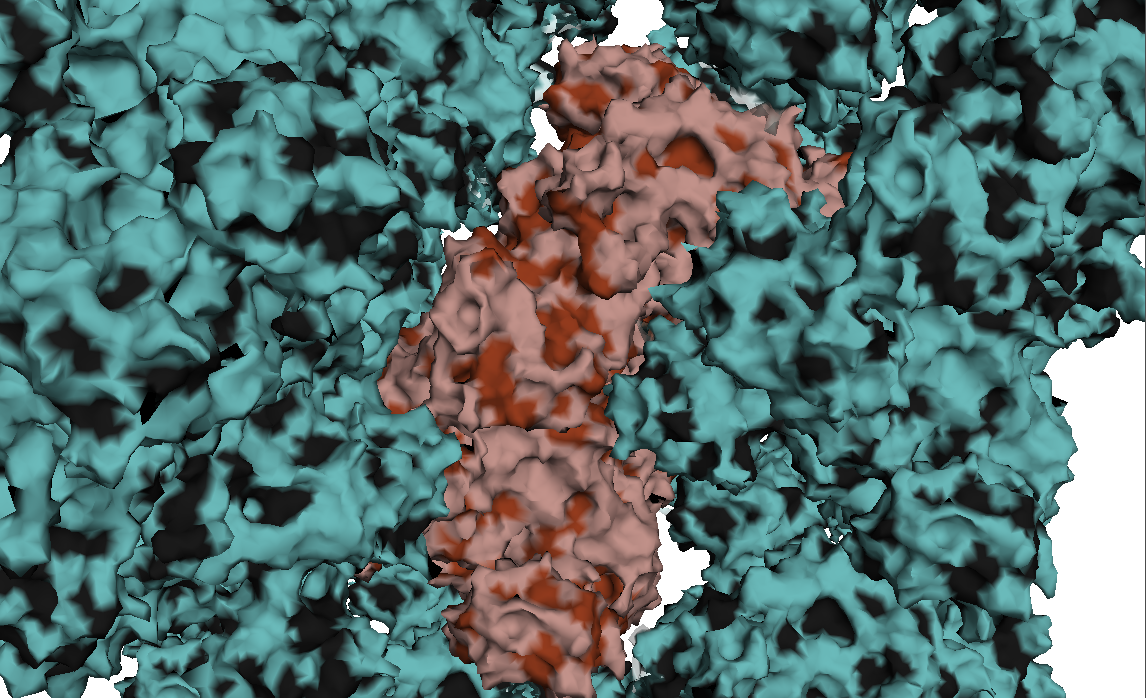
Рисунок 16. Фрагмент поверхности белков в области контакта. Коричневым цветом изображен исходный белок, голубым - соседние молекулы, контактирующие с исходным. Темным цветом выделены гидрофобные области, они не образуют крупных пятен и не соответствуют друг другу пространнственно у различных цепей.
Выводы:
Анализ взаимодействий соседних молекул в кристалле позволяет получить более полное представление о структуре. Эти взаимодействия периодичны (например, оба контакта на рисунке 9 Б абсолютно симметричны), что соответствует периодическому строению кристалла. Структура кристалла белка 4IP7 поддерживается только водородными связями, гидрофобные взаимодействя между белковыми цепями соседних ячеек отсутствуют.© Наталья Ланина
e-mail: n.lanina@fbb.msu.ru
последний раз обновлялось: 6.1.15