База данных OPM
Я решил взять интересный мне белок коннексин-46 из овцы (Uniprot CXA3_SHEEP, PDB 6mhq), который участвует в образовании щелевых контактов, которые крайне важны для образования электрических синапсов, по которым ионы и мелкие молекулы могут быстро перескакивать из клетки в клетку. Коннексины собираются в комплексе 6 штук на мембране одной клетки и взаимодействуют с таким же комплексом на мембране другой клетки, образуя коннексон.
Параметры для коннексина-46 представлены в таблице ниже.
| Толщина трансмембранной части белка | 31,2 А |
| Координаты трансмембранных участков | 21-48, 74-91, 147-167, 194-220 |
| Среднее количество остатков в одной альфа-спирали | 23 |
| Месторасположение | Цитоплазматическая мембрана хрусталика (тканеспецифичен) |


DeepTMHMM
Для белка коннексина-46 выдача в ggf3 и 3line форматах:
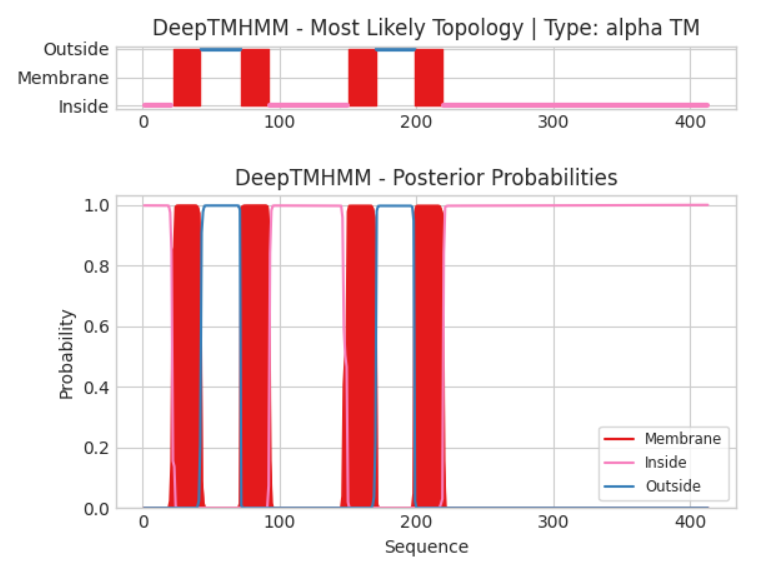
На верхнем изображении представлено топология белка в мембране, где красным выделены трансмембранные участки, синим - внеклеточные, а фиолетовым - внутриклеточные. На нижнем изображении представлены вероятности для каждого остатка белка оказаться в каждой из вышеперечисленных категорий (трансмембранный, внутри- и внеклеточный).
Для выданного мне белка Y1362_ENT38 выдача в gff3 и 3line форматах:
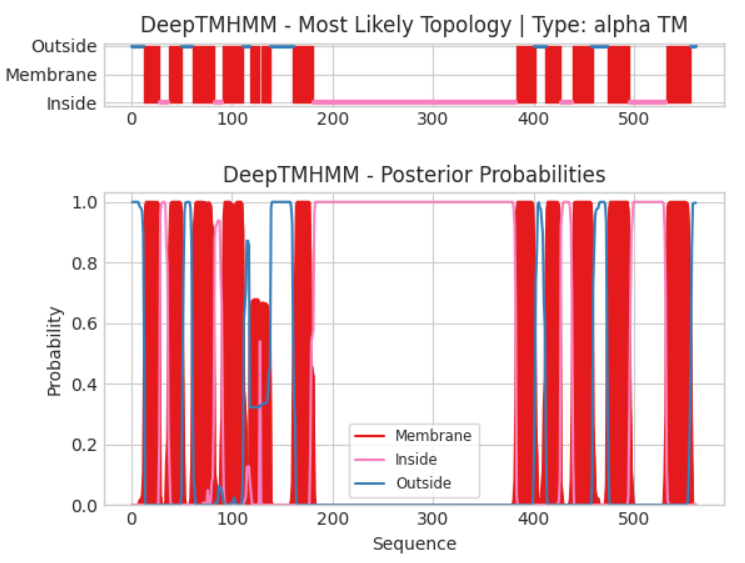
Выдача та же самая, но можно заметить, что количество трансмембранных участков больше.
Предсказание положения белка в мембране через PPM
Белок является предполагаемым транспортным. Как видно из выдачи DeepTMHMM N-конец белка располагается вне клетки (N-ter out). Найден в бактерии рода Enterobacter sp., которая является грамотрицательной, что препятствует однозначному определению мембраны (у них имеется две). Но, исходя из структуры, полученной с помощью AlphaFold, можно сказать, что пронизывает лишь одну мембрану. Allow curvature ставим no, так как мембраны достаточно жесткие. Нестандартных аминокислот не имеется, так как белок найден по гомологии.
Как видно на Рис.3, было обнаружено 12 трансмембранных участков. Красным изображена наружная сторона мембраны, синим - внутренняя.
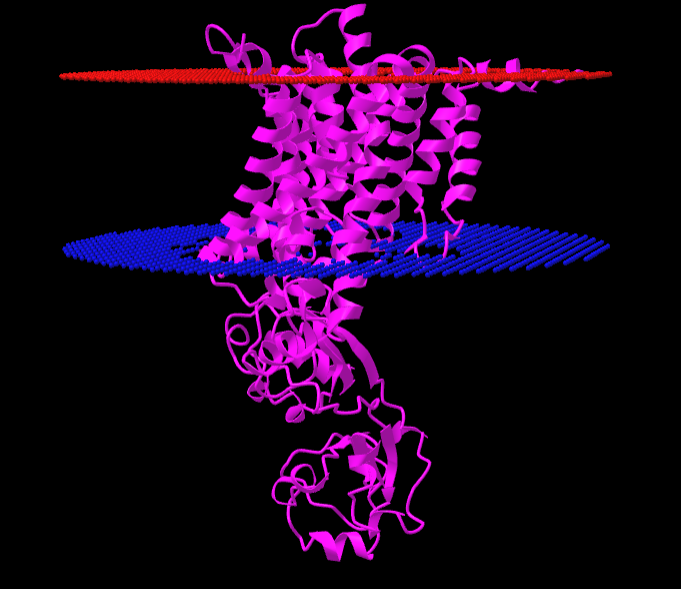
| Толщина трансмембранной части белка | 27.2 А |
| Координаты трансмембранных участков | 12-29, 39-53, 59-79, 90-111, 119-132, 133-144, 159-178, 383-398, 412-426, 439-461, 471-494, 537-556 |
| Среднее количество остатков в одной альфа-спирали | 18 |
| Месторасположение | Наружная или внутренняя мембрана |
Сравнение алгоритмов
Для Y1362_ENT38 через DeepTMHMM и PPM было обнаружено 12 трансмембранных участков в обоих случаях. Немного отличаются границы участков (на 1-6 остатков), но в целом результаты аналогичны.
Для белка CXA3_SHEEP для DeepTMHMM и OPM выдавали также сильно похожие результаты по положению трансмембранных участков и одинаковое количество участков (4).
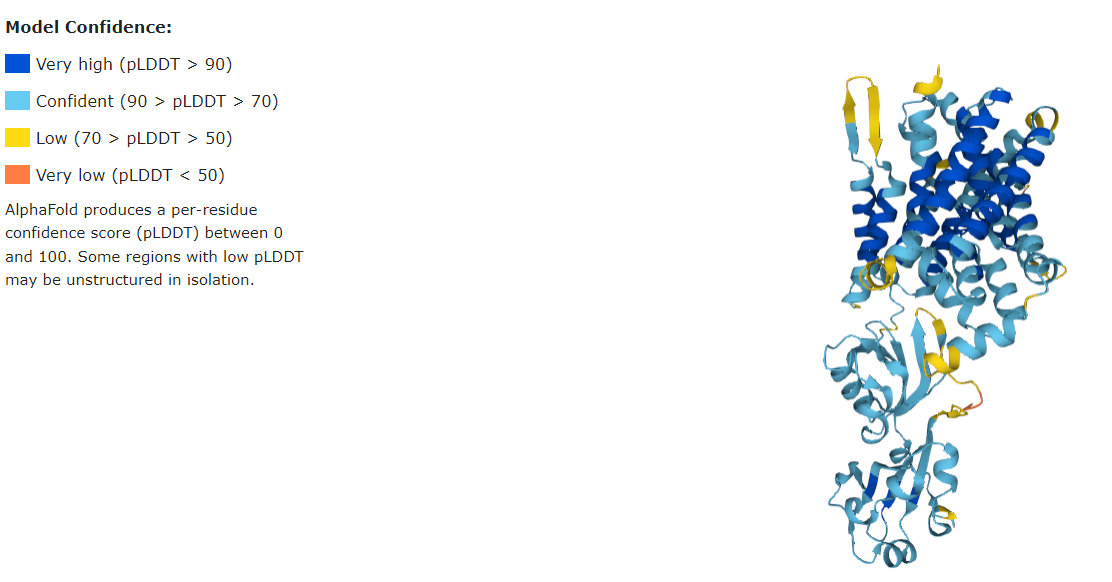
Касаемо качества предсказания структуры можно сказать, что AlphaFold большинство участков трансмембранных альфа-спиралей предсказал с очень высоким качеством (pLDDT > 90), наружный участок предсказан, в основном, с высоким качеством. Имеются небольшие участки с низким качеством - различные линкеры между двумя альфа-спиралями. И всего два участка с очень низким качеством - для трех аминокислот (ASP205 - LYS207). В целом, можно сказать, что AlphaFold достаточно хорошо предсказывает структуру белка. Маловероятно, что достоверность модели могла внести значимый отрицательный вклад в предсказание PPM.
База данных TCDB
Для выданного мне белка (AC A4W8L3) и выбранного мной (AC Q9UT17) TCDB выдал следующее - Sorry! *AC* is not included in TCDB, что крайне грустно. Для коннексина есть только описание его семейства. Поэтому, чтобы задание можно было хоть как-то оценить, то я возьму другой белок из OPM, который есть в TCDB.
Я взял кальциевую-АТФазу (SERCA) с кодом TCDB 3.A.3.2.43, которая располагается на мембране ЭПР и играет важную роль в поддержании внутриклеточной концентрации кальция (заполняет ЭПР ионами кальция). Основная информация о структуре белка, конформационных изменениях, который он претерпевает при связывании кальция. Даны многочисленные ссылки на статьи. Интересно, что SERCA ингибируют различные одиночные мембранные белки, в частности, фосфоламбан, сарколипин и миорегулин, которые тем самым регулируют сокращение мышц. При открытии поры изменяется локальная толщина бислоя и происходит наклон молекулы в месте пояса из Trp. Arg используется в качестве якоря, чтобы закрепиться за фосфолипиды при наклоне.
Цифры кода: 3 - Первичные активные транспортеры, A - Транспортеры, управляемые гидролизом полипропиленовой связи, 3 - Суперсемейство АТФаз P-типа (P-ATPase), 2 - подсемейство, 43 - субстрат (кальций)