Мини-обзор генома бактерии Borrelia garinii
Зехова Анастасия Сергеевна
ФББ МГУ имени М.В. Ломоносова
Аннотация
В данной работе был проведён анализ генома и протеома бактерии Borrelia garinii. На основе построенных гистограммы длин белков, GC состава и межгенных расстояний были сделаны выводы об особенностях генома и протеома бактерии.
1 Введение
Вид спирохет бактерий рода Borrelia, возбудитель боррелиоза предельные температуры роста — 27–37 °С, микроаэрофилы (могут обитать в бескислородной среде или в среде с концентрацией кислорода не более 2%) [1].
Таксономия Borrelia garinii
| Домен: | Bacteria |
| Филлум: | Spirochaetota |
| Класс: | Spirochaetia |
| Порядок: | Spirochaetales |
| Семейство: | Borreliaceae |
| Род: | Borrelia |
| Вид: | B.garinii |
2 Методы
1. Генетические данные по микроорганизму
получены из баз данных NCBI и UniProt.
2. Для анализа таблиц и построения гистограмм
использовались Google sheets.
3. Анализ данных проводился на языке
программирования Bash.
3 Результаты
3.1 Длины белков, закодированных в геноме Borrelia garinii
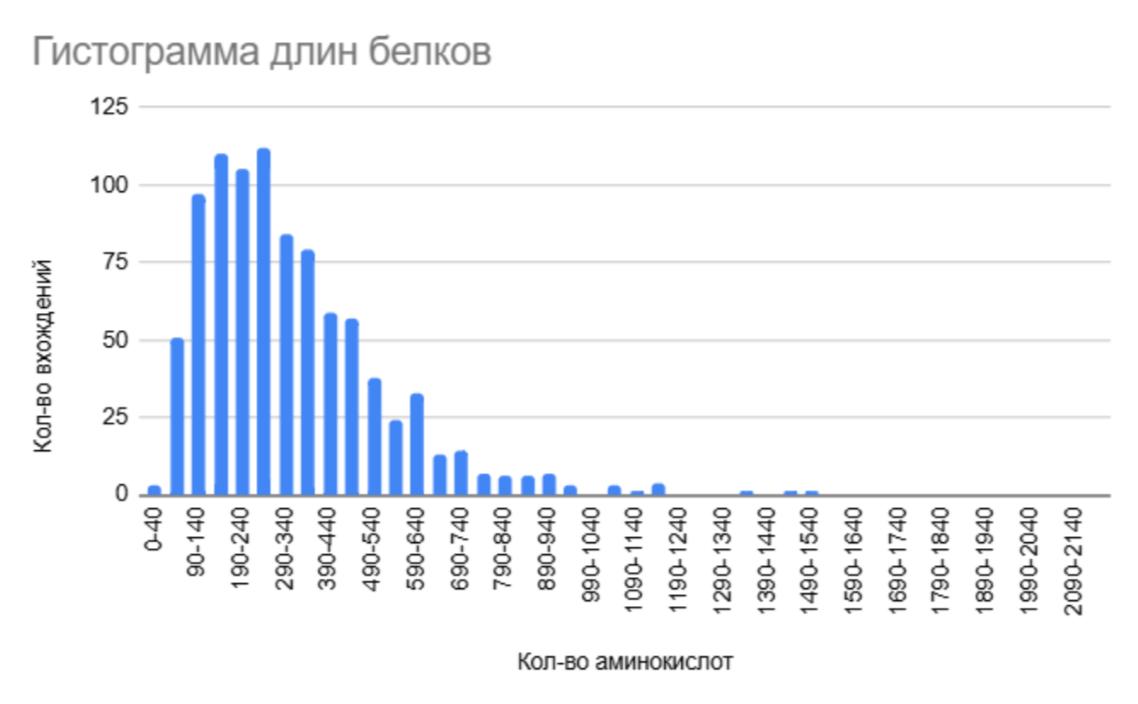
Для протеома бактерии было определено распределение белков по длине (рис.1), построена гистограмма.{1} Наиболее распространены белки длиной 140-290 аминокислот. Более длинные белки встречаются значительно реже. Минимальная длина белка - 28 ам. ост. , а максимальная - 2162 ам. ост.
3.2 Гистограмма GC% по CDS
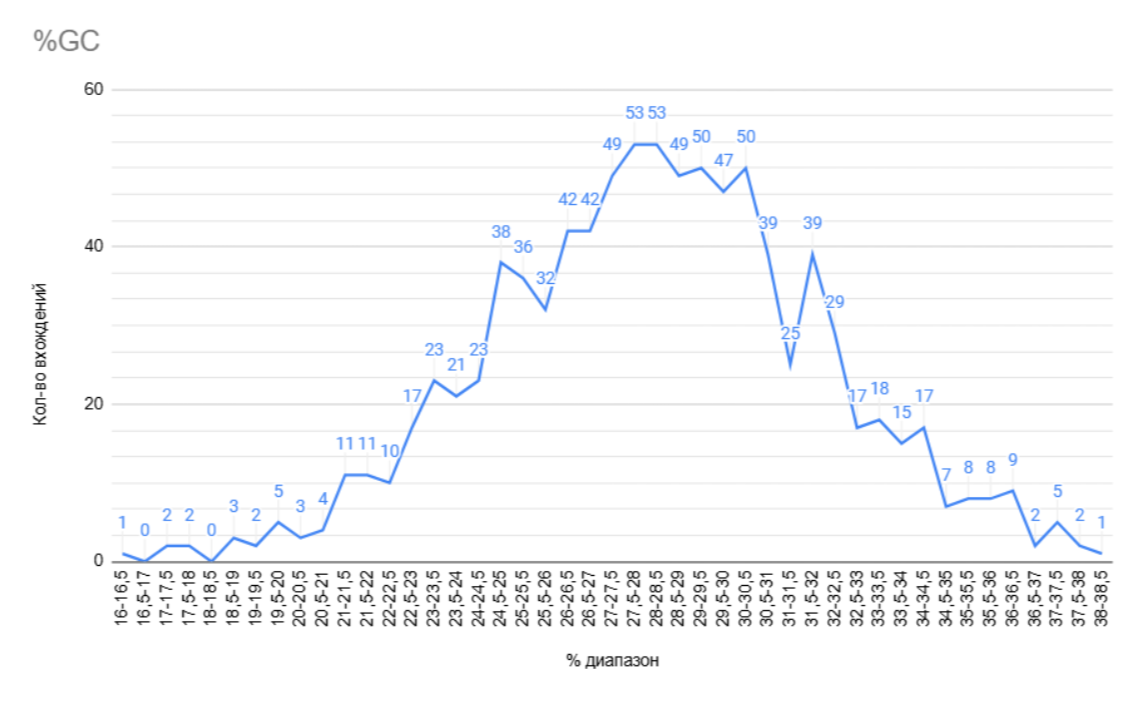
График показывает процентную долю содержания гуанина и цитозина в кодирующих последовательностях ДНК (CDS, Coding DNA Sequence) (рис. 2) {2}. Наибольшее содержание гуанина и цитозина 28-30%. ДНК с низким содержанием GC менее стабильна, чем ДНК с высоким содержанием GC, так как гуанин и цитозин удерживаются вместе тремя водородными связями. Но наиболее важным фактором, влияющим на термическую стабильность ДНК, является не столько количество водородных связей между основаниями, сколько стэкинг оснований. Пары GC имеют более благоприятную энергию стэкинга, чем AT или AU [2]. По GC-составу понятно, что бактерия живет в относительно умеренных температурных условиях.
3.3 Распределение генов в геноме Borrelia garinii
| seq_type | chromosome | CDS(with/witout_protein) | rRNA | tRNA | ncRNA | tmRNA |
|---|---|---|---|---|---|---|
| chromosome | linear | 810/8 | 6 | 32 | 2 | 1 |
| plasmid | cp26 | 28/0 | 0 | 0 | 0 | 0 |
| plasmid | lp54 | 64/10 | 0 | 0 | 0 | 0 |
Геном Borrelia garinii представлен одной хромосомой и двумя
плазмидами (ср26, lp54).
На основе анализа хромосомы и плазмид археи была
построена Таблица 2 {3}.
Из полученных данных следует, что большинство белок
кодирующих генов находится в хромосоме, плазмиды
несут только CDS. В них отсутствуют гены тРНК, рРНК,
тмРНК (транспортно-матричная РНК отвечает за
высвобождения рибосом, остановившихся в процессе
трансляции проблемных участков мРНК и разрушение
образовавшиеся при этом полипептидов [3]) и
некодирующие РНК, это значит, что плазмиды специально
предназначены для выполнения определенных
регуляторных функций, повышающих устойчивость
бактерий.
CDS делятся на два типа кодирующие белок и некодирующие
(псевдо-CDS)
3.4 Длина межгенных промежутков
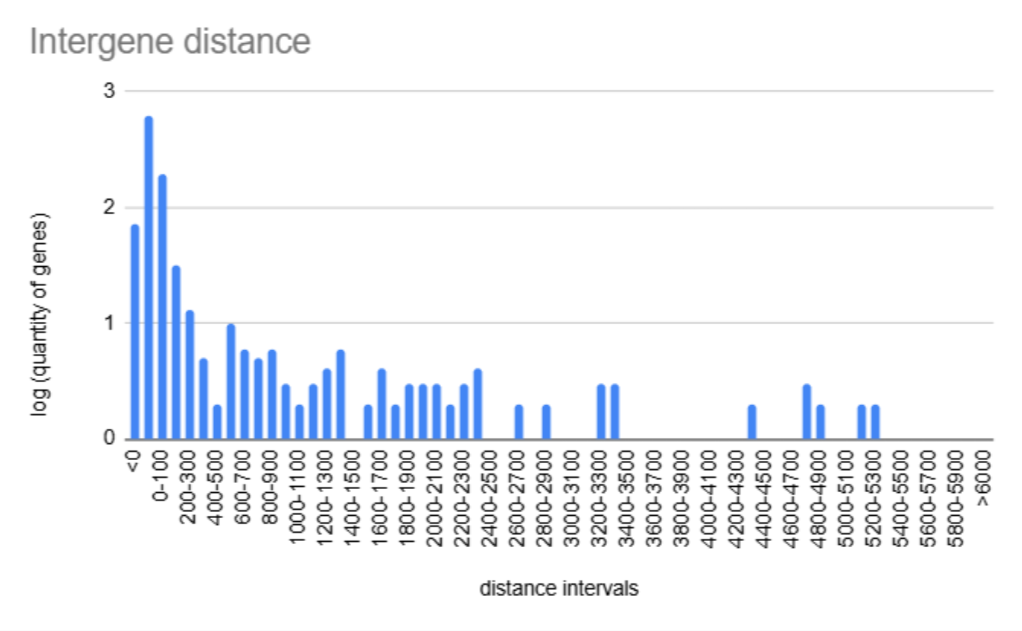
Была построена гистограмма расстояний между CDS на + цепи ДНК {4}. По оси Х межгенное растояние по оси Y логарифм генов, соответствующих определённому интервалу длин (рис. 3). Расстояние, равное нулю соответствует расположенным вплотную генам, расстояние, меньшее нуля - пересекающимся генам. Наиболее распространённое межгенное расстояние <0, то есть гены перекрываются и одни и те же участки генома находятся в разных генах, поэтому они могут иметь схожие функции, что свидетельствует об оперонной организации генома. Довольно большое количество генов Borrelia garinii умеют оперонную организацию, которая позволяет эффективно регулировать транскрипцию.
3.5 Белки в составе плазмид, связанные с болезнью Лайма
Также был проведен анализ белков, кодируемых плазмидами cp26 и lp54, и выявлены те, которые ответственны за реализацию болезни Лайма (табл.3). Оказалось, что плазмиды играют очень важную роль в этом процессе. В плазмиде cp26 гены, кодирующие эти белки, составляют 11%, а в lp54 - 24% {5}. Генетический обмен, в том числе перенос плазмид, способствует патогенности организма. Показано, что с потерей плазмид связана потеря способности организма заражать лабораторных животных, что позволяет предположить, что плазмиды кодируют ключевые гены, участвующие в вирулентности. В таблице 3 представлены белки, которые отвечают как за инвазию клещей, так и за заражение основного хозяина.
| Plasmid cp26 | Функции |
|---|---|
| alpha3-beta1 integrin-binding protein | для адгезии к клеткам-хозяевам и инвазии в них |
| Vsp/OspC family lipoprotein | для вторжения в слюнные железы клещей |
| ankyrin repeat domain-containing protein | много у облигатных внутриклеточных или факультативно-ассоциированных с хозяином бактерий (играют важную роль в симбиотических взаимодействиях бактерий с другими организмами) |
| Plasmid lp54 | |
| BBA07 family lipoprotein | способствует заражению млекопитающих при передаче через клещей |
| BBA14 family lipoprotein | борются с иммунной системой хозяина |
| outer surface lipoprotein OspA | защищает бактерию от приобретённого иммунитета хозяина, отвечает за прикрепление бактерии к среднему желудку клеща |
| outer surface lipoprotein OspB | играют важную роль в распространении, вирулентности и иммунном уклонении |
| decorin-binding protein DbpB | отвечает за инфекционность (связываются с протеогликаном внеклеточного матрикса) |
| decorin-binding protein DbpA | способствует заселению бактериями тканей человека, связываясь с гликозаминогликаном, сульфатированным полисахаридом |
| Lp6.6 family lipoprotein | облегчает передачу патогена от клеща к хозяину |
| complement regulator-acquiring protein | позволяют избегать иммунного ответа хозяина и успешно распространяться и размножаться |
| OMS28 family porin | способствует приспособленности спирохеты в течении клещевой фазы |
4 Сопроводительные материалы
- Гистограмма длин белков
- Гистограмма GC
- Генный состав
- Гистограмма межгенных расстояний
- Гены белков в %
5 Литература
- Benredjem, Wassila; Leulmi, Hamza; Bitam, Idir; Raoult, Didier; Parola, Philippe (October 2014). "Borrelia garinii and Rickettsia monacensis in Ixodes ricinus Ticks, Algeria"
- Yakovchuk, Peter; Protozanova, Ekaterina; Frank- Kamenetskii, Maxim D. (2006). "Base-stacking and base- pairing contributions into thermal stability of the DNA double helix". Nucleic Acids
- Kazemi Nezhad, Seyed Reza & Montazeri, F. & Hoseini, Seyed Mehdi. (2015). Role of the transfer-messenger RNA pathway _ trans-translation _ in bacterial physiology. Genetics in the Third Millennium. 13. 4014-4021.
- Blevins, J.S., Hagman, K.E. & Norgard, M.V. Assessment of decorin-binding protein A to the infectivity of Borrelia burgdorferi in the murine models of needle and tick infection. BMC Microbiol 8, 82 (2008).
- Hejduk, L., Rathner, P., Strnad, M. et al. Resonance assignment and secondary structure of DbpA protein from the European species, Borrelia afzelii. Biomol NMR Assign 15, 415–420 (2021).
- Tilly K, Bestor A, Rosa PA. 2016. Functional Equivalence of OspA and OspB, but Not OspC, in Tick Colonization by Borrelia burgdorferi.
- Jernigan KK, Bordenstein SR. 2014. Ankyrin domains across the Tree of Life. PeerJ 2:e264
- Giuseppe Valerio De Gaetano,Germana Lentini,Francesco Coppolino,Agata Famà,Giampiero Pietrocola,Concetta Beninati. 2024. Engagement of α3β1 and α2β1 integrins by hypervirulent Streptococcus agalactiae in invasion of polarized enterocytes
- Pal, Utpal; Yang, Xiaofeng; Chen, Manchuan; Bockenstedt, Linda K.; Anderson, John F.; Flavell, Richard A.; Norgard, Michael V.; Fikrig, Erol (2004-01-15). "OspC facilitates Borrelia burgdorferi invasion of Ixodes scapularis salivary glands"
- Xu H, He M, He JJ, Yang XF. Role of the surface lipoprotein BBA07 in the enzootic cycle of Borrelia burgdorferi. Infection and Immunity.
- Akopjana, I.; Brangulis, K. Structural Analysis of the Outer Membrane Lipoprotein BBA14 (OrfD) and the Corresponding Paralogous Gene Family 143 (PFam143) from Borrelia burgdorferi.Pathogens 2022
- NCBI outer surface lipoprotein OspA [ Borreliella burgdorferi B31 ]
- NCBI Lp6.6 family lipoprotein
- Coleman AS, Yang X, Kumar M, Zhang X, Promnares K, et al. (2008) Borrelia burgdorferi Complement Regulator- Acquiring Surface Protein 2 Does Not Contribute to Complement Resistance or Host Infectivity
- NCBI porin Osm28 [ Borreliella burgdorferi B31 ]