Практикум 3
Описание рецепторов L-цистеина Neisseria gonorrhoeae (2YJP)
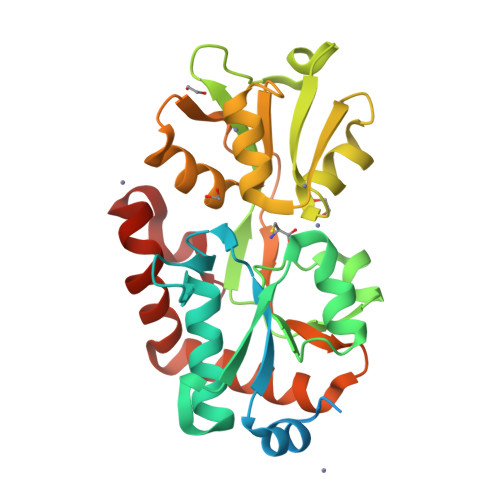
Количество полимерных цепей: 3 (A, B, C) Цепи A, B, C идентичны по последовательности

Для анализа идентичности последовательностей был написан скрипт Python и использовалась библиотека Biopython. Последовательности цепей были взяты из раздела SEQRES. Эта секция содержит последовательность аминокислот, использованную при кристаллизации белка. Однако, она может не совпадать с фактической последовательностью в кристалле, указанной в секции ATOM.
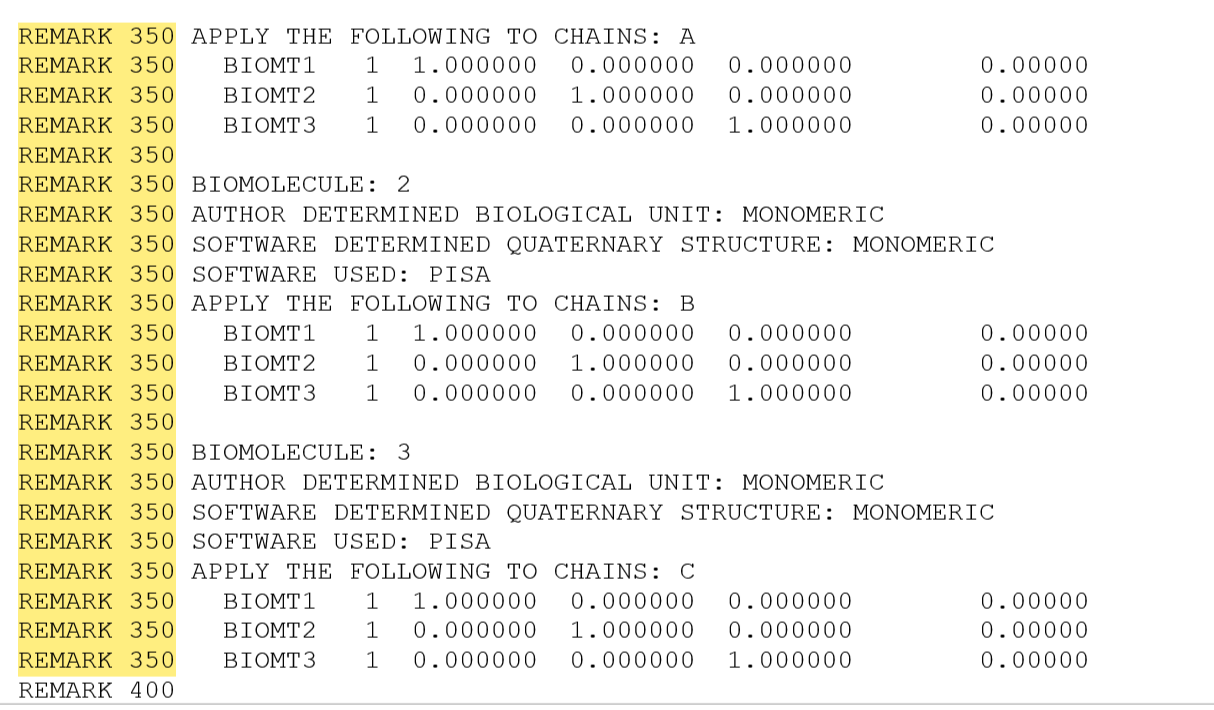
Чтобы определить, сколько цепей и каких входят в одну биологическую единицу необходимо проанализировать раздел REMARK 350, так как он содержит информацию о том, как формируется биологическая единица из асимметрической единицы кристалла.
REMARK 350 BIOMT1, BIOMT2, BIOMT3 определяют матрицы преобразования, которые необходимо применить к асимметрической единице для создания биологической единицы. REMARK 350 APPLY THE FOLLOWING TO CHAINS указывает, к каким цепям применять преобразования. COMPND 4 CHAIN: A, B, C указывает, что в асимметрической единице присутствуют цепи A, B и C. Для каждой из цепей матрицы преобразования единичные, следовательно, биологическая единица представлена мономером и состоит из одной копии каждой из цепей A, B и C.
Цепь А:
SOURCE 2 ORGANISM_SCIENTIFIC: NEISSERIA GONORRHOEAE
Для нахождения информации для данной цепи из базы Uniprot необходимо выполнить поиск последовательности с помощью BLAST. Сначала нужно переписать последовательность из раздела SEQRES в виде однобуквенного кода аминокислот (для этого был написан скрипт Python и использована библиотека Biopython).

Последовательность:
MGHHHHHHHHHHSSGHIDDDDKHMVGLTAAGGGSGDAQSSQSSGAATVAAIKEKGVIRIGVFGDKPPFGYVDANGKNQGFDVEIAKDLAKDLLGSPDKVEFVLTEAANRVEYVRSGKVDLILANFTQTPERAEAVDFADPYMKVALGVVSPKNKPITDMAQLKDQTLLVNKGTTADAFFTKSHPEVKLLKFDQNTETFDALKDGRGVALAHDNALLWAWAKENPNFEVAIGNLGPAEFIAPAVQKGNADLLNWVNGEIAAMKKDGRLKAAYEKTLLPVYGEKVKPEALLAE
Программа BLAST выдала следующие результаты:
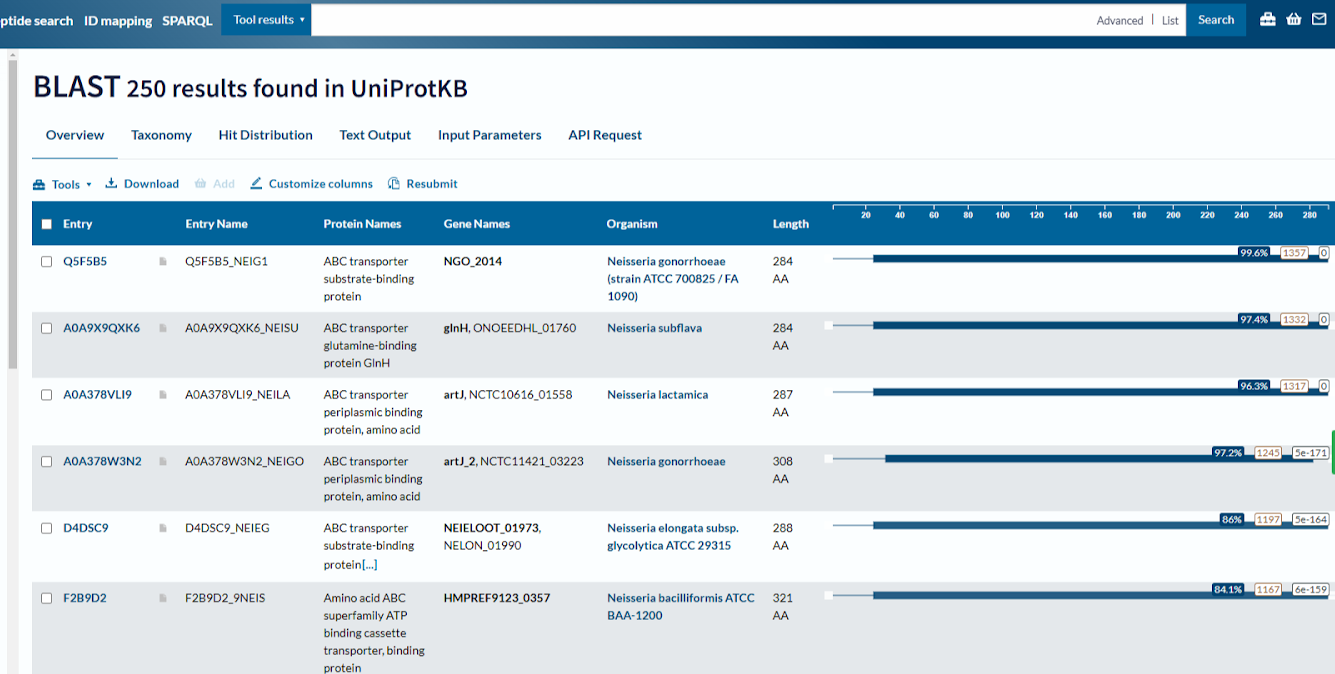
Выбрать нужно белок с максимальным процентом совпадения последовательностей. В первом случаем этот процент составляет 99.6%
Uniprot_id: Q5F5B5 (совпал с данными из pdb файла)
Название: ABC transporter substrate-binding protein
Функция: транспорт аминокислот (Направленное перемещение аминокислот, органических кислот, содержащих одну или несколько аминогрупп, в клетку, из клетки, внутри клетки или между клетками с помощью какого-либо агента, например переносчика или поры).
В последовательности цепи относительно референса из Uniprot произошла замена цистеина на аланин.
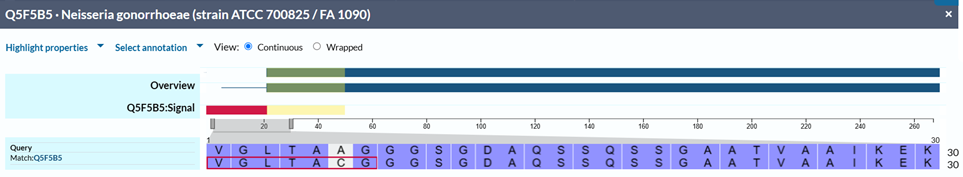
Для цепей B и C программа BLAST выдала аналогичные результаты, так как их последовательности совпадают с последовательностью цепи А.
Модифицированные аминокислотные остатки:
Разделы REMARK 465 и REMARK 600 часто используются для указания наличия модифицированных остатков. Также можно изучить раздел HETATM, в котором содержится информация о неатомные компонентах, таких как лиганды, растворители и модифицированные аминокислоты. В pdb файле для 2YJP в разделе REMARK 465 и HETATM не были указаны модифицированные аминокислотные остатки. Раздел REMARK 600 отсутствовал. Таким образом, в составе цепей нет модифицированных аминокислотных остатков.
Малые молекулы
Необходимо проанализировать записи HETNAM и HETATM, чтобы найти малые молекулы: CYSTEINE-CYS, ZINC ION-ZN, 1,2-ETHANEDIOL-EDO, WATER-HOH.
Ссылка на информацию о малых молекулах из pdb файла: Малые молекулы 2YJP
Согласно статье, описывающей структуру данного белка, к малым молекулам, отвечающим за функции белка, относятся: цистеин, молекулы воды, ионы Zn2+, этиленгликоль.
В комплексе Cys-CysRec/L-цистин пять прямых водородных связей соединяют большие и малые доли, и пять из этих связей группируются вблизи выхода из связывающего кармана и могут способствовать “фиксации” складки в закрытой конформации. В той же области дополнительный набор водородных связей связывает две доли и включает в себя две молекулы воды, которые соединяют боковую цепь Arg123 с основной цепью и атомами боковых цепей Thr164 и Glu169. Наложение обоих цистеинсвязывающих карманов показывает идеальное соответствие аминокислотной последовательности и конформации, а также сохранение положения молекулы воды в обеих структурах. Аналогичный анализ интерфейса между долями CysRec показывает, что в этом белке два домена соединены 11 прямыми водородными связями и 5 участками, опосредованными молекулами воды. Также важно отметить, что в случае комплекса L-cysteine боковая цепь тиола также вносит свой вклад в формирование сети H-связей. Анализы связывания показали, что эти взаимодействия играют решающую роль в связывании лиганда.
Поскольку как Cys-CysRec, так и CysRec-рецепторы участвуют в распознавании и транспортировке аминокислот, в их связывающих структурах наблюдаются некоторые общие черты, отражающие почти идентичное, очень высокое сродство к их природным лигандам. Одной из наиболее очевидных особенностей является распознавание функций амино- и карбоновых кислот, которые являются общими для L-цистина и L-цистеина.
Молекулы этиленгликоля и ионы Zn2+ взаимодействуют с сайтами связывания белка. Дальнейший анализ структуры CysRec/L-цистеина показал существенную роль катионов Zn2+ в обеспечении кристаллографических контактов между Asp, Glu и боковыми цепями His различных мономеров, составляющих кристаллическую асимметричную единицу.