Атлас контактов
Введение, или Как выглядят прионы
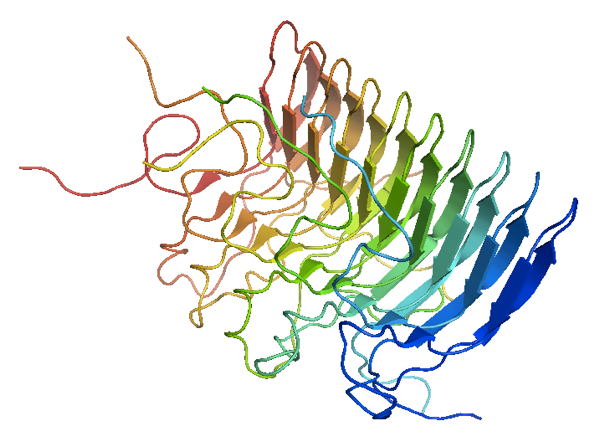
Общая информация
Белок 2MUS является прионом. Прионы представляют особый класс инфекционных агентов, имеющих аномальную третичную структуру и не содержащих нуклеиновых кислот. Прионный белок есть в организме здоровых людей и животных. Это нормальный мембранный белок - PrP C . Инфекционная форма Prp Sc , попадая в организм, способна превращать нормальную форму в аномальную. В аномальной форме бета-тяжи преобладают над альфа-спиралями. Так, 2MUS содержит 24 бета-тяжа и всего 2 альфа-спирали. Среди различных клеточных контактов вызывает интерес большое количество солевых мостиков. Возможно, они необходимы для придания структуре белка дополнительной прочности, ведь, как известно, прионы очень устойчивы к денатурации под воздействием химических и физических факторов. Из-за этого вызываемые ими заболевания, например, трансмиссивные губчатые энцефалопатии (ТГЭ), не поддаются лечению и, как правило, приводят к летальному исходу.[1][2]
| Имя | Прион |
| PDB ID | 2MUS |
| Uniprot ID | Q03689 |
| Молярная масса г/моль | 43955.70 |
Описание связей в составе комплекса
Ссылка на скрипт
Гидрофобные взаимодействия
Гидрофобное ядро формируется в результате сосредоточения гидрофобных радикалов аминокислот в центре белковой глобулы, что позволяет принять наиболее выгодное энергетическое положение с минимальной энергией. У данного белкового комплекса 26 гидрофобных ядер, из них 3 относительно крупных (от 171 до 71 атома), остальные более мелкие (от 45 до 3 атомов). Самое крупное ядро (core7, 171 атом) составляет 0,78% от общего числа атомов. Для сравнения самые маленькие ядра (3 атома) составляют всего 0,014%. Для поиска ядер использовался сервис CluD, с которого был скачан скрипт с ядром и получена информация о ядрах и количестве атомов в них.
Водородные связи
Водородные связи образуются между водородом и атомом сильно электроотрицательного элемента (азота, кислорода, фтора). В данном случае мы наблюдаем водородную связь между водородом ([GLY]269:E) и кислородом ([ARG]232:E), длина которой составляет 1.832 А, а угол N-O-C равен 158.38. Для нахождения водородных связей были выделены все бета-тяжи, из них выбраны два и найдены водородные связи между ними. Затем была выбрана конкретная водородная связь и измерены ее геометрические параметры, приведенные выше.
Солевые мостики
Солевые мостики или электростатические взаимодействия образуются между заряженными аминокислотами, такими как аспаргиновая и глутаминовая кислота и лизин и аргинин. Прионы характеризуются большим количеством солевых мостиков, один из них продемонстрирован на примере глутаминовой кислоты и лизина.[4]
Ковалентные связи
Ковалентная связь (от лат. co — «совместно» и vales — «имеющий силу») — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Пептидные связи образуются при взаимодействии a -аминогруппы одной аминокислоты с a -карбоксильной группой другой аминокислоты: Пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку. Она продемонстрирована на примере связи между серином и аргинином.
Описание лиганда - 3LS
| Имя | 3LS |
| Формула | C26 H16 O8 S5 |
| Номенклатура по ИЮПАК | 5-[4-(carboxymethyl)-5-[5-[3-(carboxymethyl)-5-(5-carboxythiophen-2-yl)thiophen-2-yl]thiophen-2-yl]thiophen-2-yl]thiophene-2-carboxylic acid |
| Брутто-формула | 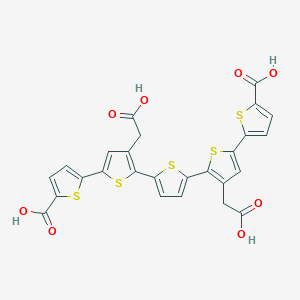 |
| Молярная масса г/моль | 616.706 |
| Cсылка на PubChem | Ссылка |
Рис.1. Лиганд

Лиганд имеет 4 карбоксильных группы, поэтому предположительно молекула обладает сильными кислотными свойствами. Молекула обладает почти идеальной симметрией и почти целиком лежит в одной плоскости, что является довольно редким и удивительным явлением. Следовательно, можно предположить, что она выполняет особые функции при взаимодействии с белком, предположительно связующую и стабилизирующую функции.[3]
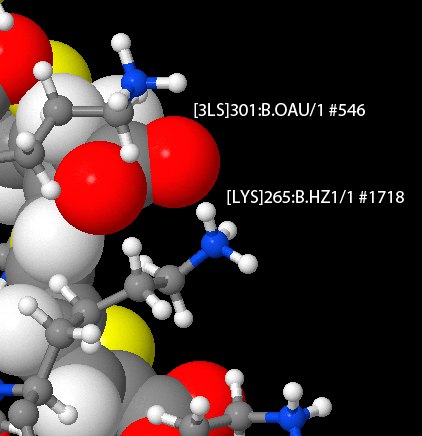
На рис.2 приведен пример ионной связи между лигандом и аминокислотой белка. Связь возникла между отрицательно заряженным атомом кислорода лиганда ([3LS]301:B.OAU/1 #5461) и положительно заряженной аминокислотой лизином ([LYS]265:B.HZ1/1 #1718).
Рис.2. Связь с лигандом
Личный вклад
Общая информация о белке, водородных связях, гидрофобных взаимодействиях и соответстующие скрипты выполнила Никишова Анастасия.
Дополнение к общей информации о белке, информация о лиганде, ковалентных связях, солевых мостиках и соответствующие скрипты, а также верстка - Черкашина АнастасияСсылки на источники
[1] https://ru.wikipedia.org/wiki/Прионы[2] http://www.rcsb.org/pdb/explore/viewerLaunch.do?viewerType=LX&structureId=2MUS&hetId=3LS
[3]https://ru.wikipedia.org/wiki/Ковалентная_связь
[4] http://hpc.mipt.ru/wp-content/uploads/2012/05/Lecture04.pdf
© Cherkashina Anastasia 2017