Лиганды

MAN
ALPHA-D-MANNOSE
Название по IUPAC: (2S,3S,4S,5S,6R)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol
Брутто-формула: C6 H12 O6
Молярная масса: 180.16
PubChem ID: 185698

BMA
BETA-D-MANNOSE
Название по IUPAC: (2R,3S,4S,5S,6R)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol
Брутто-формула: C6 H12 O6
Молярная масса: 180.16
PubChem ID: 439680
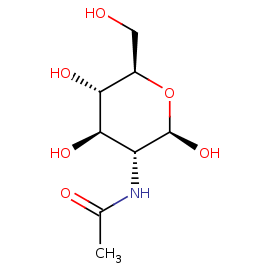
NAG
N-ACETYL-D-GLUCOSAMINE
Название по IUPAC: N-[(2R,3R,4R,5S,6R)-6-(hydroxymethyl)-2,4,5-tris(oxidanyl)oxan-3-yl]ethanamide
Брутто-формула: C8 H15 N O6
Молярная масса: 221.21
PubChem ID: 439174
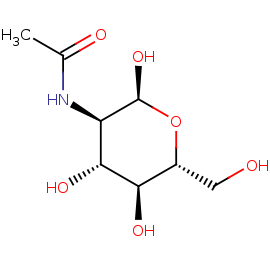
NDG
2-(ACETYLAMINO)-2-DEOXY-A-D-GLUCOPYRANOSE
Название по IUPAC: N-[(2S,3R,4R,5S,6R)-2,4,5-trihydroxy-6-(hydroxymethyl)oxan-3-yl]ethanamide
Брутто-формула: C8 H15 N O6
Молярная масса: 221.21
PubChem ID: 439174
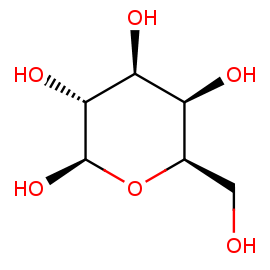
GAL
BETA-D-GALACTOSE
Название по IUPAC: (2R,3R,4S,5R,6R)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol
Брутто-формула: C6 H12 O6
Молярная масса: 180.16
PubChem ID: 439353

BGC
BETA-D-GLUCOSE
Название по IUPAC: (2R,3R,4S,5S,6R)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol
Брутто-формула: C6 H12 O6
Молярная масса: 180.16
PubChem ID: 64689