В данном задании требовалось рассмотреть альтернативные положения двух аминокислот в белке, стабилизирующие их взаимодействия и наиболее вероятные сочетания альтернативных положений (альт-локов) данных аминокислот.Для выполнения задания была использовала структура белка с PDB ID 6B0D.
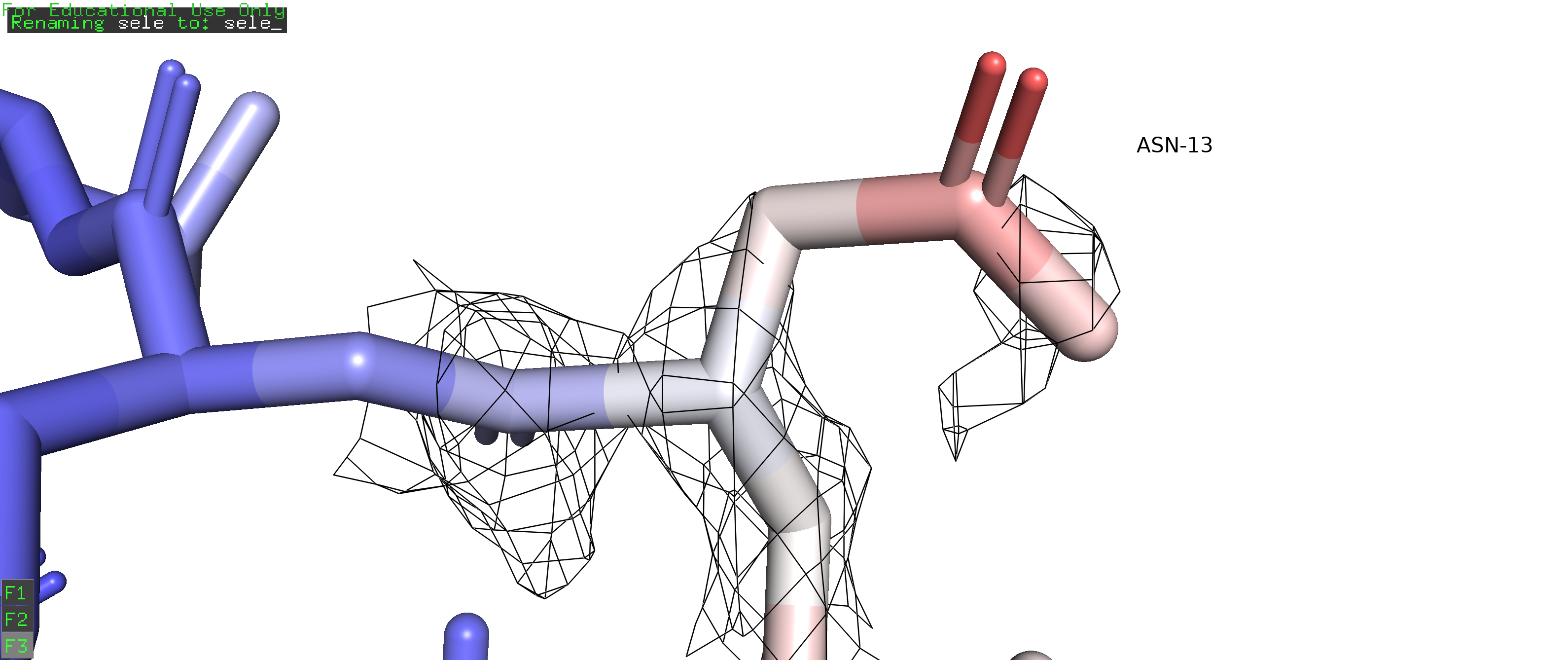
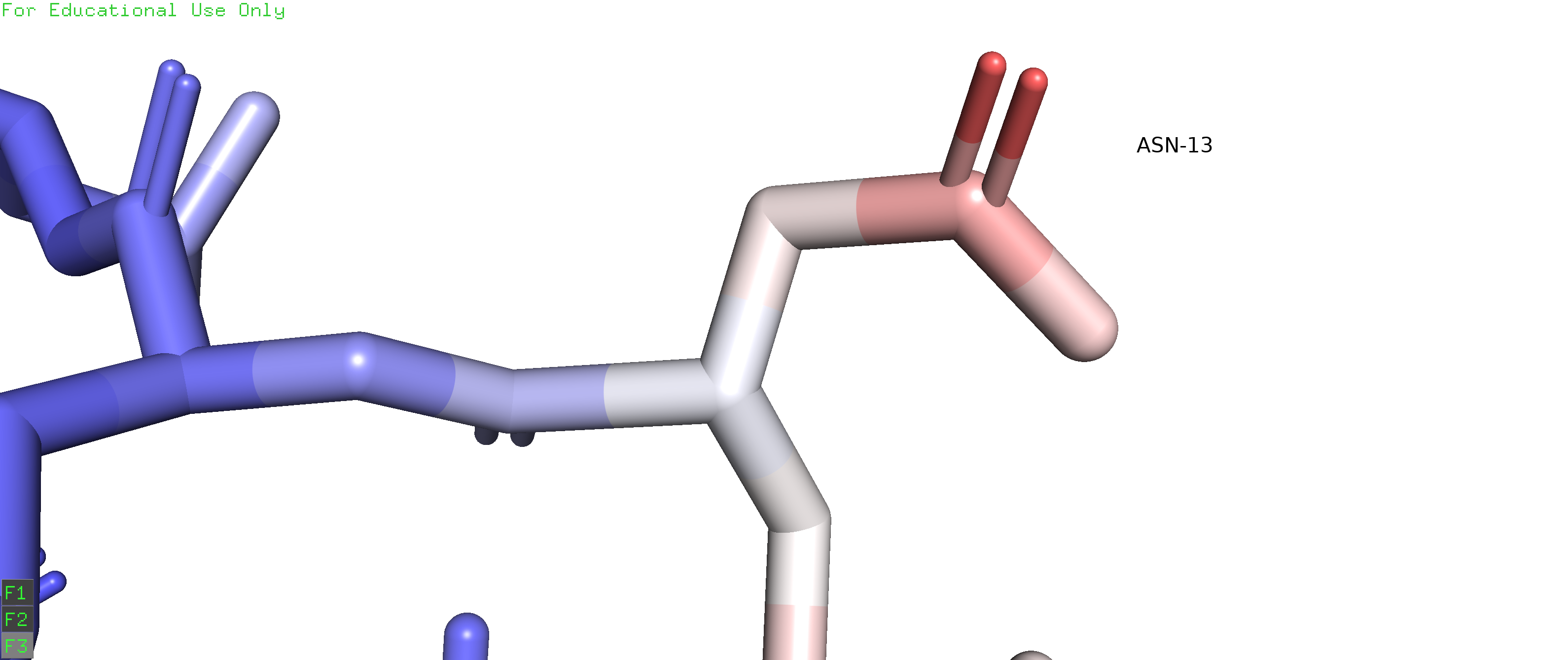
На рисунке 1 изображен остаток ARG35. Альтернативное положение А отмечено оранжевым, альтернативное положение В - синим.
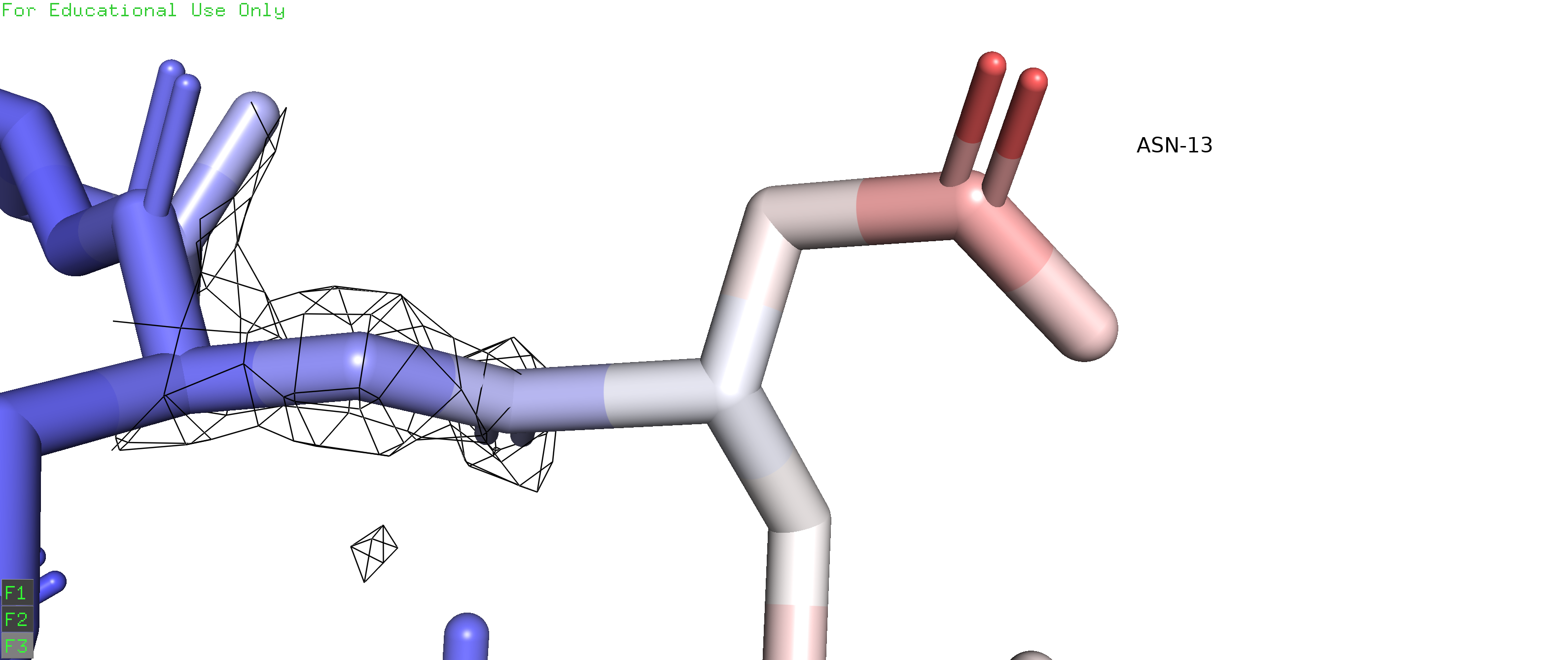
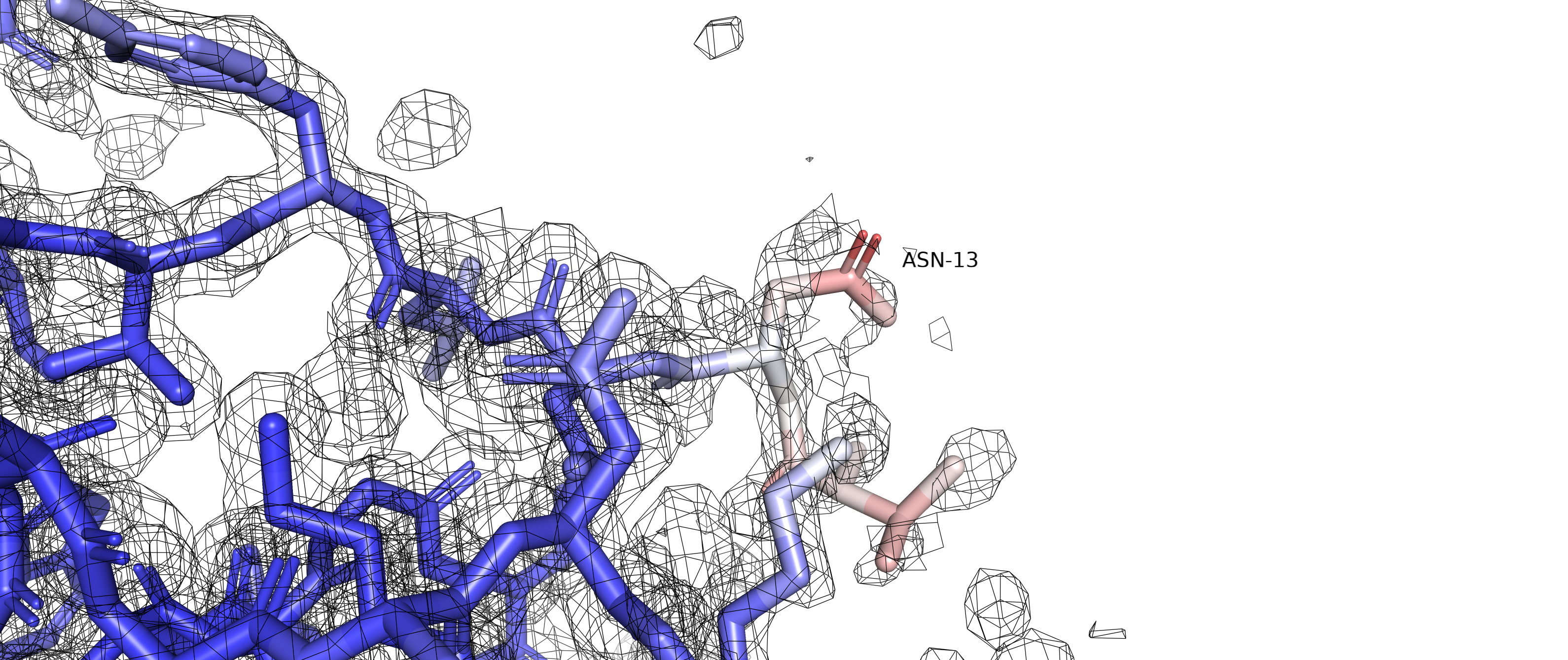
Рисунок 2 позволяет высказать предположение, что альтернативное положение А остатка ARG35 (цепь D) с положительно заряженным радикалом может образовывать соляной мостик с отрицательно заряженным радикалом ASP131 (цепь D), а альтернативное положение В может образовывать соляной мостик с отрицательно заряженным радикалом GLU31 (с его альтернативным положением C). Полярное взаимодействие с остатком GLU31, находящимся на соседнем ветке альфа-спирали, скорее всего, несет совсем небольшую структурную функцию, в то время как взаимодействие с ASP131, находящимся на соседней альфа-спирали, может с большей вероятностью выполнять структурную функцию. Можем предположить, что населенность альтенативного положения А будет больше, чем населенность альтернативного положения В. Однако данные из PDB файла подтверждают говорят, что населенность альтернативных положений А и В составляют 0.5). Это может означать, что рассмотренные нами взаимодействия на самом деле почти не несут стабилизирующей функции, или же, наоборот, вклады обоих взаимодействий равны между собой.
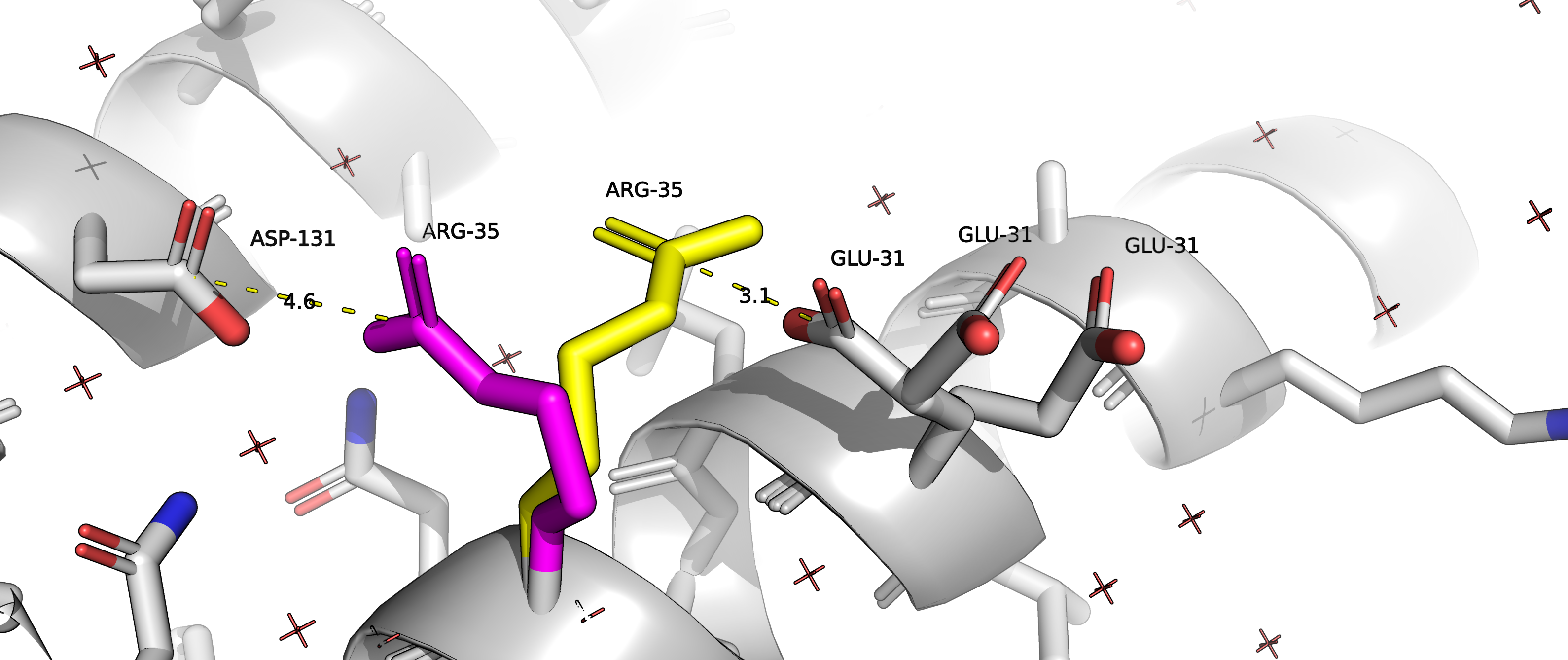 Рисунок 1. Альтернативные положения А и В остатка ARG35 в цепи D белка с PDB ID 6B0D. Альтернативное положение A покрашено фиолетовым, В - желтым. |
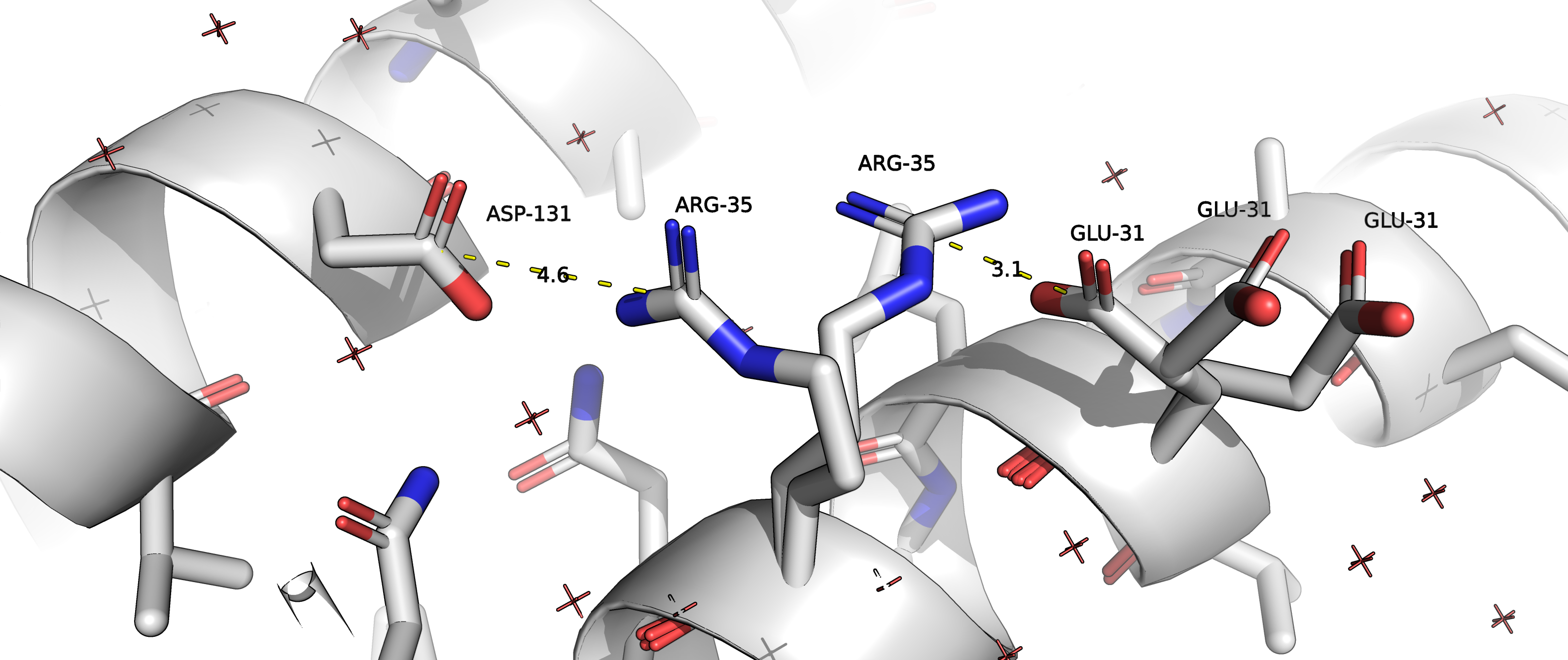 Рисунок 2.Желтым пунктиром отмечены возможные солевые мостики, которые могут стабилизировать различные альтернативные положение остатка ARG35. В случае альтернативного положения A - это соляной мостик с остатком ASP131 цепи D, в случае альтернативного положения B - это соляной мостик с GLU31 цепи D. |
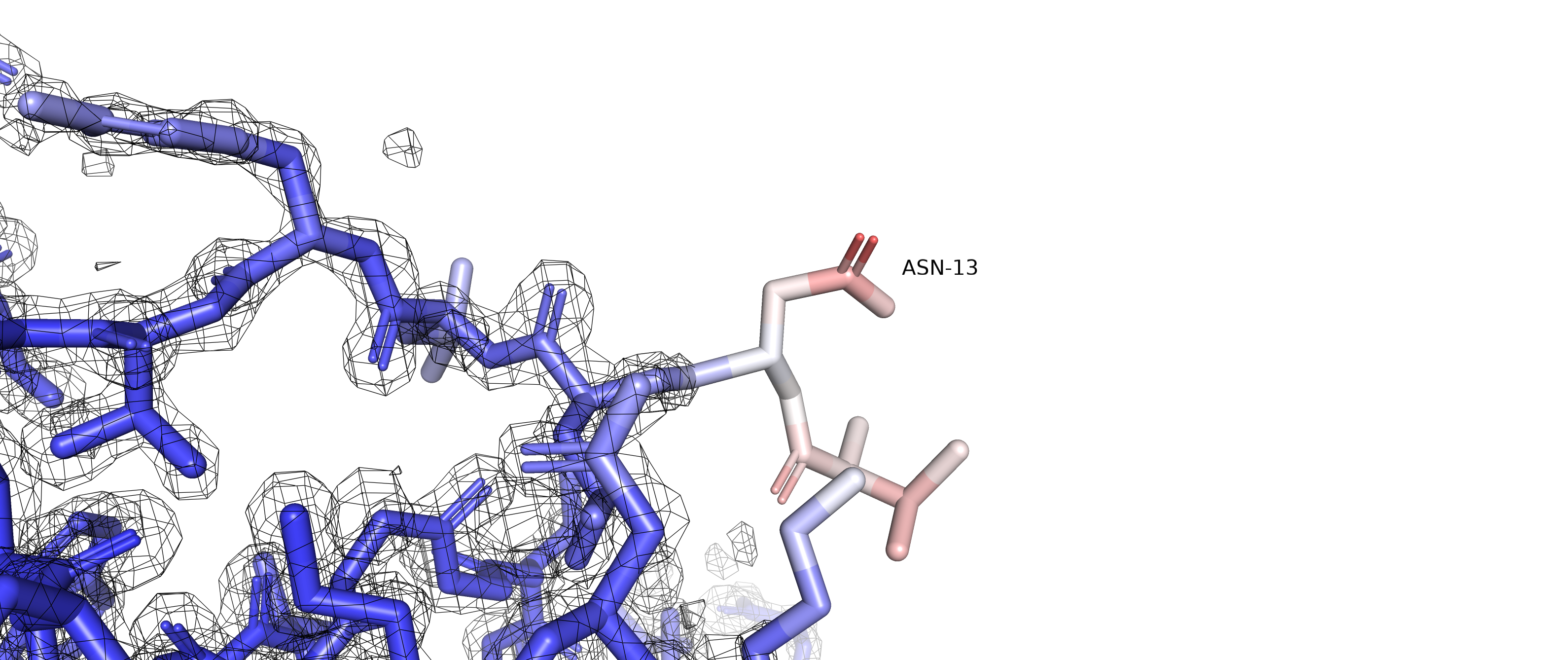
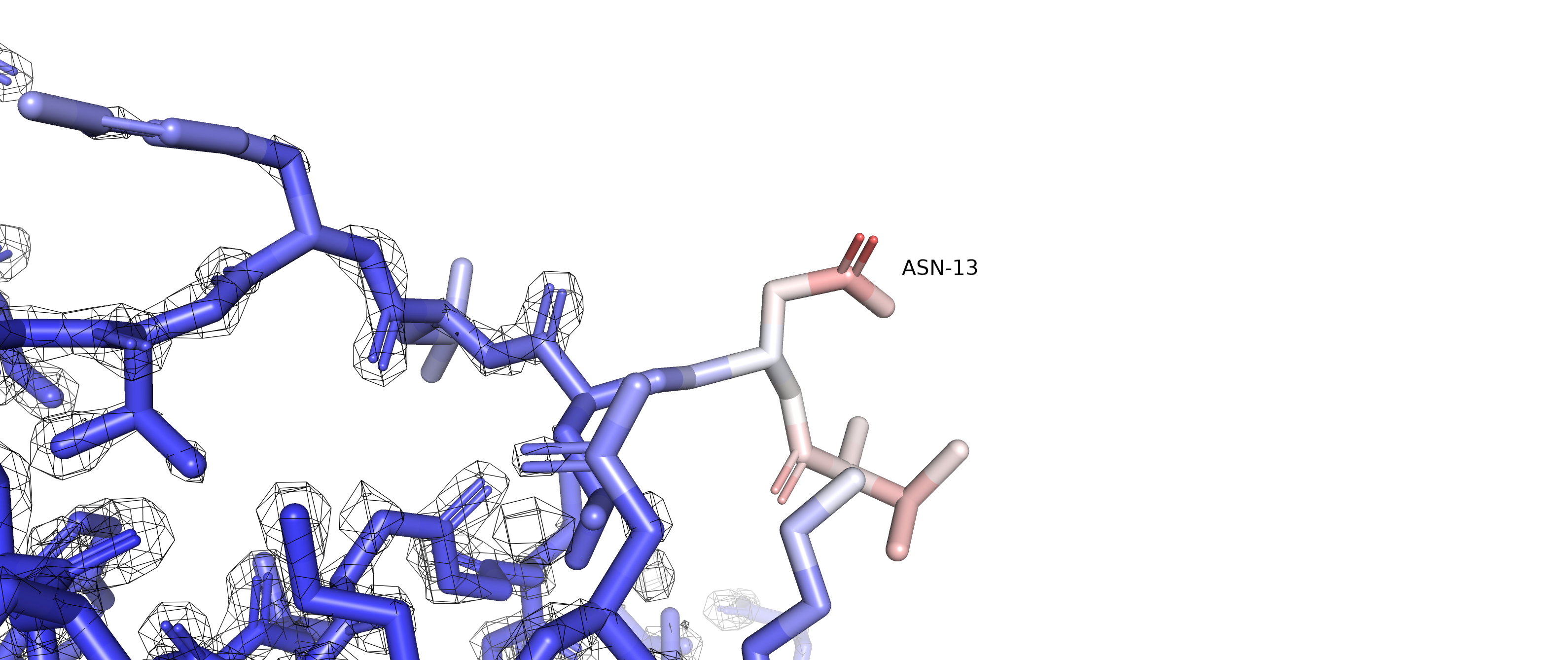
На рисунке 3 изображены три альтернативных положения остатка GLU31.
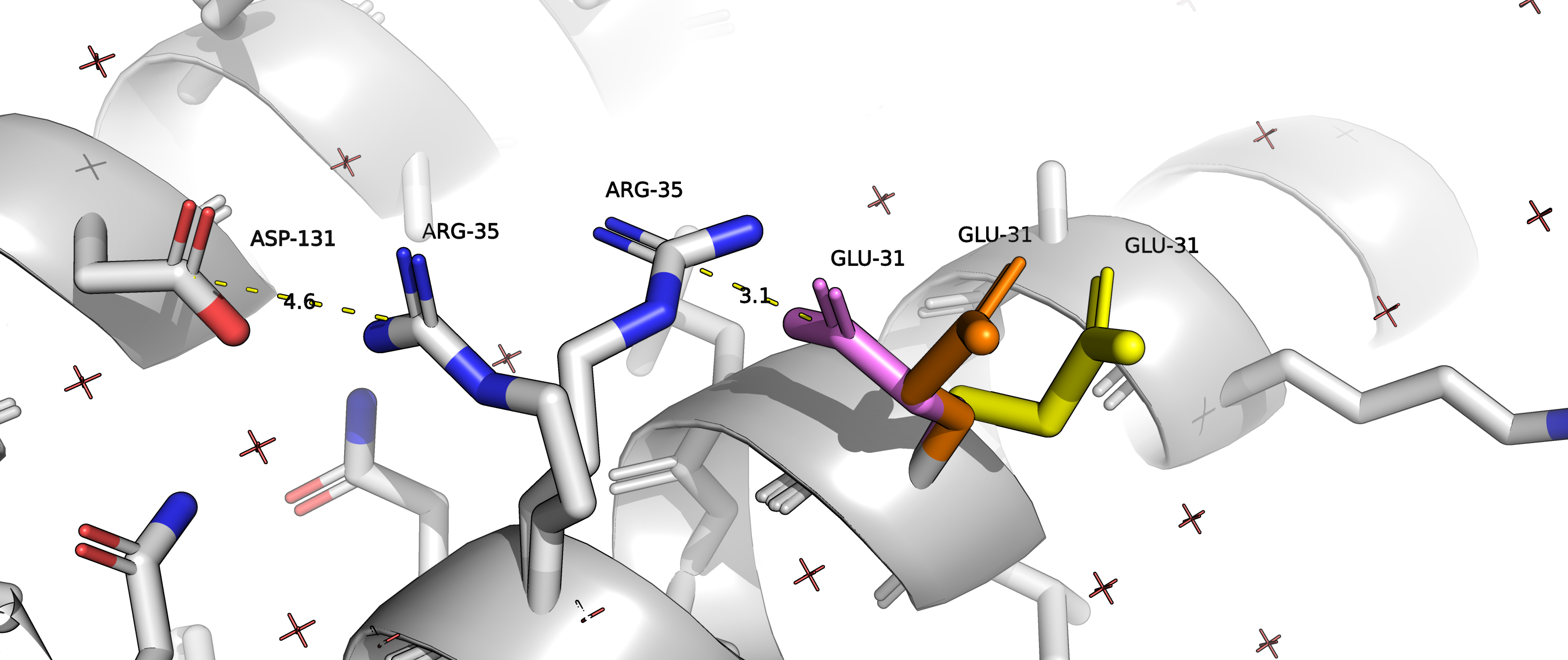
Рисунок 3. Альтернативное положение А покрашено оранжевым , В - желтым, С - фиолетовым.
Альтернативное положение С стабилизировано соляным мостиком с ARG35, о котором уже было упомянуто выше. Альтернативные положения А и В, по-видимому, не вступают в какие-либо взаимодействия.
Можно предположить, что альтернативное положение В остатка ARG35 скорее будет существовать в комплекте с альтернативным положением С остатка GLU31, чтобы имел место обнаруженный нами соляной мостик. Но, как уже было упомянуто, это взаимодействие вряд ли несет структурную функцию. Так как альт-локи А и В остатка GLU31 не вступают ни в какие взаимодействия, а соляной мостик альт-лока С с аргинином ARG35 не играет существенной роли, то, кажется, вероятность каждого из альтернативных положений остатка GLU31 должна быть одинакова и составлять 0.33. Данные PDB-файла говорят нам, что альт-лок A имеет населенность 0.4, альт-локи B и C имеют населенность 0.3 - то есть, наше предположение не полностью совпало с данными по населенности (скорее всего, альтернативное положение А имеет наибольшую населенность по сравнению с двумя другими альтернативными положениями именно потому, что располагается в центре).
Кажется, что каждое из сочетаний альтернативных положений данных аминокислот возможно.