Задание 1.
В данном задании требовалось для структуры главной протеазы вируса SASR-CoV2 с лигандом (PDB ID: 5RHB) сгенерировать 2D-диаграмму взаимодействий
с помощью Poseview и сравнить ее с остатками, который были в практикуме 1 отмечены как потенциально интересные для взаимодействия.
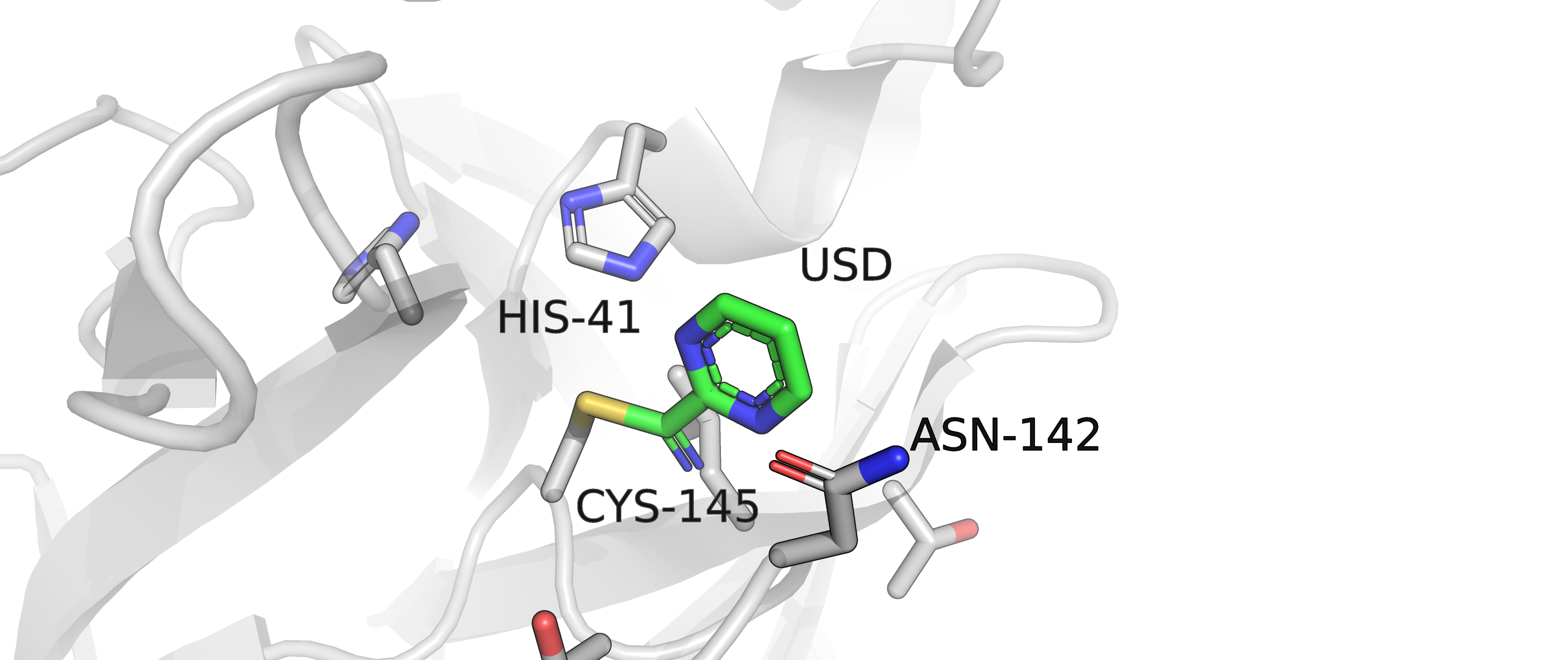
Рисунок 1. Структура главной протеазы вируса SARS-CoV2 с лигандом в окружении остатков, потенциально взаимодействующих с ним
(практикум 1) |
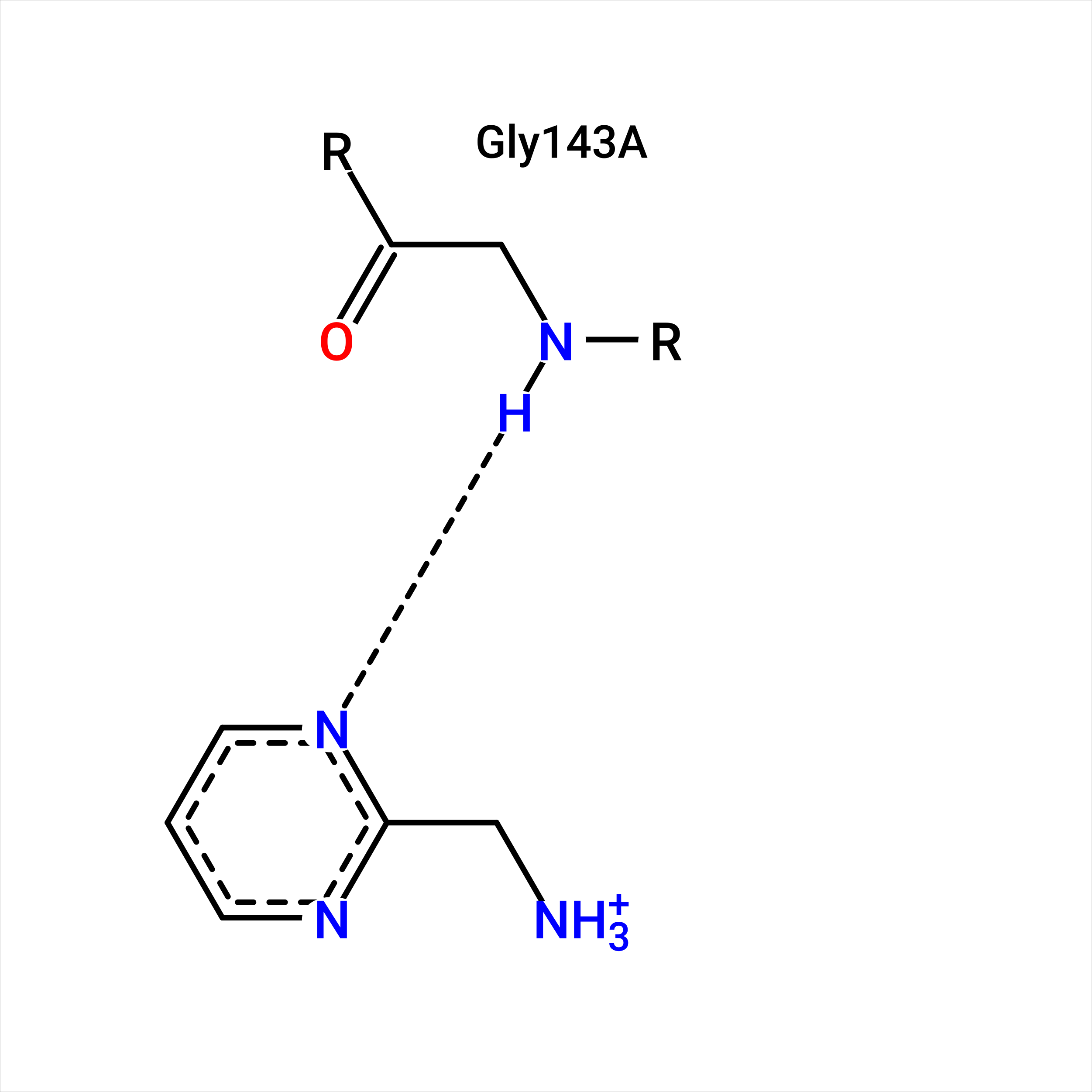
Рисунок 2. 2D-диаграмма взаимодействия лиганда USD с главной протеазой вируса SARS-CoV2. |
Диаграмма показала, что лиганд USD образует водородную связь с остатком GLY143.
Из аминокислотных остатков, отмеченных в практикуме 1, как потенциально интересные, ни один не совпал с тем, который программа
вывела на диаграмме.
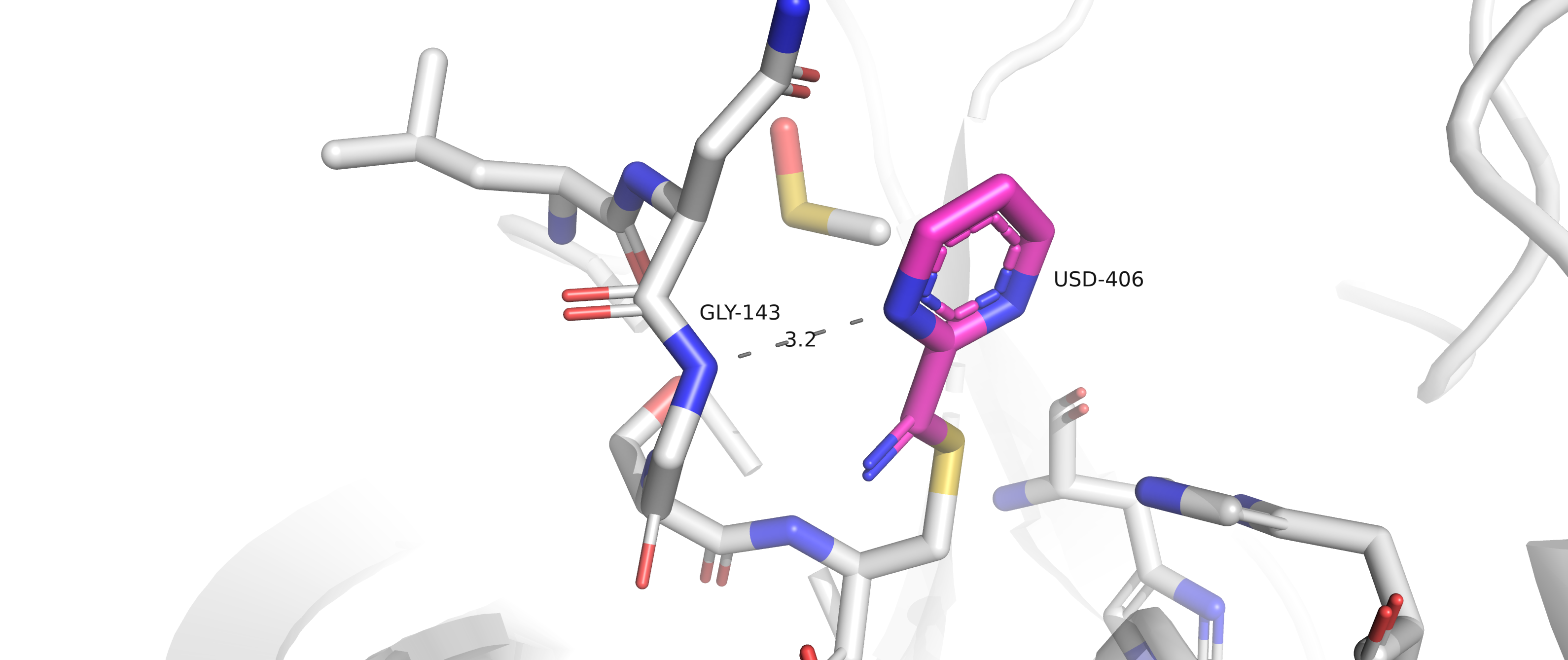 Рисунок 3.1. Взаимодействие лиганда USD с аминокислотой GLY143.
Рисунок 3.1. Взаимодействие лиганда USD с аминокислотой GLY143.
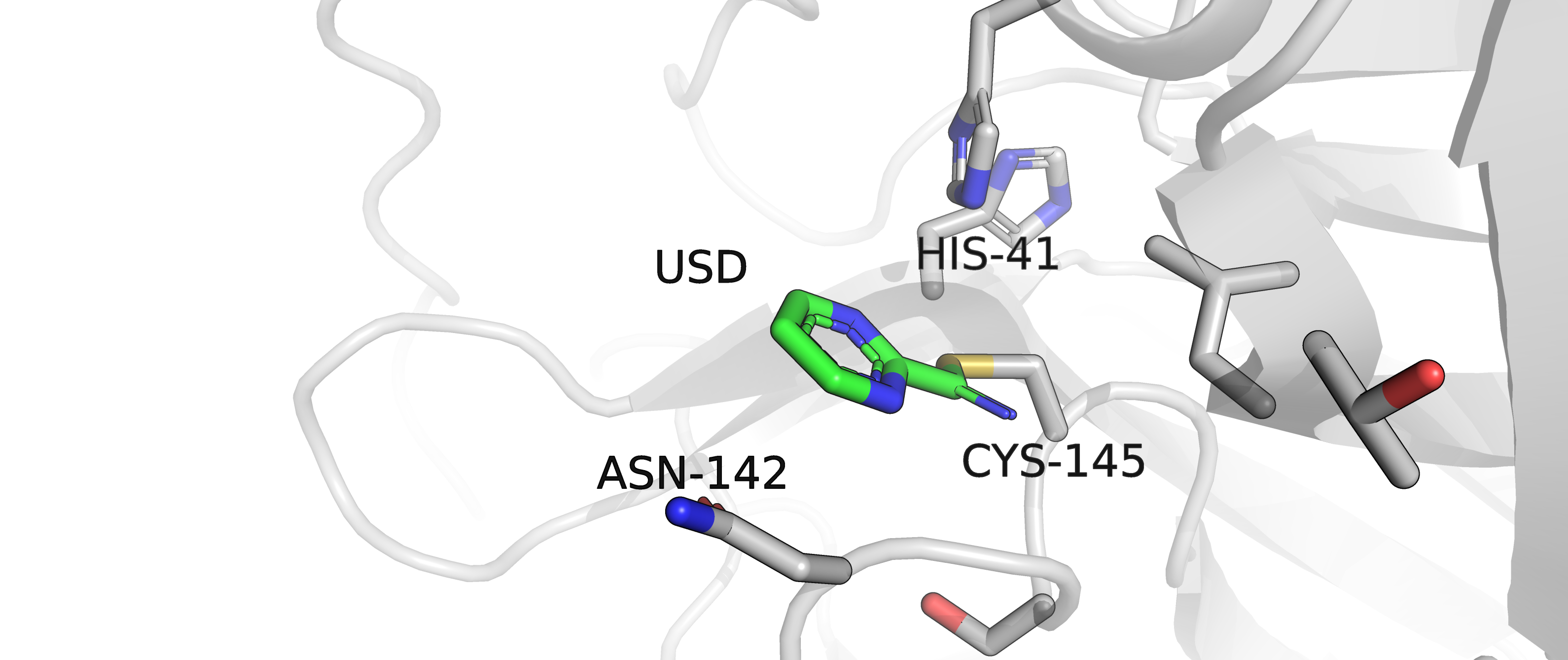 Рисунок 3.2. Расположение лиганда USD относительно окружающих его аминокислот.
Рисунок 3.2. Расположение лиганда USD относительно окружающих его аминокислот.
Кажется, что выдача программы права, потому что водородная связь USD-GLY143 имеет хорошую геометрию, а остатки, с которыми
предполагалась связь в практикуме 1 (в частности, ASN142, который на рисунке 3.1. неудачно отображен относительно лиганда USD),
наоборот, имеют неблагоприятную геометрию для образования связи.
Ошибка при выполнении практикума 1 была допущена в том, что не были учтен остаток GLY143, так как его радикал не выдаётся наружу
и становится "невидим" для side_chain_helper.
Задание 2.
В данном задании нам было дано две структуры, в определенных местах которых была внесена замена нативной аминокислоты на глицин.
С помощью инструмента mutagenesis в PyMol'е требовалось сделать предположение о том, какая аминокислота была
вместо глицина изначально.
Структура 1.
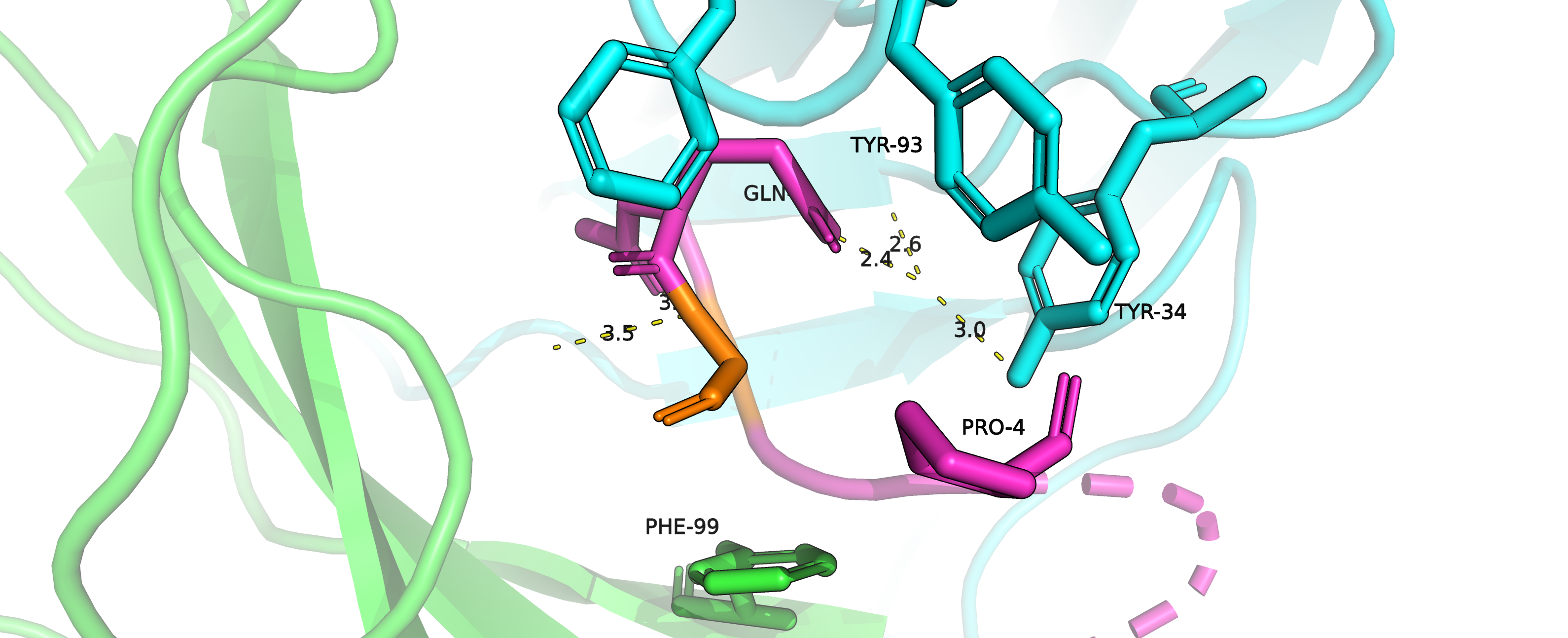
Рисунок 4.1. Остаток GLY2 (оранжевый) в своём окружении (атомы покрашены по цепям).
|
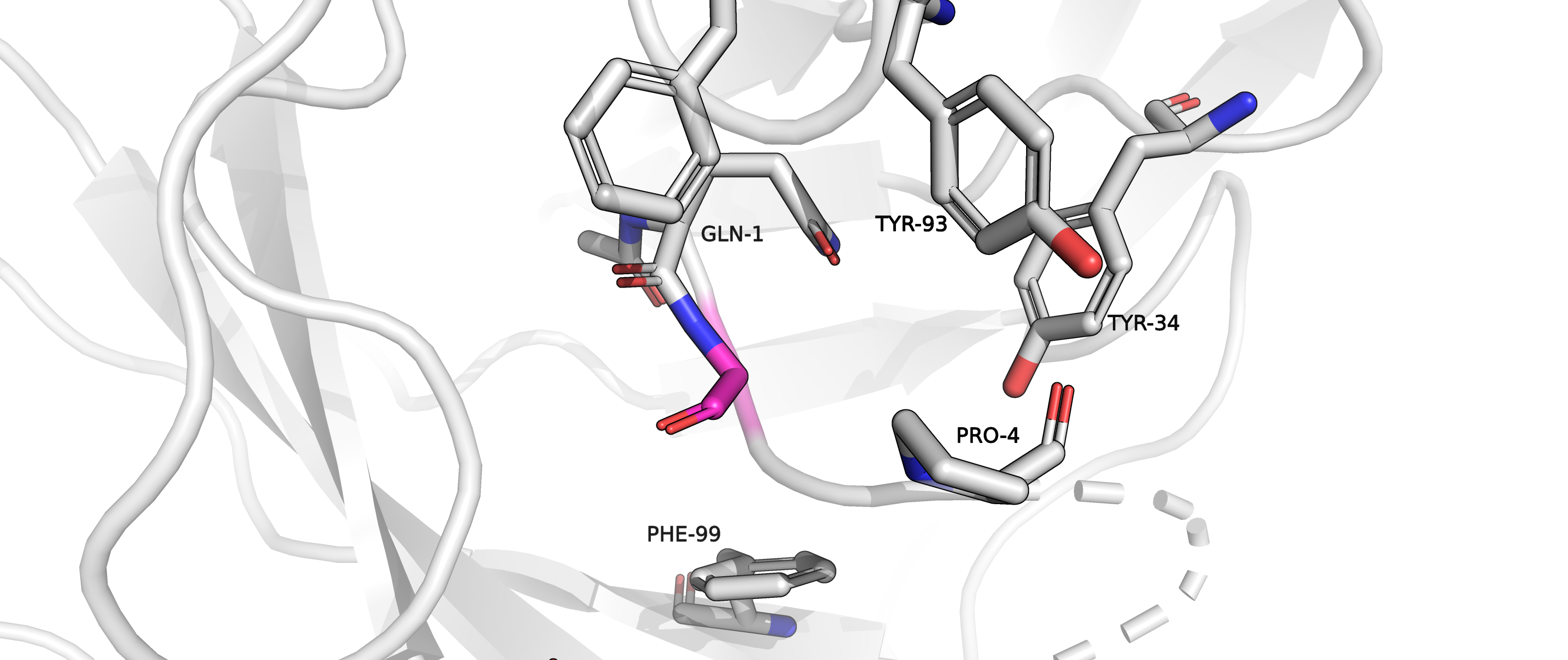
Рисунок 4.2. Остаток GLY2 (розовый) в своём окружении.
|
Так как у нас взаимодействие антиген-антитело, нас в первую очередь интересуют взаимодействия потенциального остатка
с остатками других цепей с минимальным при этом перекрыванием Ван-дер-Ваальсовых радиусов.
Среди аминокислот окружение нашего остатка надо отметить 2 тирозина (TYR93 и TYR34), фенилаланин (PHE99) и находящиеся на
той же
цепи остатки GLN1 и PRO4 (радикал глутамина позволяет предположить на месте изначальной аминокислоты что-то полярное, кислород карбонильной
группы пролина, смотрящий в сторону потенциального радикала, намекает на то же).
В пространстве, где должен располагаться радикал изначального аминокислотного остатка, не очень много места, поэтому наличие
там радикалов ароматических аминокислот или гистидина будет неблагоприятно с точки зрения перекрывания Ван-дер-Ваальсовых радиусов
(значения strain получаются минимум 36.5, что не очень нас устраивает).
Значит,ароматика - не наш вариант в данном случае.
Попробуем предположить, что исходная аминокислота может являться донором протона для пи-водородной связи с одним из
тирозинов или
фенилаланином.
Среди кандидатов в исходные аминокислоты можем представить лизин (ротамер 5/13, представленность 5.6 %, strain = 48.33). Да,
здесь не самая
удачная геометрия для пи-водородной связи и большое перекрывание Ван-дер-Ваальсовых радиусов, но это может объясняться
ограниченностью набора ротамеров в PyMol, так что будем считать, что такое взаимодействие потенциально возможно.
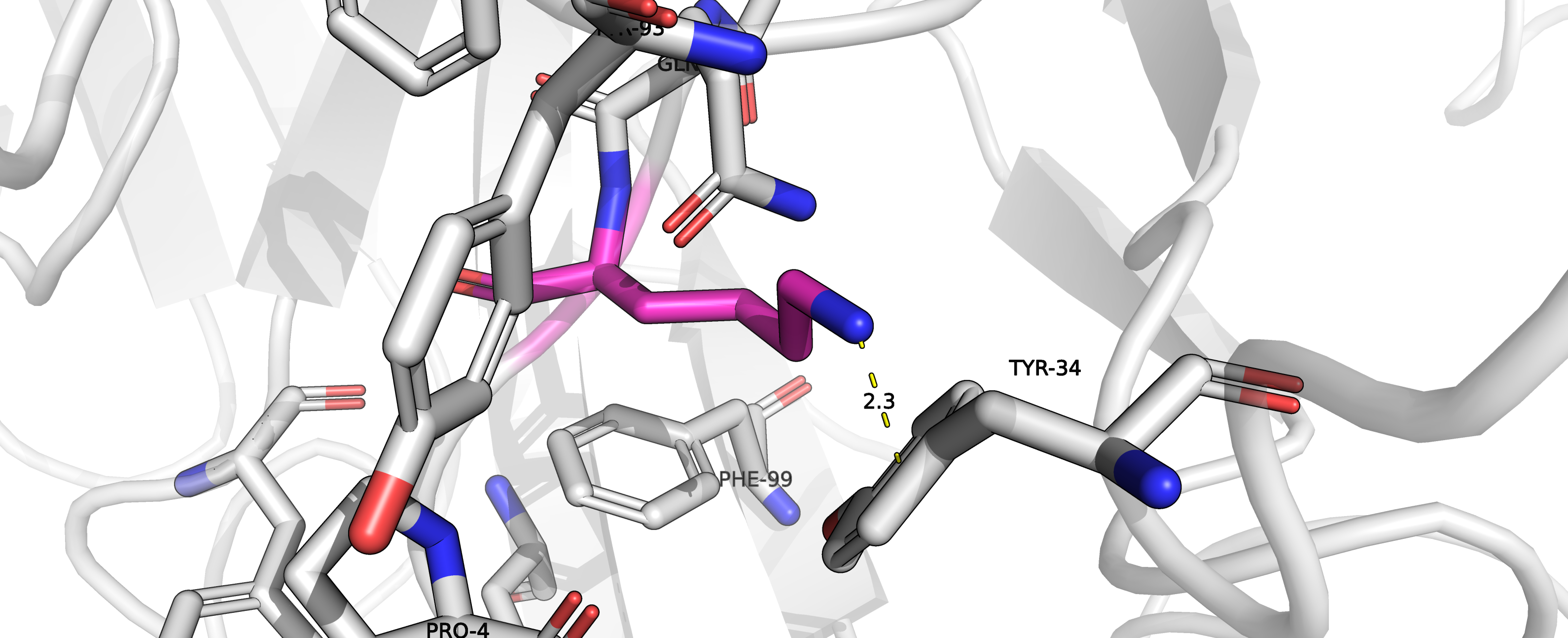 Рисунок 5. Потенциальная пи-водородная связь лизина (который предположительно мог находится на месте остатка GLY2)
с тирозином.
Рисунок 5. Потенциальная пи-водородная связь лизина (который предположительно мог находится на месте остатка GLY2)
с тирозином.
Так как с аргинином у нас ничего удачного не вышло (ротамер с небольшим значением strain не образует никаких взаимодействий),
попробуем рассмотреть другие полярные аминокислоты. Среди наших кандидатов: отрицательно заряженные аспартат и глутамат
и незаряженные серин, треонин,
цистеин, аспарагин и глутамин.
Порассуждаем логически: остаток, который потенциально может вступать в водородные связи в качестве донора водорода -
это TYR34.
Серин и треонин слишком маленькие и "не достают" до тирозина.
В библиотеке ротамеров не нашлось ротамера аспарагина или глутамина с правильной геометрией водородных связей (так, чтобы они
располагались в одной плоскости). Удачного аспартата, как и цистеина, тоже не нашлось.
Зато нашелся приличный ротамер для глутамата (ротамер 4/14, представленность 9.8 %, strain= 27.79)! Однако в данной ситуации
стоит сказать о конфликте гидрофильность-гидрофобность: кислород радикала глутамина располагается близко к -(CH2)- группе
нашего глутамата.
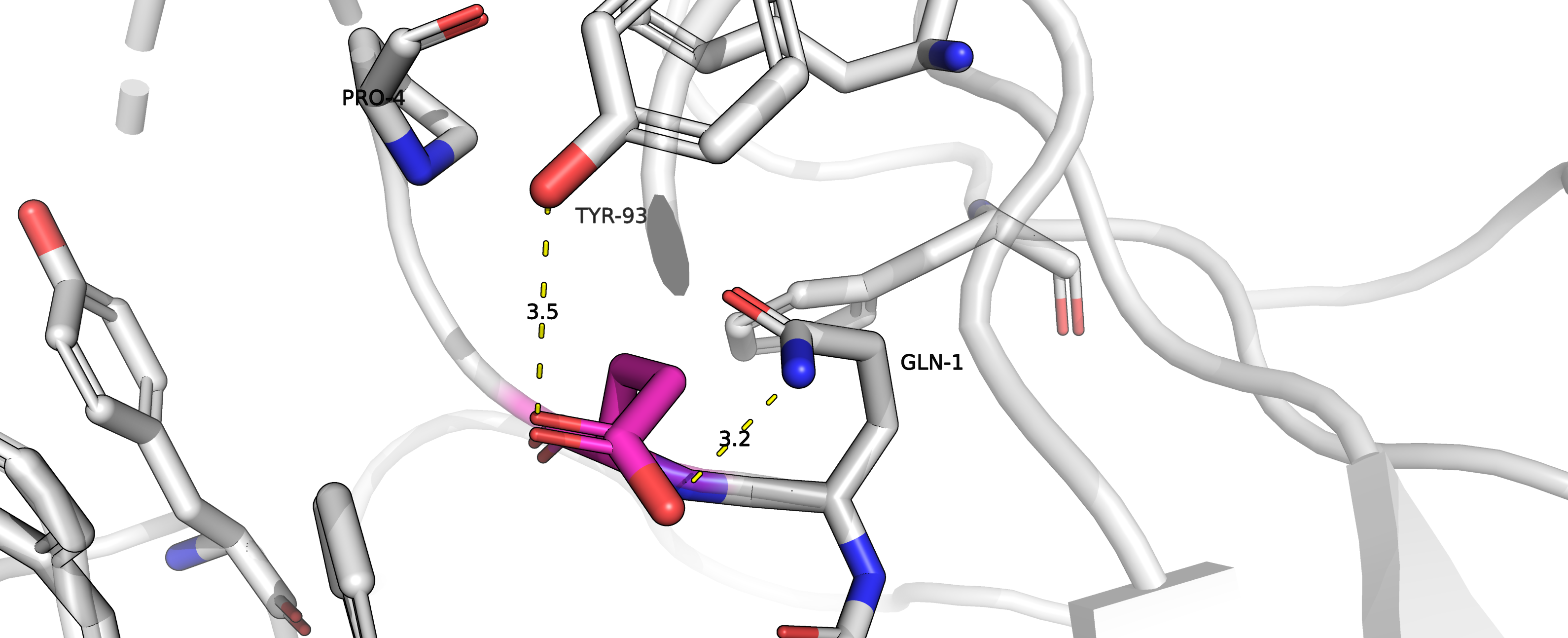 Рисунок 6. Потенциальный водородные связи глутамата с остатками TYR93 и GLN1.
Структура 2.
Рисунок 6. Потенциальный водородные связи глутамата с остатками TYR93 и GLN1.
Структура 2.
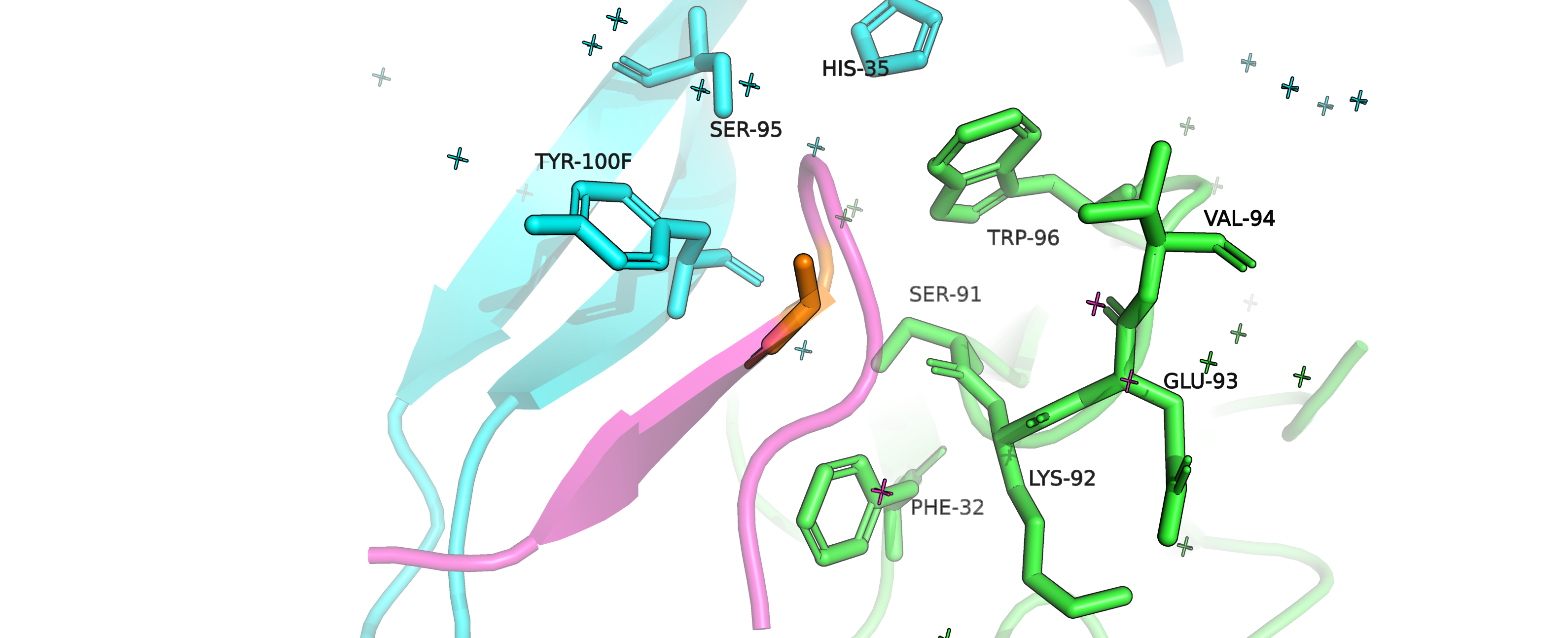 Рисунок 7. Остаток GLY41 (оранжевый) в своём окружении (атомы покрашены по цепям).
Рисунок 7. Остаток GLY41 (оранжевый) в своём окружении (атомы покрашены по цепям).
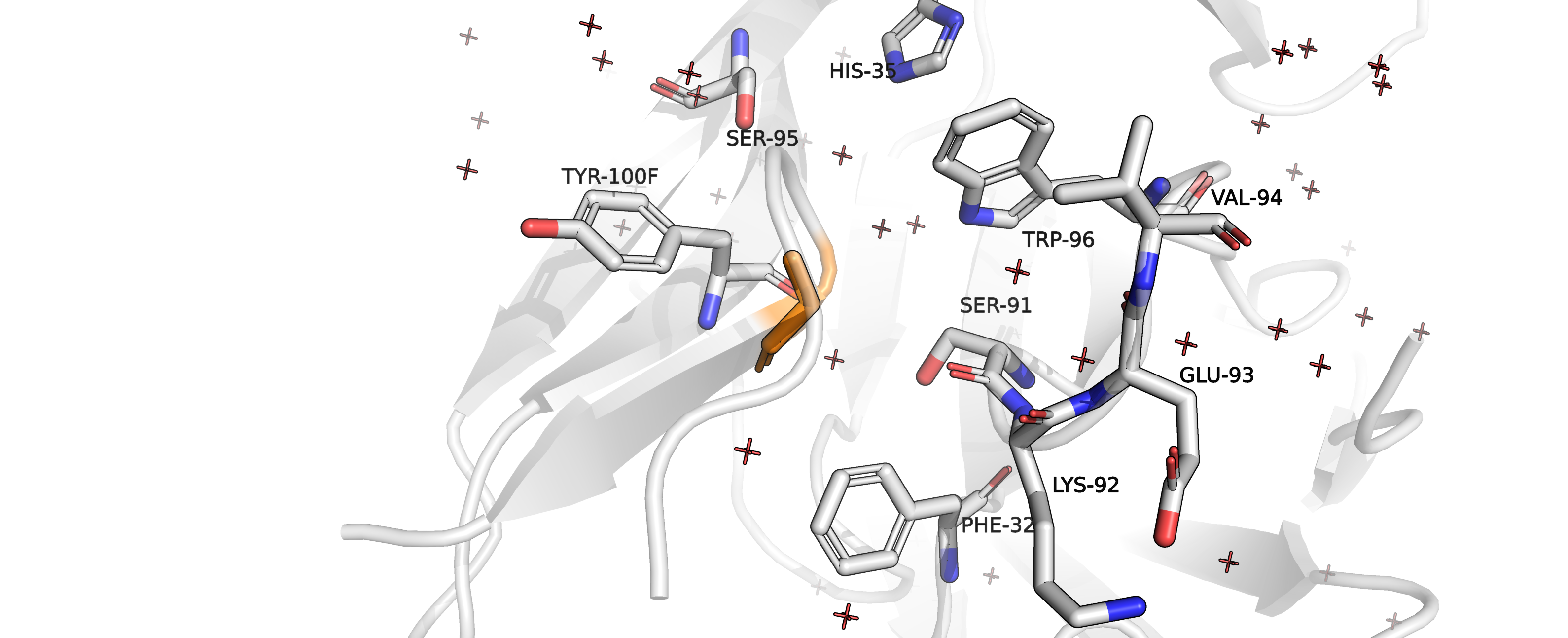 Рисунок 8. Остаток GLY41 (оранжевый) в своём окружении.
Рисунок 8. Остаток GLY41 (оранжевый) в своём окружении.
Нас, как и в случае предыдущей структуры, интереусуют взаимодействия с аминокислотами цепей, отличных от цепи, к которой пренадлежит
наш остаток, так как цель - обеспечить взаимодействие антиген-антитело.
Судя по окружению, кандидатами для взаимодействия могут выступать аминокислоты TRP96, SER91 и (с меньшей вероятностью)
PHE32 и HIS35, а также кислород карбонильной группы LYS92.
Сначала можем предположить, что в изначальной структуре подразумевался стэкинг и попробуем "примерить" вместо глицина аминокислоты с
ароматическими радикалами. Для них получаются слишком большие перекрывания Ван-дер-Ваальсовых радиусов - не подходят.
Стоит заметить, что в данной структуре, в отличии от предыдущей, присутствуют молекулы воды.
Нельзя не обратить внимание на очень симпатичную геометрию водородных связей аргинина
(ротамер 2/19, представленность 10.7 %
strain = 20.61) с водой,
несмотря на то, что такое взаимодействие вряд ли интересует нас в констексте взаимодействия антиген-антитело.
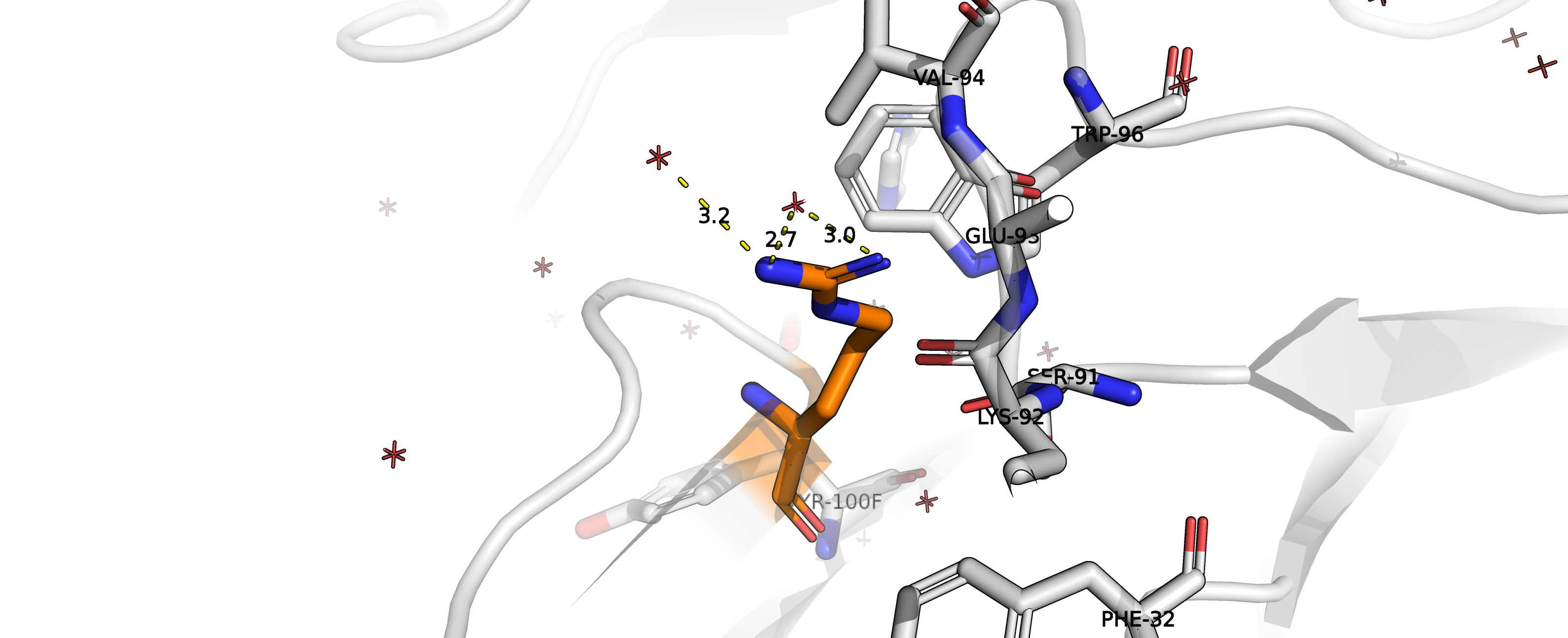 Рисунок 9. Водородные связи аргинина с водой.
Рисунок 9. Водородные связи аргинина с водой.
Попробуем посмотреть, насколько хорошо сюда подойдёт лизин (ротамер 8/19, представленность 3.2% strain = 28.40).
Получается одна водородная связь с кислородом карбонильной группой остова и одна водородная связь с водой (наверное,
не самая удачная, так как расстояние уже великовато).
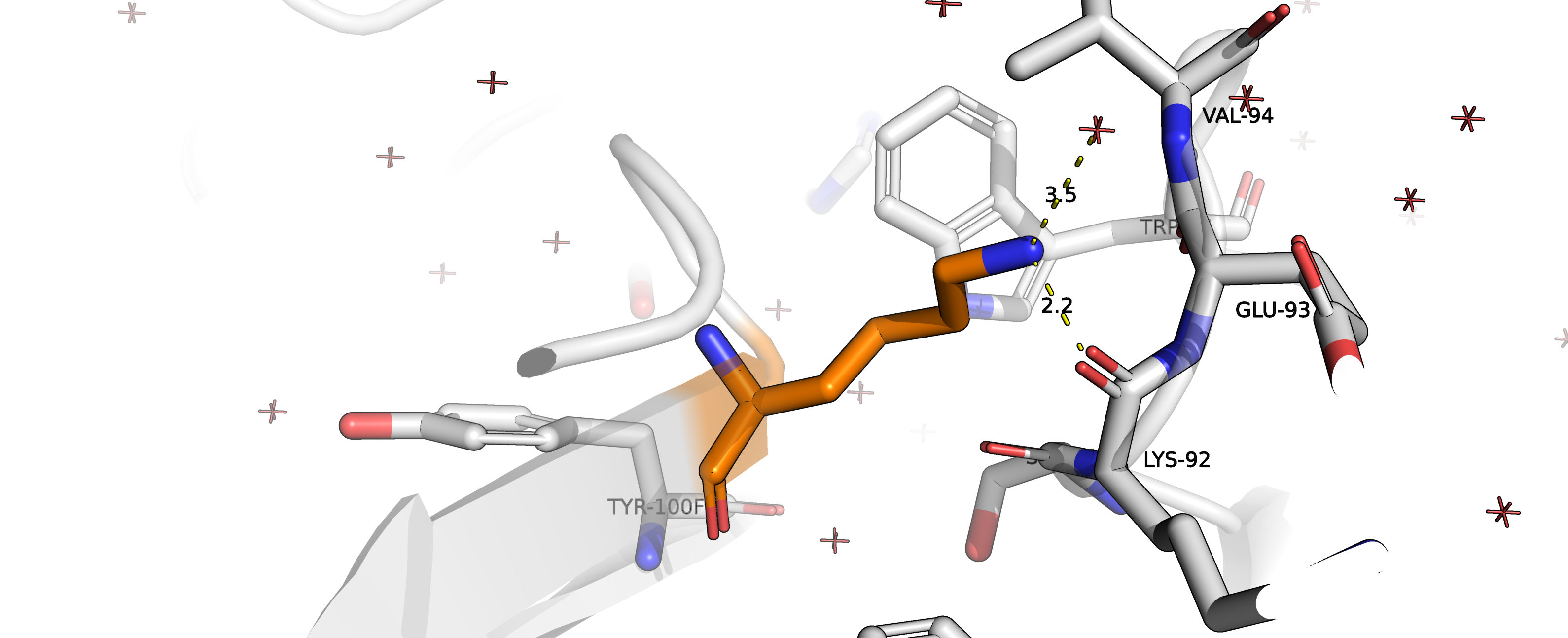 Рисунок 10. Водородные связи лизина с кислородом карбонильной группы LYS92 и водой.
Рисунок 10. Водородные связи лизина с кислородом карбонильной группы LYS92 и водой.
Попробуем, как и в первой структуре, также "примерить" другие полярные аминокислоты (окружение к этому располагает).
Для глутамина не нашлось подходящих ротамеров, зато один нашёлся для аспарагина.(ротамер 1/13, представленность 24.8 % strain = 19.28)
Данный ротамер хорош с точки зрения представленности и перекрывания Ван-дер-Ваальсовых радиусов.
Водород триптофана почти идельно "смотрит" на кислород аспарагина.
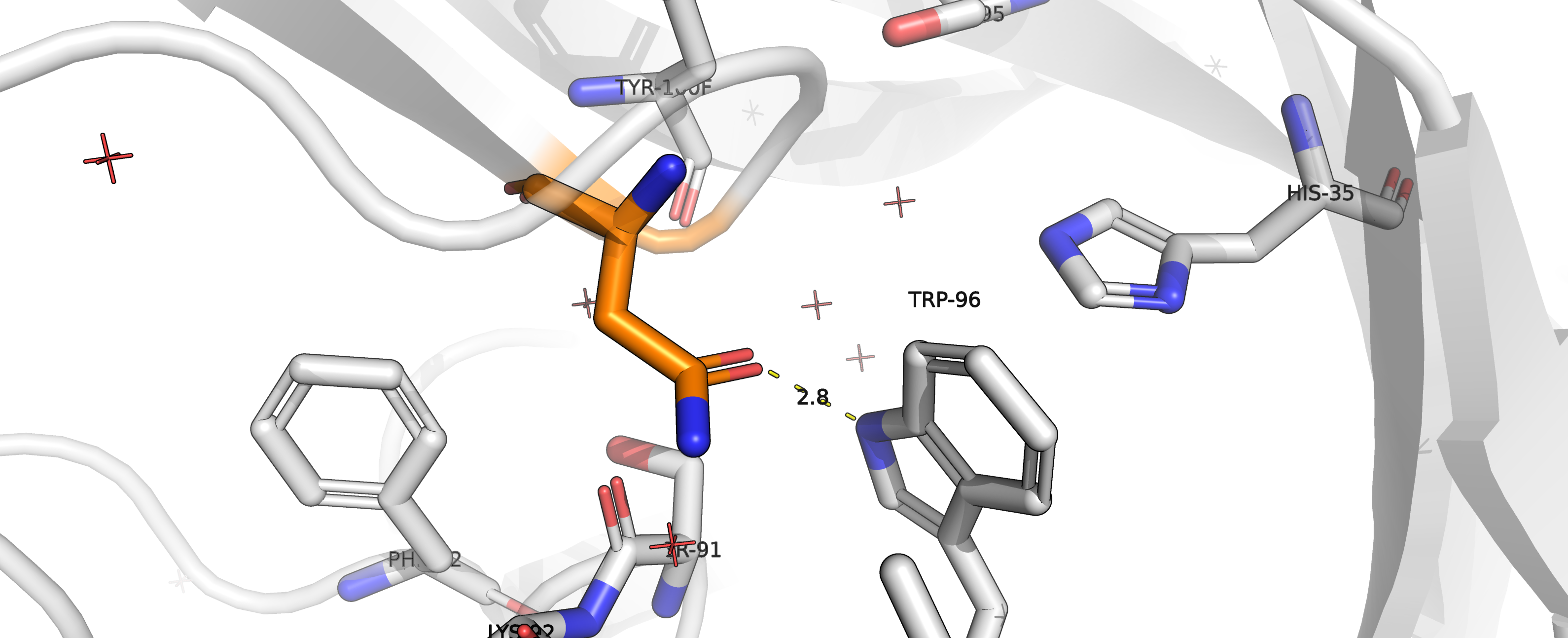 Рисунок 11. Взаимодействие аспарагина с остатком TRP96.
Рисунок 11. Взаимодействие аспарагина с остатком TRP96.
Также, есть вероятность, что тот же самый кислород аспарагина образует связи с водой (хотя длина связи великовата).
Зато получается очень хорошая геометрия: две водородные связи практически располагаются в одной плоскости.
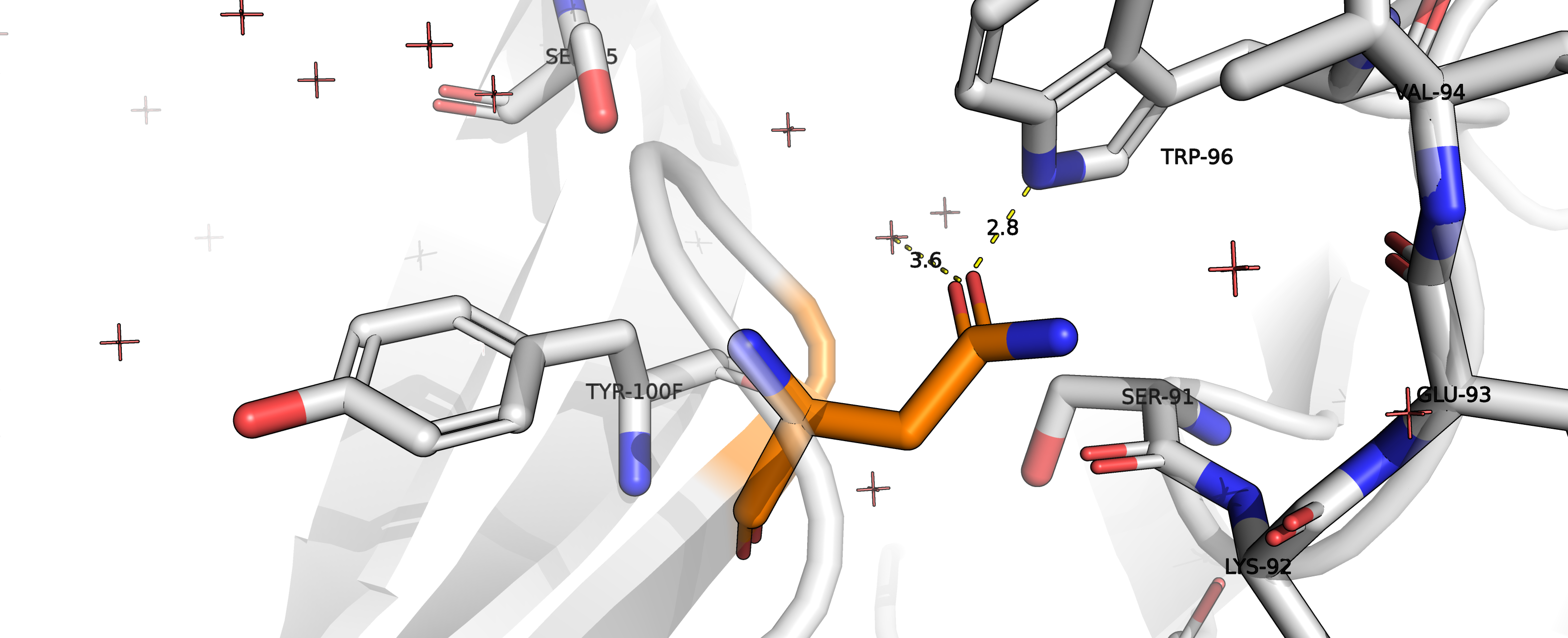 Рисунок 12. Взаимодействие аспарагина с остатком TRP96 и водой.
Рисунок 12. Взаимодействие аспарагина с остатком TRP96 и водой.
Также, в процессе подбора аминокислоты в качестве кандидата рассматривался глутамат (
ротамер 17/17, представленность 1% strain = 24.44). Однако, угол N-H-O между триптофаном и
глутаматом слишком мал, и водородной связи тут скорее нет. Но взаимодействие с водой возможно, хоть, как
и в случае с аргинином, вряд ли будет важно в контексте антиген-антитело.
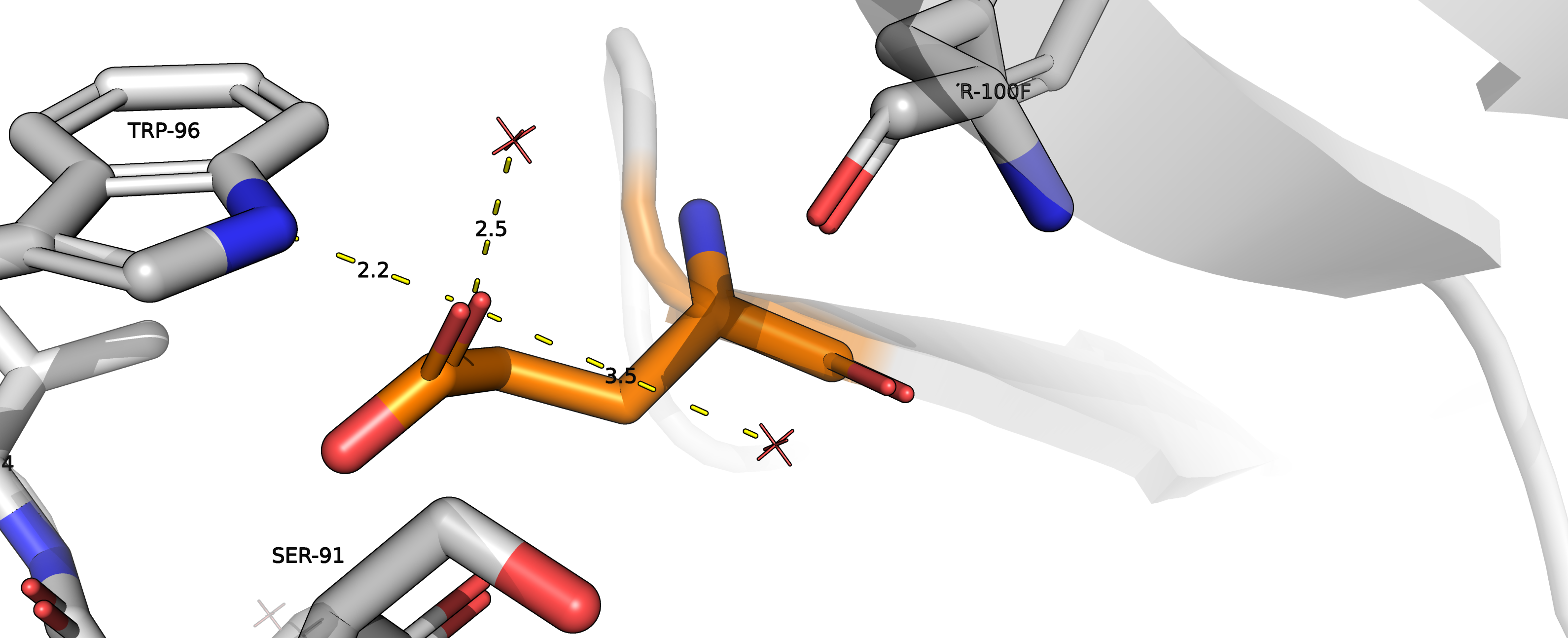
Рисунок 13.1. Взаимодействие глутамата с TRP96 и водой.
|
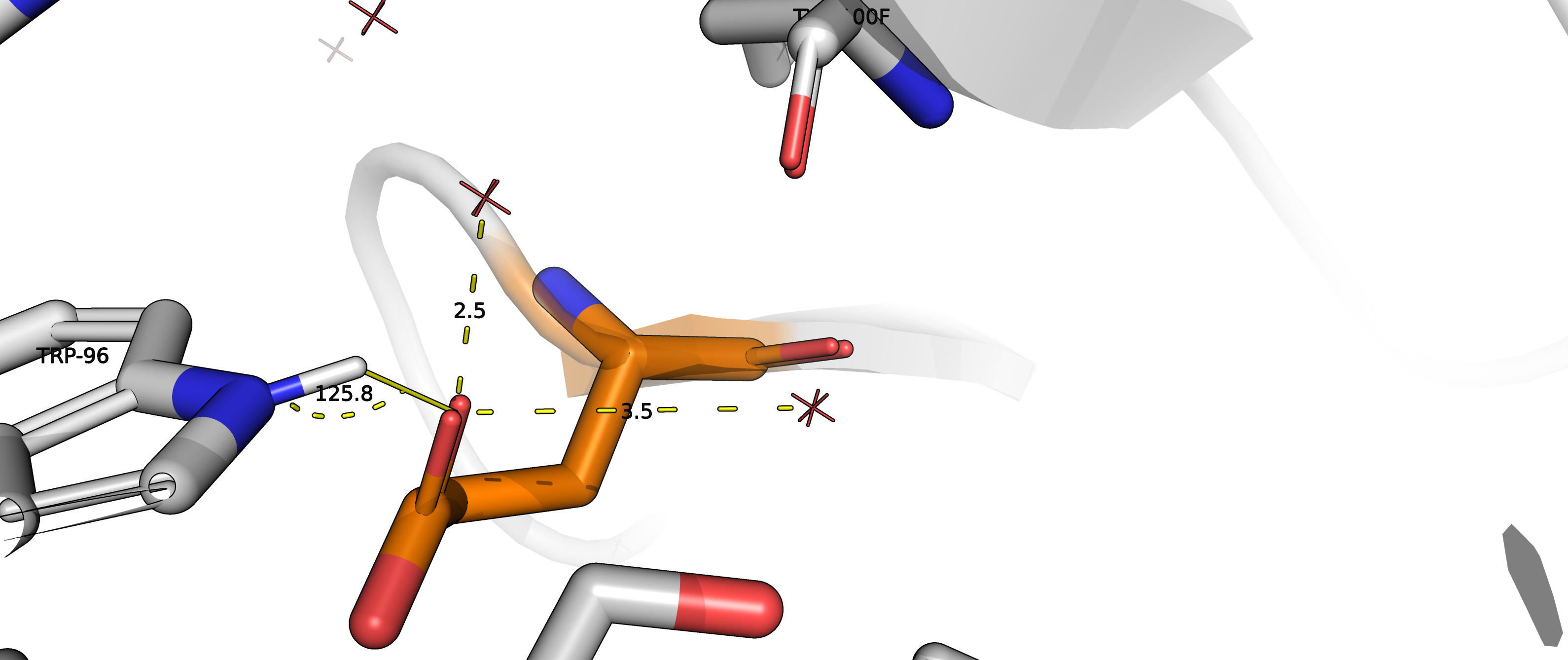
Рисунок 13.2. Взаимодействие глутамата с TRP96 и водой.
|















