Задание 1.Знакомство с укладками.
В данном задании нам было дано 10 записей PDB, соответствующие структурам последовательности имеют не более 40% попарного сходства.
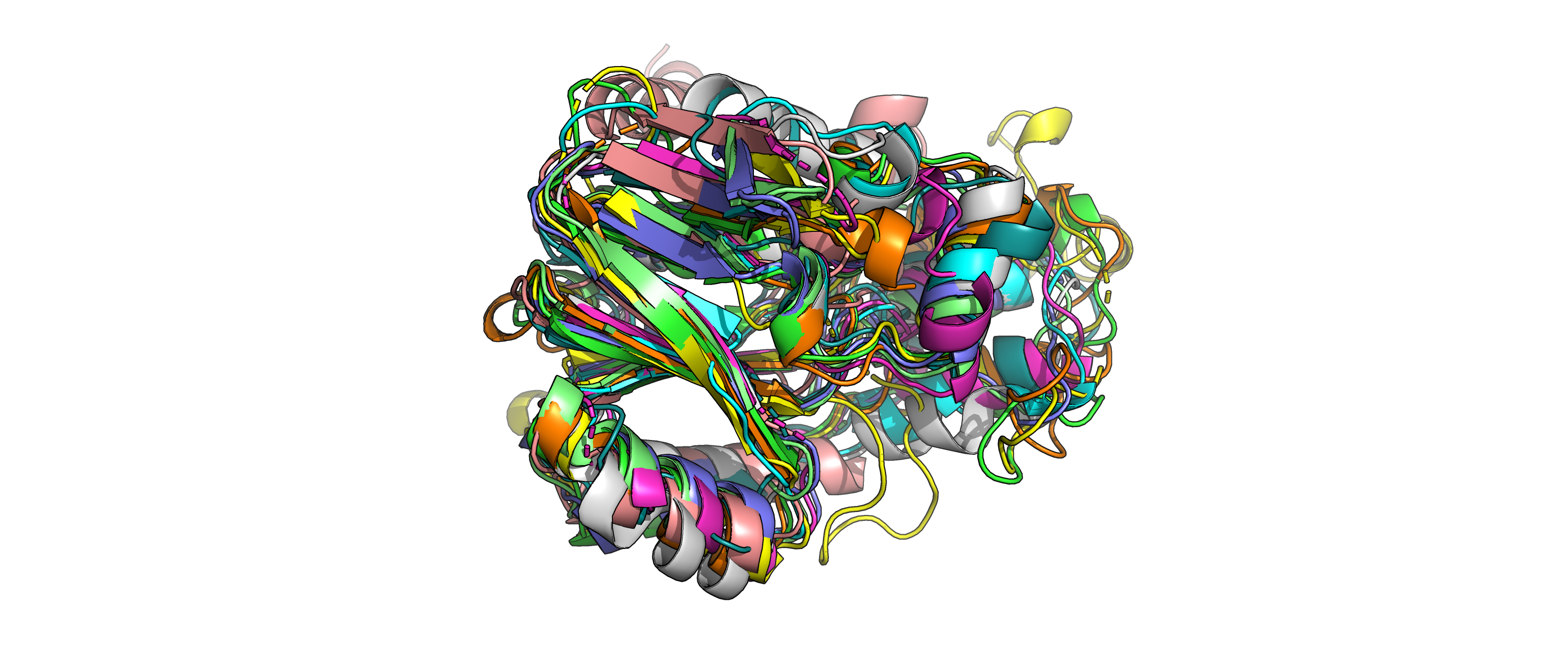 Рисунок 1.Изображение наложенных друг на друга 10 структур.
Рисунок 1.Изображение наложенных друг на друга 10 структур.
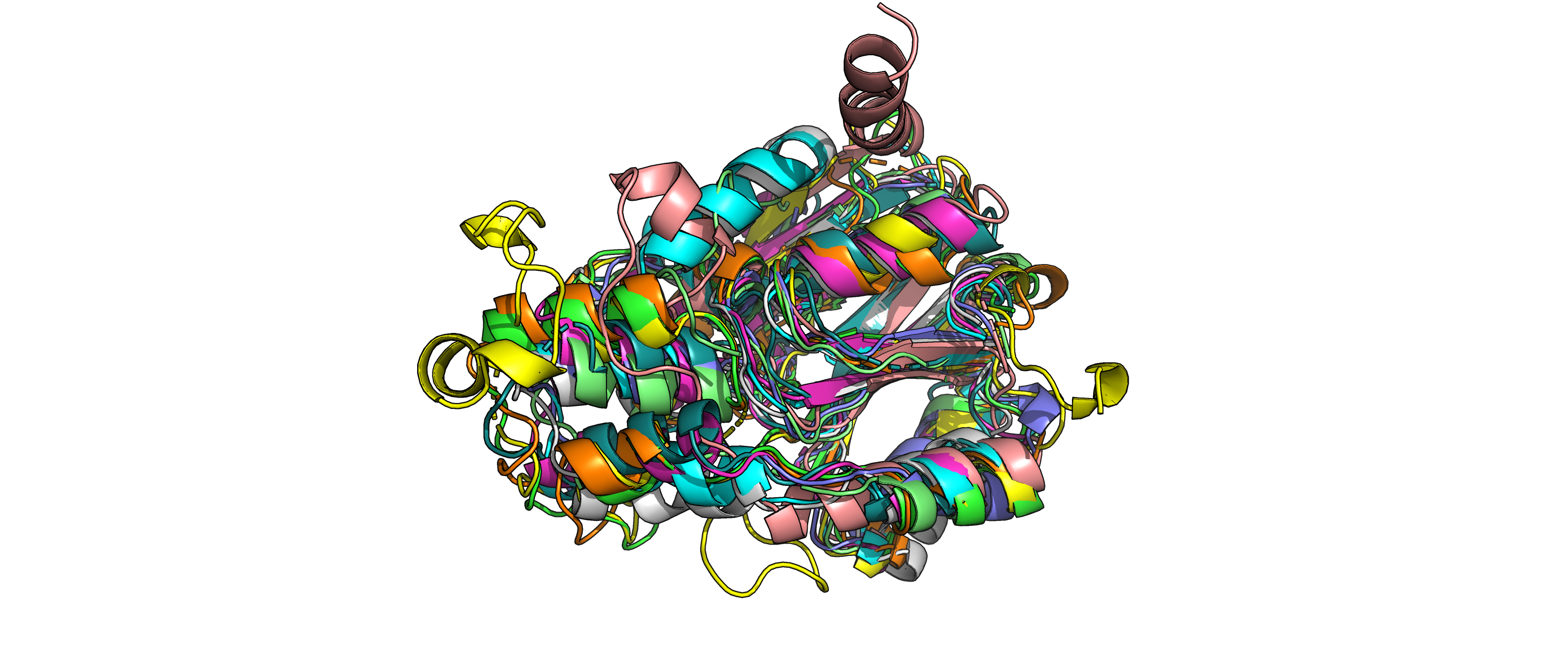 Рисунок 2.Изображение наложенных друг на друга 10 структур.
Рисунок 2.Изображение наложенных друг на друга 10 структур.
Данные структуры имеют похожую третичную структуру, однако не одинаковую.
Как видно из рисунков 1 и 2, у структур повторяется какая-то часть вторичных структур (альфа-спирали и бета-листы), но есть также
и различающиеся элементы. Например, на рисунке 2 сверху видны альфа-спирали, которые совпадают только у двух структур (обозначены
серым и голубым цветом), также сверху можно заметить 2 альфа-спирали, которые присутствуют только у структуры, покрашенной розовым
цветом.
Задание 2. Работа с разметкой вторичной структуры в ручном режиме.
В данном задании нужно было взять 2 структуры из 10, данных в предыдущем задани, и найти участок у обоих белков, который
располагается в одном месте в пространстве, но имеют различную разметку вторичной структуры.
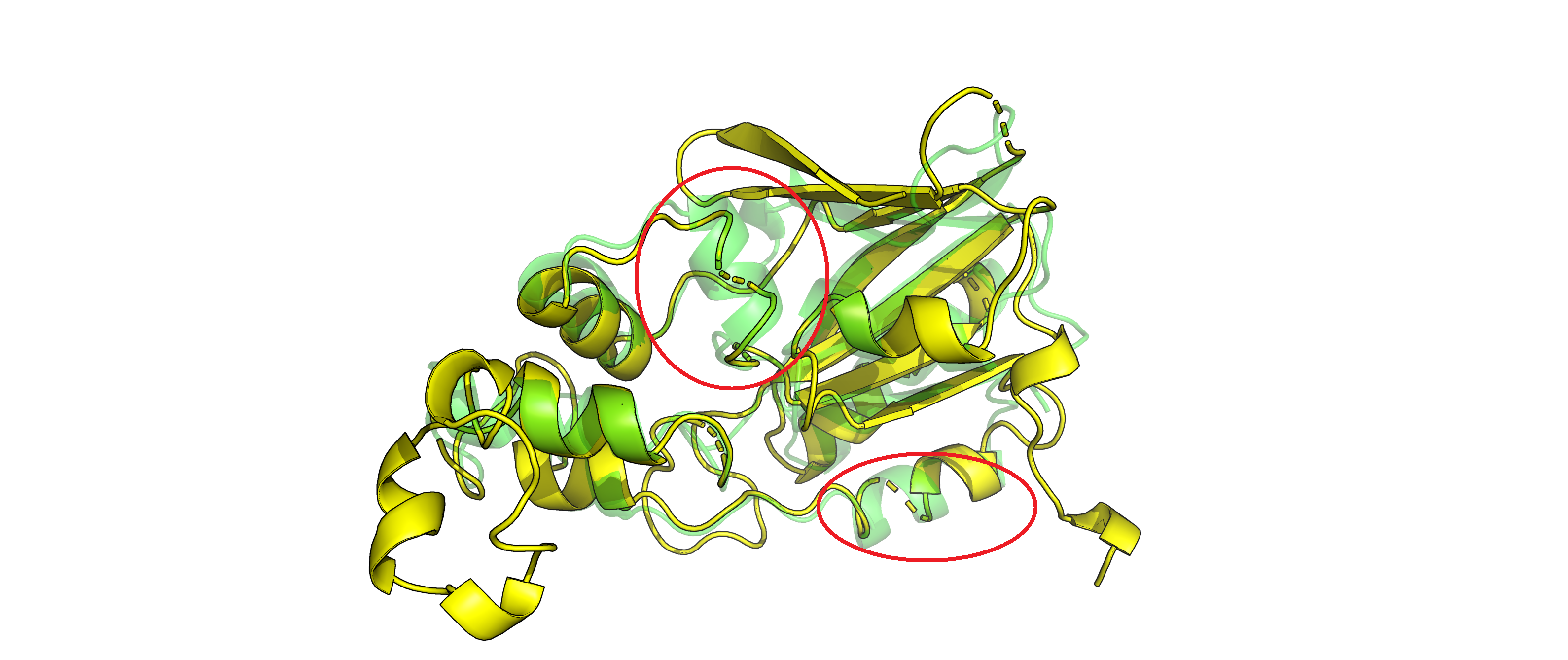 Рисунок 3. Наложенные друг на друга структуры 5vk4A02 (зеленая) и 3kizA02 (желтая).
Рисунок 3. Наложенные друг на друга структуры 5vk4A02 (зеленая) и 3kizA02 (желтая).
Мы помним, что между нашими белками не более 40% попарного сходства. Из того, что сразу бросается в глаза - это
элементы структуры 5vk4A02 (зеленой), размеченные как спирали, и соответствующие им при наложении элементы структуры 3kizA02
(желтой), размеченные как петли. Таким элементы обведены красным на рис. 3. Посмотрим, почему так получилось.
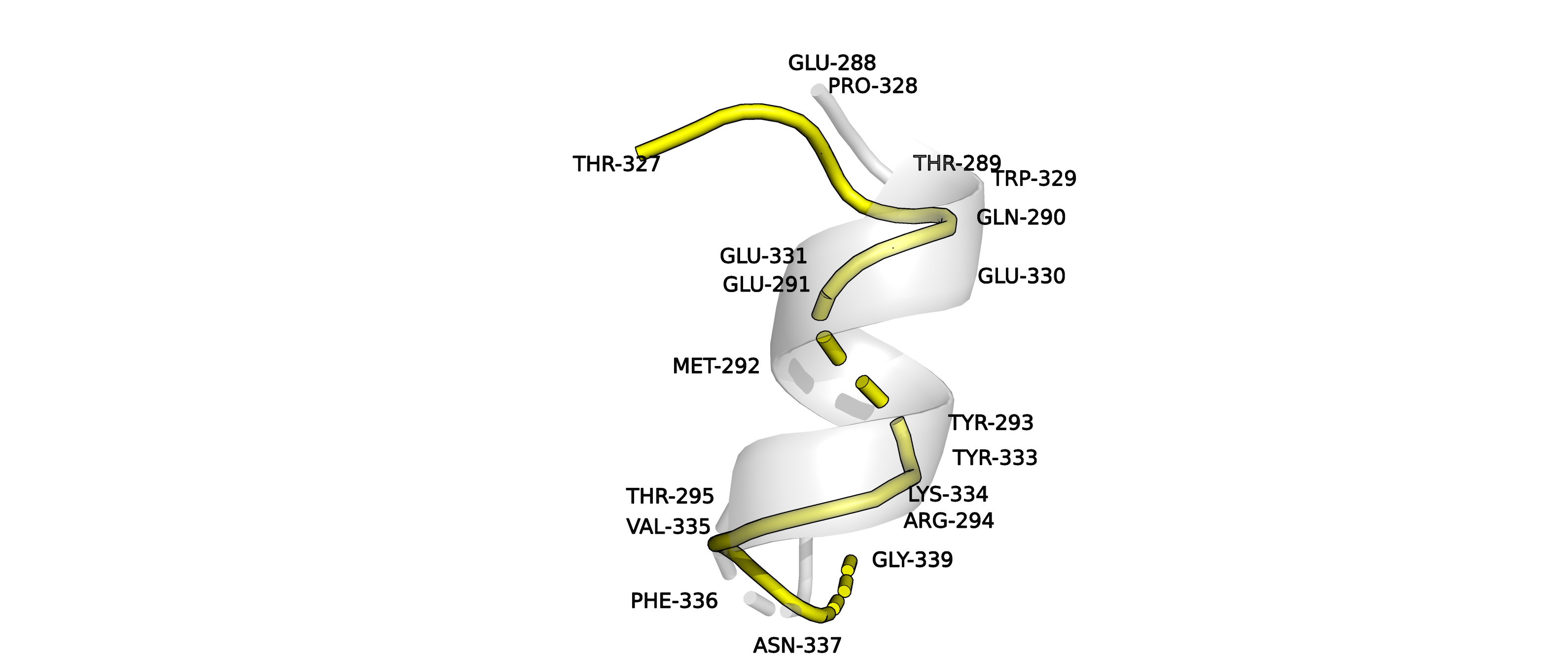 Рисунок 4. Наложенные друг на друга куски структур 5vk4A02 (серая) и 3kizA02 (желтая), имеющие разную разметку вторичной структуры.
Рисунок 4. Наложенные друг на друга куски структур 5vk4A02 (серая) и 3kizA02 (желтая), имеющие разную разметку вторичной структуры.
На рисунке 4 можно видеть увеличенный различающийся элемент вторичной структуры, который мы далее будем изучать.
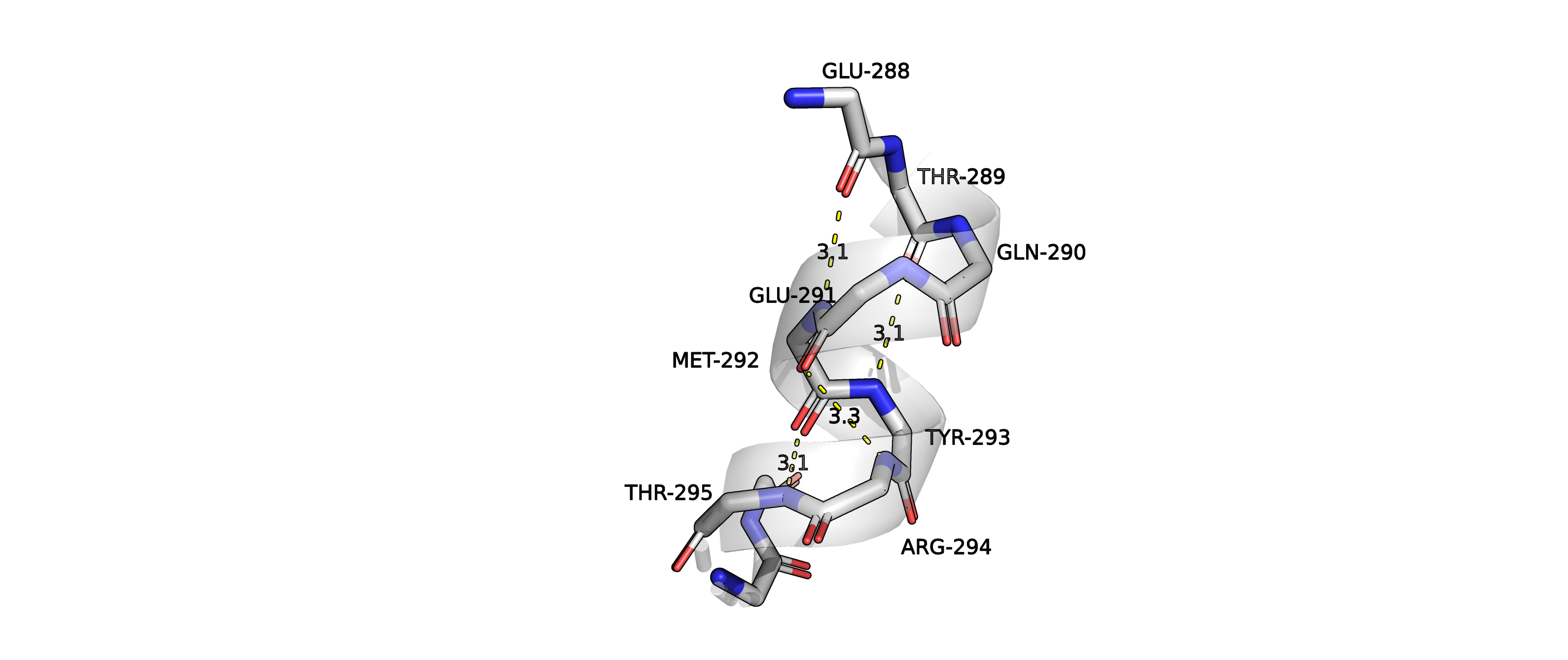 Рисунок 5. Изображение водородных связей между атомами остова, изображенными в виде sticks, наложенных на
изображение вторичной структуры в виде cartoons для структуры 5vk4A02.
Рисунок 5. Изображение водородных связей между атомами остова, изображенными в виде sticks, наложенных на
изображение вторичной структуры в виде cartoons для структуры 5vk4A02.
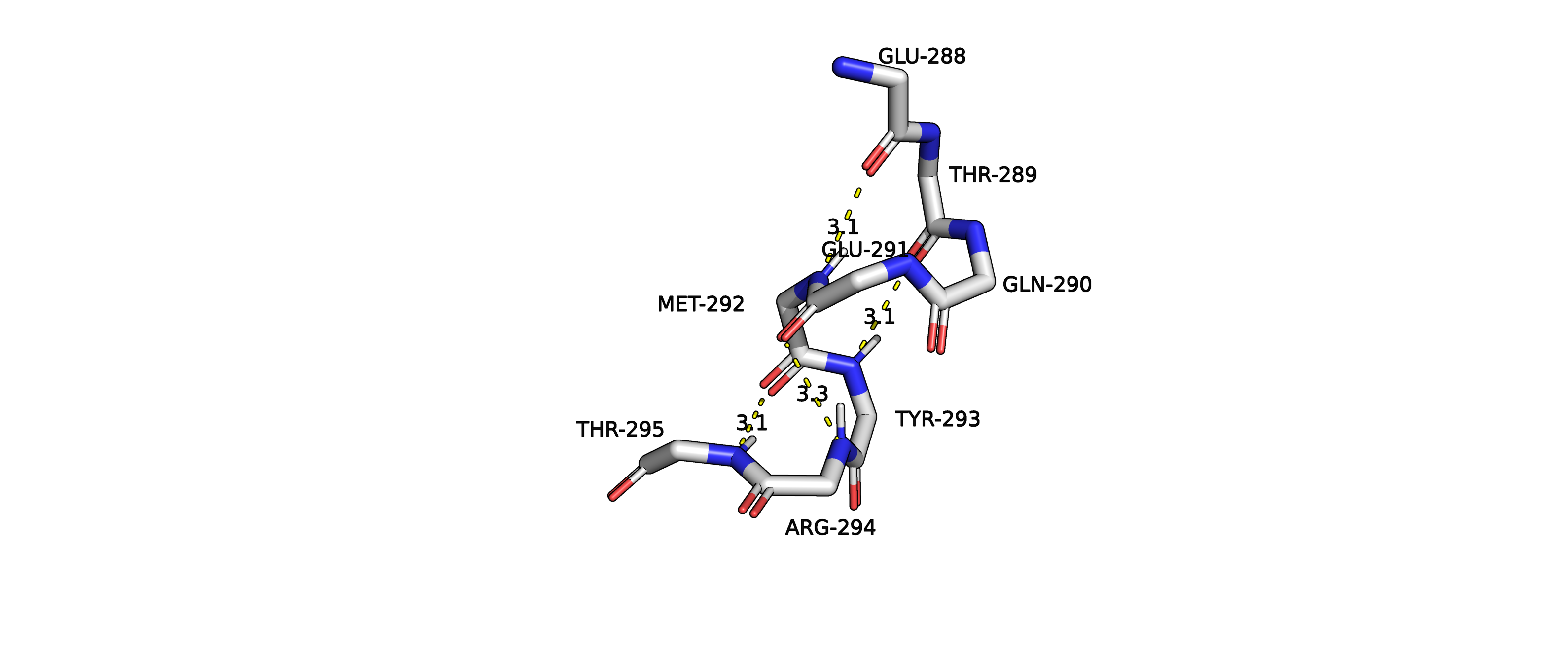
Рисунок 6. Водородные связи спирали структуры 5vk4A02.
|
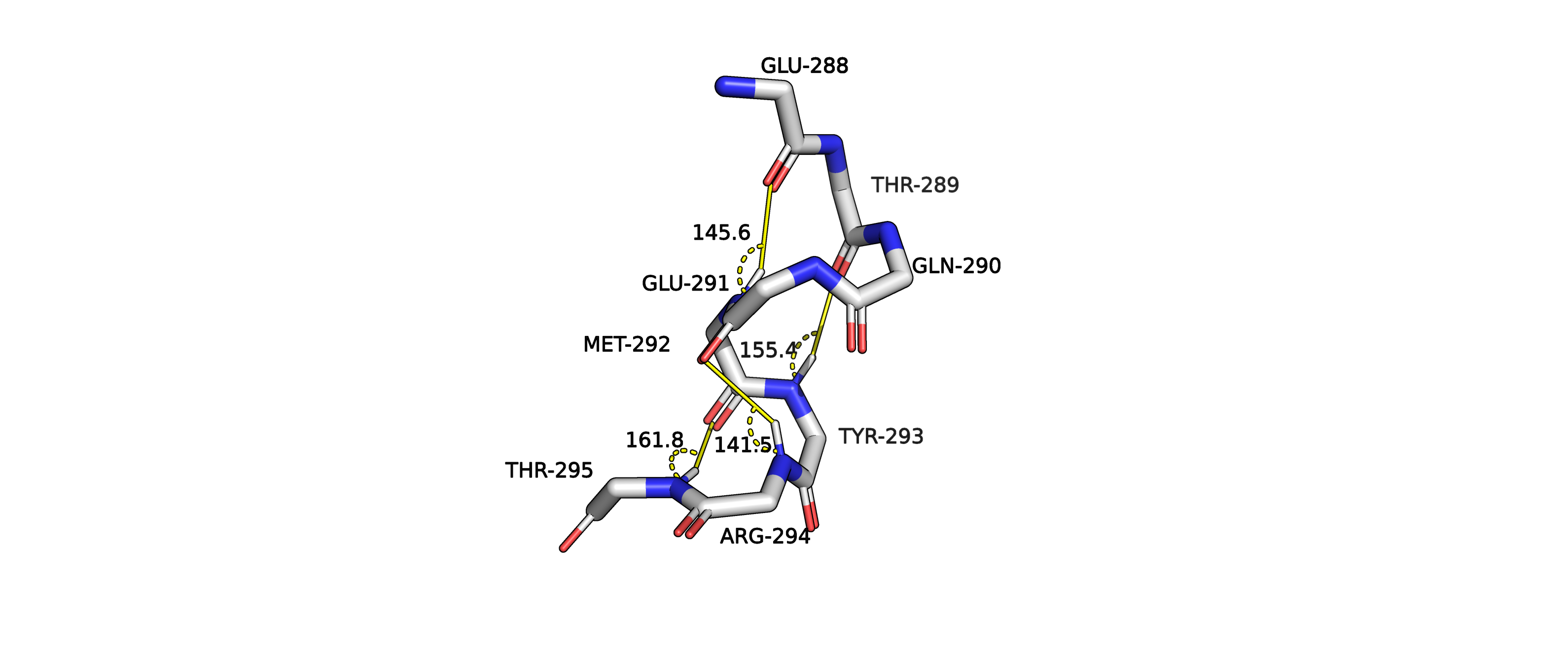
Рисунок 7. Углы N-H-O водородных связей спирали структуры 5vk4A02.
|
На рисунке 5 изображены водородные связи, которые, как мне показалось, должны участвовать в образовании вторичной структуры
(для удобства отображение боковые радикалы убраны).
Мы можем наблюдать водородные связи между GLU288 и MET292, THR289 и TYR293, GLU291 и ARG294, MET292 и THR295. Первые 2 связи
(GLU288 и MET292, THR289 и TYR293) соединяют i
и i+4 остаток, между которыми в "цикле" насчитывается 13 атомов, соединенных ковалентной
связью (считая добавленные инструментарием PyMol'a водород). Это соответствует альфа-спирали (4,13).
Вторые 2 водородные связи соединяют i остаток с остатком i+3, и между ними насчитывается 10 атомов (включая H), соединенных ковалентной
связью. Это соответсвует (3,10) спирали. Такие спирали менее распространены, могут располагаться на концах альфа-спиралей.
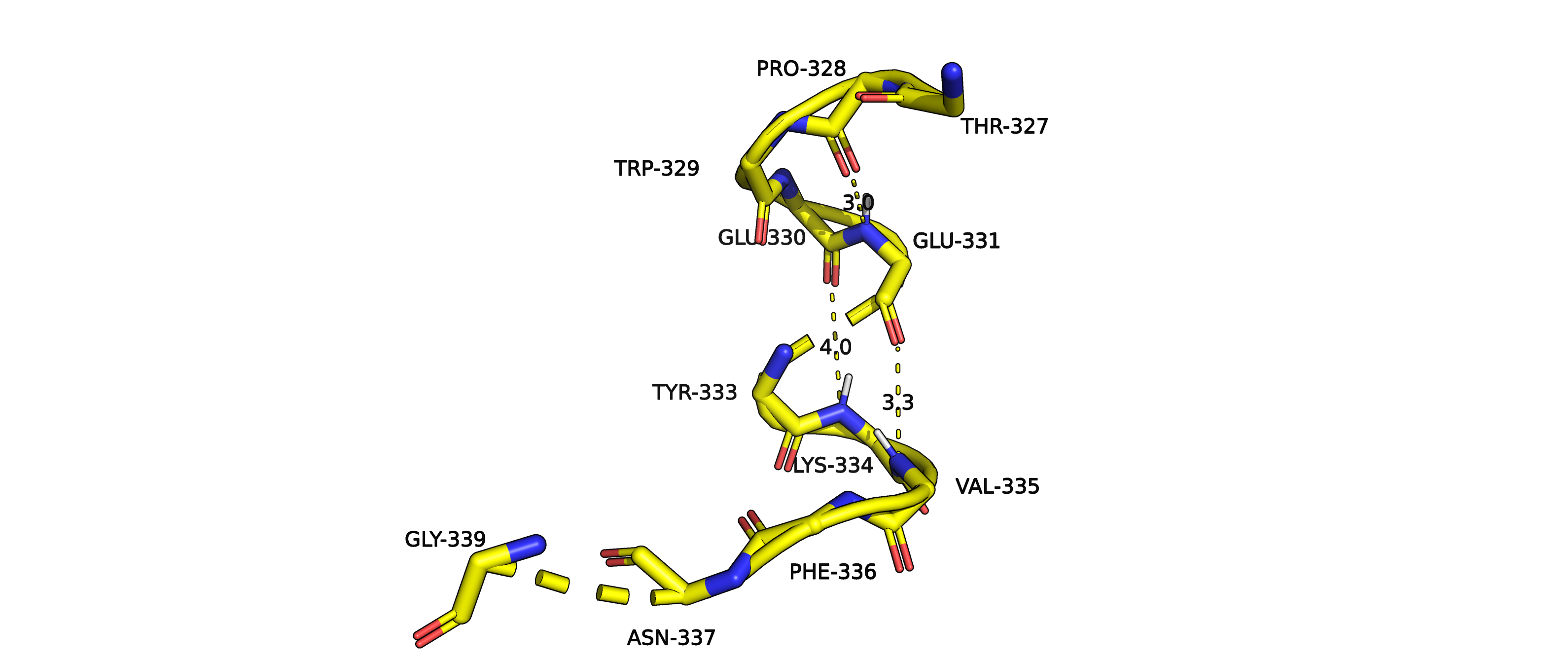 Рисунок 8. Изображение водородных связей между атомами остова, изображенными в виде sticks, наложенных на
изображение вторичной структуры в виде cartoons 3kizA02.
Рисунок 8. Изображение водородных связей между атомами остова, изображенными в виде sticks, наложенных на
изображение вторичной структуры в виде cartoons 3kizA02.
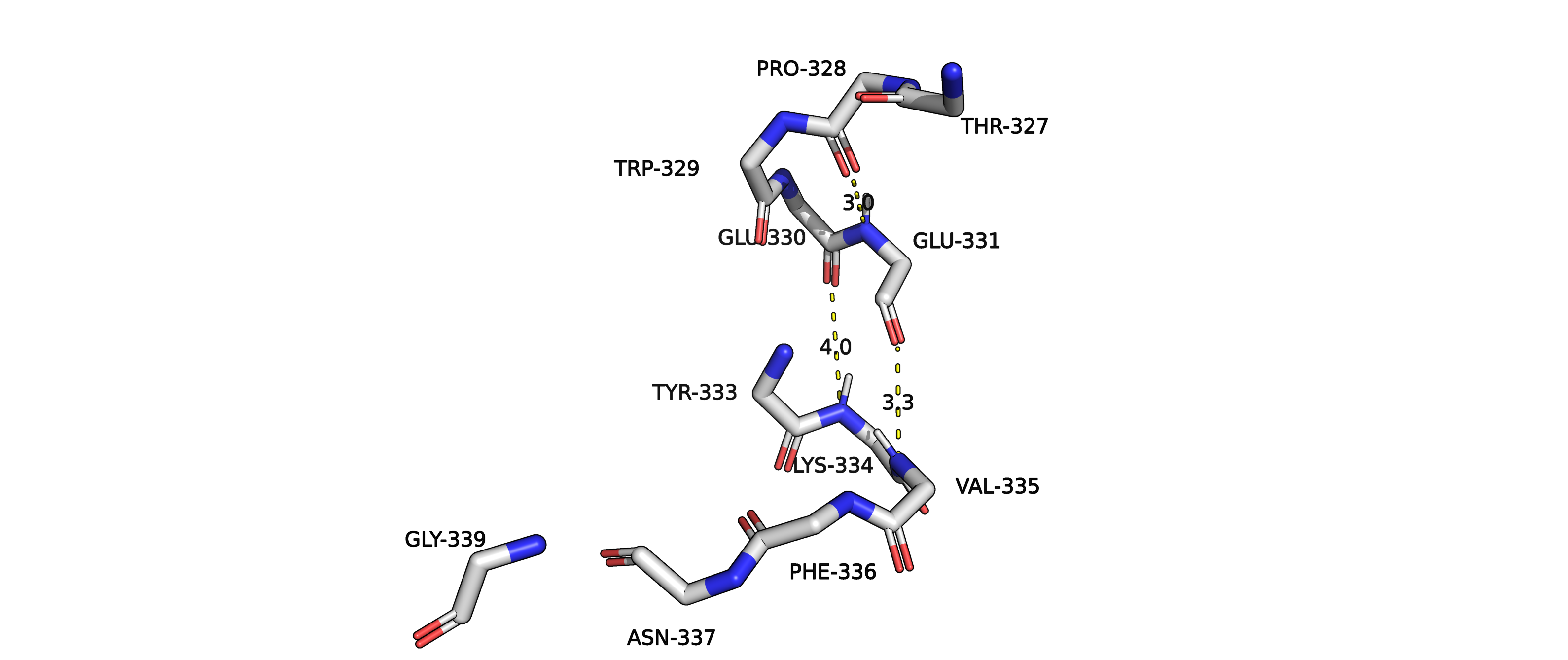
Рисунок 9. Водородные связи альфа-спирали структуры 3kizA02.
|
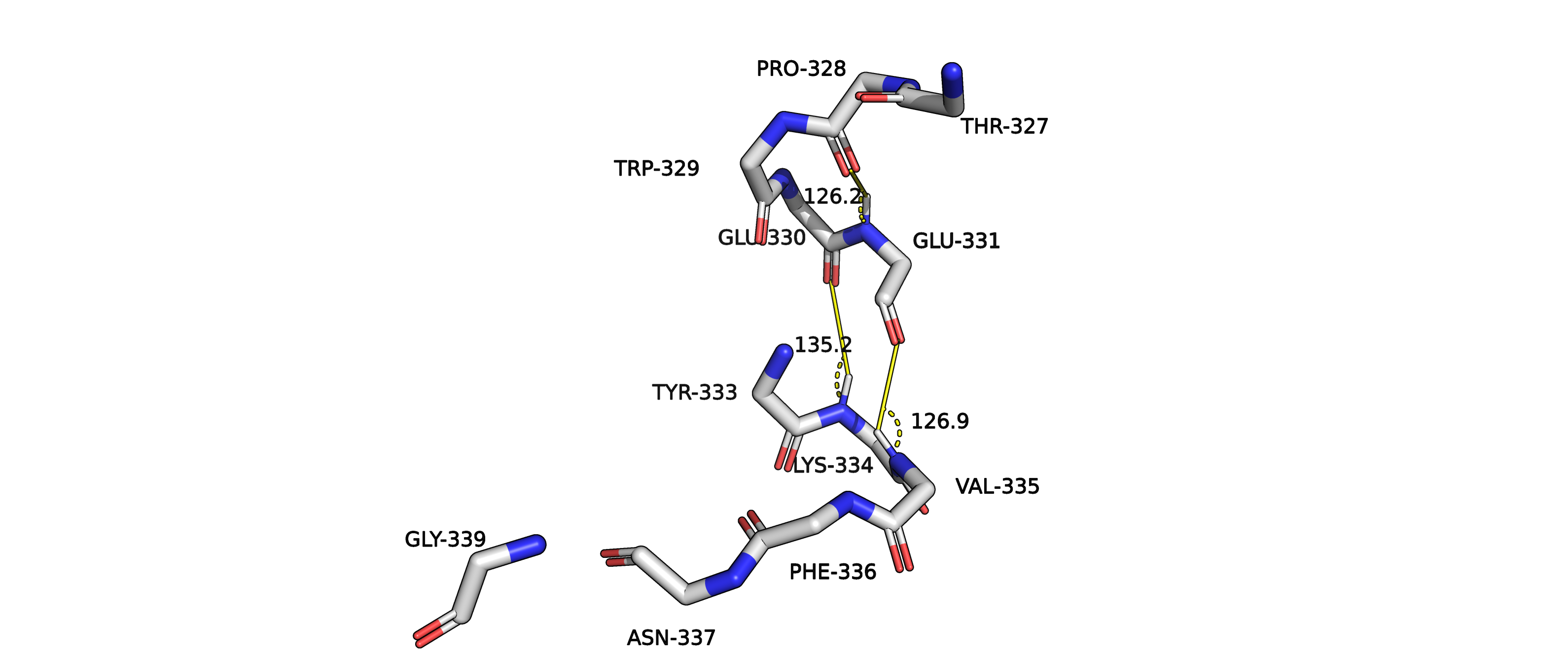
Рисунок 10. Углы N-H-O водородных связей альфа-спирали структуры 3kizA02.
|
В данной структуре можно было бы предположить образование водородных связей между парами: PRO328 и GLU331, GLU330 и LYS334,GLU331 и VAL335.
Но если посмотреть на углы N-H-O, то мы видим неблагоприятную геометрию (слишком маленькие углы для водородных связей). То есть,
можно объяснить, почему алгоритм не распознал данный отрезок как спираль.
Задание 3. Работа с разметкой вторичной структуры в автоматическом режиме.
В данном задании требовалось для 10 PDB-структур из задания 1 сгенерировать разметку вторичной структуры с помощью dssp и рассчитать
склонности каждого типа аминокислот образовывать тот или иной тип вторичной структуры.
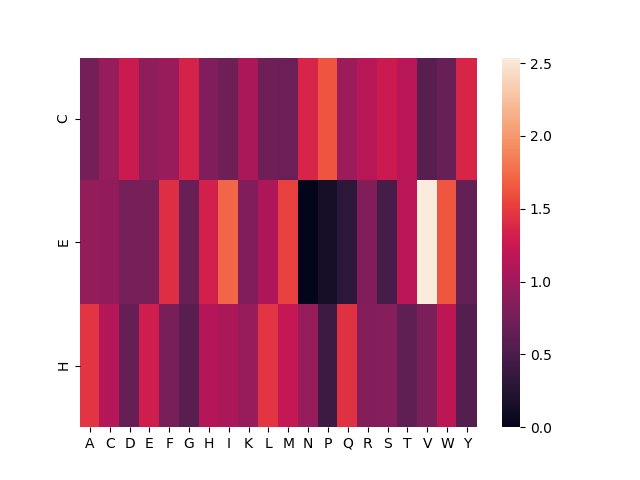 Рисунок 11. Тепловая карта, склонности остатков образовывать вторичные структуры. 'C' - петли, 'E' - бета-листы,
'H' - альфа-спирали.
Рисунок 11. Тепловая карта, склонности остатков образовывать вторичные структуры. 'C' - петли, 'E' - бета-листы,
'H' - альфа-спирали.
По получившимся данным получается, что:
1)Альфа-спирали, чаще, чем бета-листы и петли, образует глутамин, но тут также стоит отметить ещё и аланин.
2)Бета-листы, чаще, чем альфа-спирали и петли, образует валин.
3)Петли, чаще, чем альфа-спирали и бета-листы, образует пролин.
Таблица со склонностями аминокислот образовывать вторичные структуры.










