| На главную |
|
Мои проекты | Ссылки | Обо мне | Мои заметки |
Внутримолекулярные взаимодействия в структуре MntR
Общая характеристика структуры 1ON2
| Идентификатор PDB | 1ON2 |
| Название белка | Марганцевый транспортный регулятор Bacillus Subtilis (Bacillus Subtilis manganese transrort regulator (MntR)) Синоним: Регулятор транскрипции MntR (Transcriptional regulator MntR) |
| Количество цепей в PDB-файле | 2 цепи: А и В |
| Лиганды | 2 иона Mn2+ |
Вторичная структура белка изображена на рисунке 1
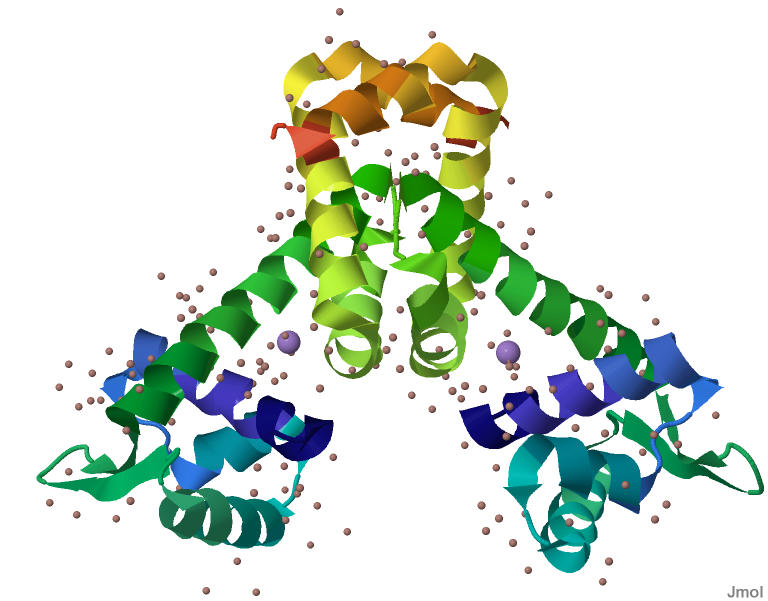
Рис.1 Вторичная структура белка MntR Переход от N-конца к C-концу показан переходом цвета от темно-синего до красного. Темно-синий - N-конец. Красный - C-конец. Ионы марганца окрашены в сиреневый цвет. Молекулы воды (в виде маленьких шариков) окарашены красновато-серым цветом.
Анализ структуры альфа-спиралей и бета-листов в цепи A белка с кодом PDB 1ON2
Белок cостоит из цепей А и В. Всего в белке MntR содержится 8 альфа-спиралей в цепи А, 9 альфа-спиралей в цепи B и по одному бета-листу
из 2х антипаралленых бета-тяжей в каждой из цепей.
На рисунке 2 изображена цепь А с выделенными бета-листом и одной из альфа-спиралей. На рисунке 3 изображены выделенные альфа-спираль
и бета-лист отдельно.
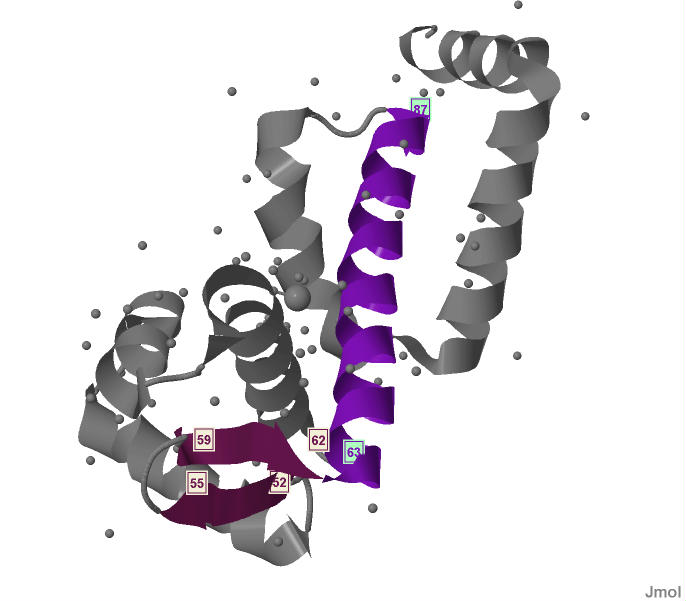 |
Рис.2 Цепь А белка MntR с вылеленными на ней бета-листом и альфа-спиралью. Цепь А окрашена серым цв
етом, альфа-спираль окрашена фиолетовым цветом, бета-лист - бордовым цветом. Указаны номера аминокислотных остатков начала и конца каждого из бета-тяжей
и альфа-спирали. |
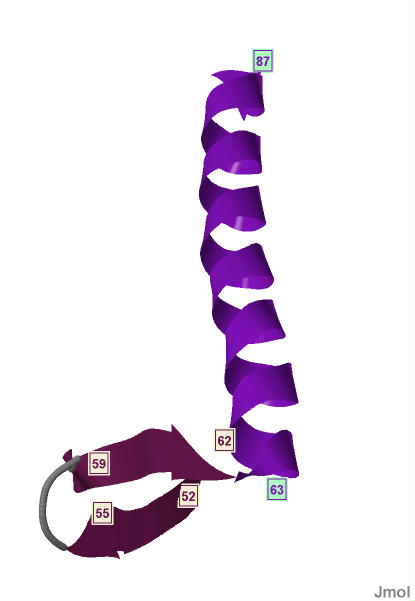 |
Рис.3 Одна из альфа-спиралей и бета-лист цепи А белка MntR. Альфа-спираль содержит с 63-го по 87-й аминокислотные остатки. Бета-тяжи с 52-го по 55-й и с 59-го по 62-й остатки. |
Характеристики выбранной альфа-спирали (с 63-го по 87-й аминокислотный остаток)
| Шаг спирали примерно равен 6,11 ангстрем (см. рис.4). Рис.4(справа) Фрагмент альфа-спирали цепи А белка MntR. Измерен шаг спирали. |
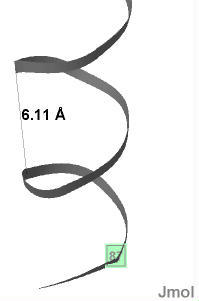 |
|
| На один виток приходится в среднем 4 аминокислотных остатка (см. рис.5). Рис.5(справа)Фрагмент альфа-спирали цепи А белка MntR. Аминокистоные остатки в витке поочередно отмечены красным или зеленым. Отмечена длина шага спирали. |
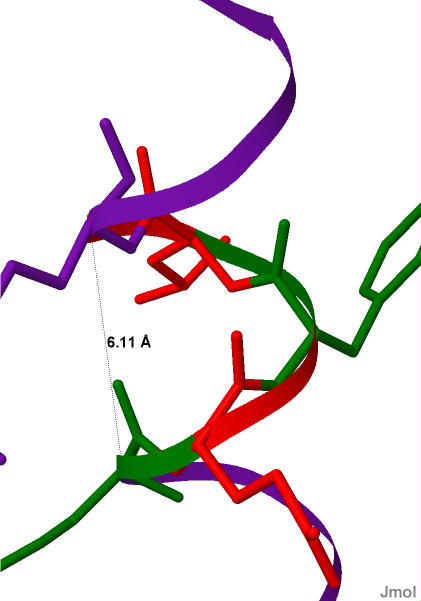 | |
| Аминокислотный остаток с номером n, находящийся в середине спирали образует водородные связи с n+4 и n-4 остатками (см. рис.6). Рис.6(справа) Фрагмент альфа-спирали цепи А белка MntR. Показаны водородные связи и их длина для 77-го аминокислотного остатка. |
 |
Характеристика бета-листа цепи А белка MntR
| В данном листе только антипараллельные бета тяжи (см. рис.7), это означает, что тяжи противоположно направлены (С-конец одного тяжа рядом с N-концом другого). Рис.7(справа) Фрагмент бета-цепи цепи А белка MntR. Указаны номера аминокислотных остатков начала и коца бета-тяжей. Направление от N-конца к С-концу показано стрелкой. |
 |
|
| Лист образует вогнуто-выпуклую поверхность (см. рис.8). Рис.8(справа)Фрагмент бета-цепи цепи А белка MntR. Вид в другом ракурсе. Виден изгиб бета-тяжа. |
 |
Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры MntR
В белке MntR остатков цистеина не обнаружено, следовательно цистеиновых (серных) мостиков в белке нет.
В цепи А белка было обнаружено 4 солевых мостика между остатками положительно и отрицательно заряженных аминокислот (см. рис.9).
Один из нид представлен отдельно на рис. 10.
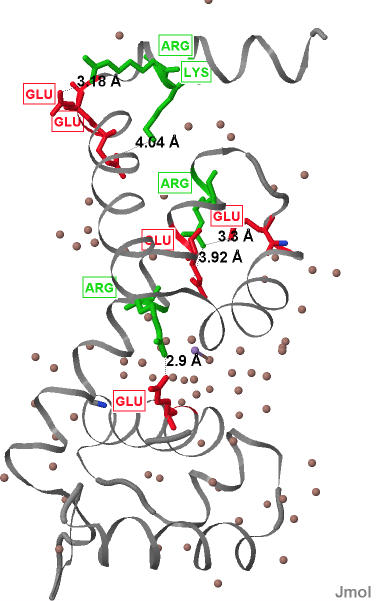 Рис.9 Солевые мостики в цепи А белка MntR Цепь А окрашена серым, положительно заряженные аминокислоты мостиков окрашены зеленым, отрицательно заряженные окрашены красным. Молекулы воды (в виде маленьких шариков) окарашены красновато-серым цветом. Показаны расстояния между атомами образующими солевой мостик. Подписаны трехбуквенные коды аминокислот. |
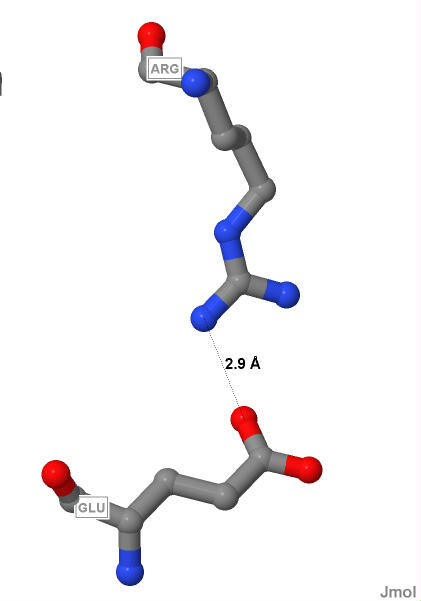 Рис. 10. Солевой мостик между аргинином и глутаминовой кислотой Атомы азота окрашены синим, кислорода красным, углерода серым. |
Источники информации:
[1] Страница о белке на UniProt
© Ходыкина Наталья, 2012