| На главную |
|
Мои проекты | Ссылки | Обо мне | Мои заметки |
Описание области контакта белка и лиганда Mn2+ в структуре MntR
Лиганды в структуре 1ON2
Вторичная структура белка изображена на рисунке 1. Примерные размеры белка представлены в таблице 1, размер лиганда равен его атомному радиусу и составляет 1,3 Å
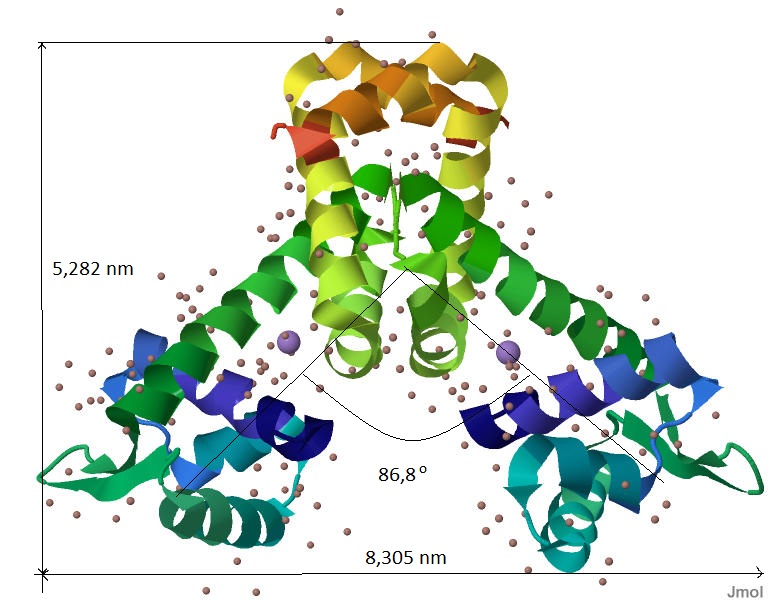
Рис.1 Вторичная структура белка MntR и лиганд Mn2+ Переход от N-конца к C-концу показан переходом цвета от темно-синего до красного. Темно-синий - N-конец. Красный - C-конец. Ионы марганца окрашены в сиреневый цвет. Отмечены примерные размеры белка и угол, образуемый цепями.
Таблица 1. Размеры белка MntR.| Единица измерения | Длина | Ширина | Высота |
| Å | 52,82 | 23,19 | 83,05 |
| nm (nanometer) | 5,282 | 2,319 | 8,305 |
| m (meter) | 5,282*10-9 | 2,319*10-9 | 8,305*10-9 |
Ион марганца в белке MntR, скорее всего, является кофактором. MntR является репрессором белка-транспортера, импортирующего марганец[1].
Анализ области контакта белка из структуры PDB 1ON2 и лиганда MN
Белок содержит 2 иона Mn2+, по одному в каждой из цепей. Так MntR - гомодимер, то в дальнейшем будет рассматриваться лиганд только одной цепи. На рисунке 1 лиганды (ионы марганца) выделены сиреневым цветом. На рисунке 2 показано относительное расположение лиганда и молекул связанных с ним (аминокислотные остатки и молекула воды) в белке. С ионом марганца связаны аминокислотные остатки гистидина, глутаминовой кислоты и молекула воды. Их взаимное расположение показано на рисунке 3. На рисунке 4 приведена схема лиганда и его окружения с указанием связей и их длин.
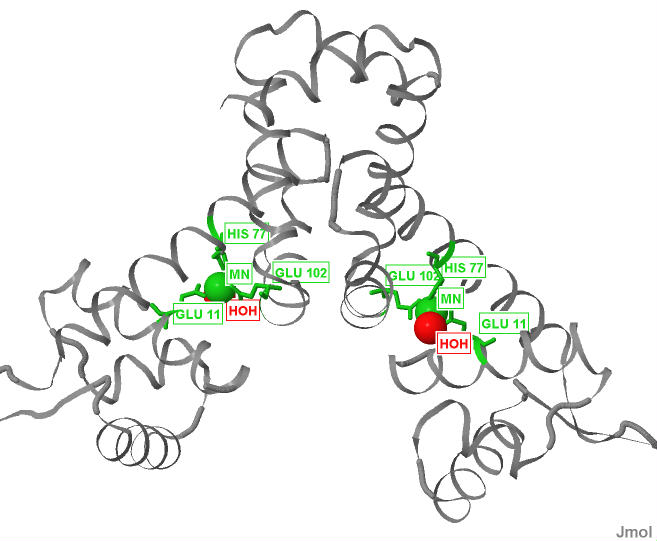
Рис.2. Относительное расположение лиганда и его окружения в белке. Белок окрашен серым, ион Mn2+ красным, молекулы, связанные с ним зеленым.
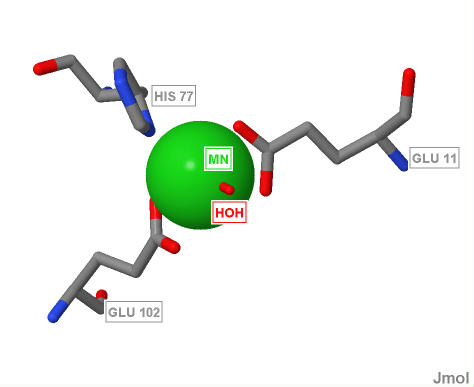
Рис.3. Взаимное расположение лиганда и окружающих его молекул. Подписаны трехбуквенные коды и номера аминокислотных остатков. Ион марганца окрашен зеленым.
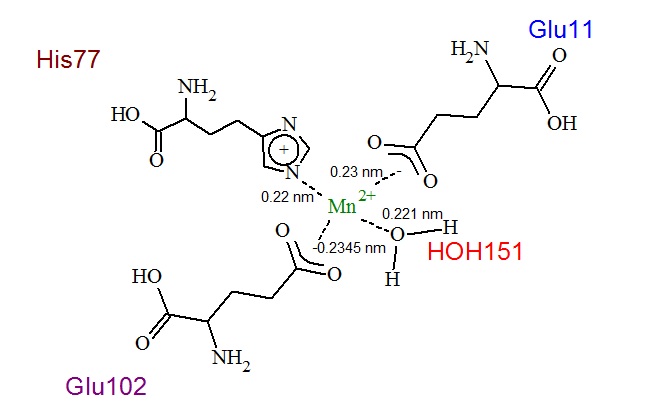
Рис.4. Связи между лигандом и связывающими его молекулами. На рисунке указаны номера и трехбуквенные обозначения аминослот, окружащих лиганд, подписаны молекула воды, участвующая во взаимодействиии и длины связей (в nm).
Изображения представленные на рисунках 1 и 3 можно получить используя этот скрипт для программы JMol.
Проект генно-инженерного эксперимента с белком из структуры 1ON2
Точечная мутация - это мутация, приводящая к замене одного нуклеотида. При возможности замены аминокислоты, можно заменить её на близкую по свойствам или на совершенно отличную.
Если целью является сохранение белком возможности связывать лиганд, то есть 2 варианта возможной замены:
1)Заменить аминокислоту, не входящую в центр связывания лиганда. В таком случае, изменения не повлияют на способность белка связывать лиганд. За исключением случаев, когда заменена аминоксилота, имеющая важное значение
для правильной структуры белка. Для белка MntR такой заменой, почти не влияющей на его функционирование, могла бы стать замена тирозина75 (Tyr75). Заменой, которая могла бы повлиять на структуру белка, а, соответственно, и на его
способность связывать лиганд, могла бы стать замена одной из аминокислот участвующих в образовании солевых мостиков, например глутамата81 (Glu81) или аргинина85 (Arg85) на любую аминокислоту не способную к подобному взаимодействию.
2)Заменить аминокислоту из центра связывания белка на похожую по свойствам. Это, возможно, уменьшит способность белка связывать лиганд, но не лишит её полностью.
Для белка MntR одной из таких замен могла бы стать замена одного из остатков глутамата, входящих в окружение лиганда, на остаток аспартата.
Если целью является потеря белком способности связывать лиганд, то для её достижения неоходимо заменить аминоксислоты, входящие в центр связывания лиганда, на аминослоты резко отличные по свойствам. Например, Glu102 на глицин.
Источники информации:
[1] Аннотация статьи о белке на PubMed
© Ходыкина Наталья, 2012