| На главную |
|
Мои проекты | Ссылки |
Сравнение методов ЯМР и РСА
Для работы был взят белок циклофилин А из бактерии Escherichia coli. Для этого белка в PDB содержатся структуры, полученные и ЯМР (PDB код 1OCA, число моделей - 20), и РСА (PDB код 1W8L, разрешение 1.8 Å). Структуры достаточно похожи (см. рис. 1)
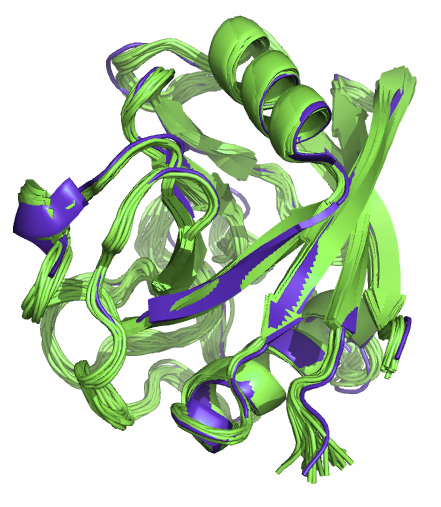
Рис. 1. Совмещение структур циклофилина А,
полученных ЯМР (зеленые) и РСА (фиолетовая).
Для сравнения структур были выбраны три водородных связи в разных областях белка:
1)между карбоксильным кислородом Asn35 и аминогруппой Leu39 внутри α-спирали (см. рис. 2)2)между азотом боковой цепи His92 и кислородом боковой цепи Ser99 в ядре белка (см. рис. 3)
3)между кислородом боковой цепи Gln163 и аминогруппой боковой цепи Arg37 на поверхности белка (см. рис. 4)
Для каждого из трёх случаев в структуре РСА и для всех моделях структуры ЯМР были измерены расстояния между атомами. Наличие водородной связи между двумя атомами в модели принималось при расстоянии не больше 3.5 Å. По этому правилу рассчитала процент встречаемости каждой из водородных связей в моделях ЯМР. Эти значения записаны в таблицу 1 вместе с минимальным, максимальным и медианным расстояниями между атомами.
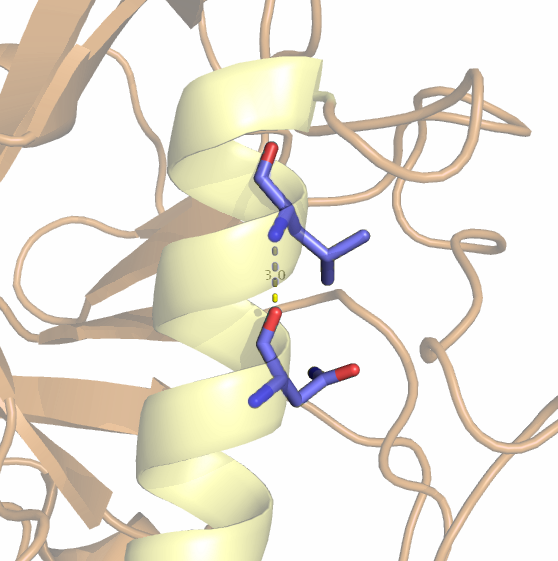
Рис. 2. Водородная связь между атомами О и N остатков Asn35 и Leu39.
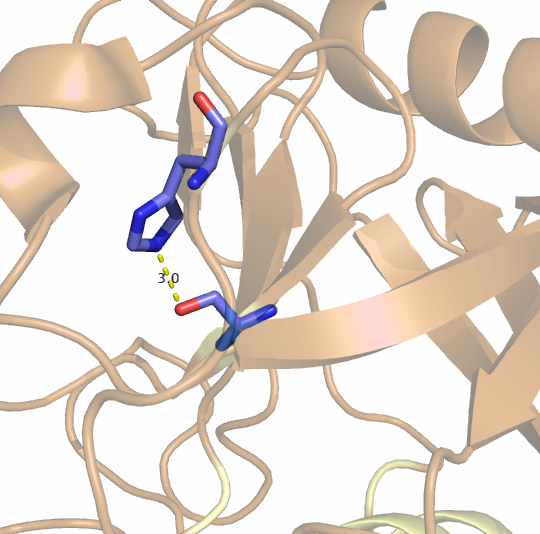
Рис. 3. Водородная связь между атомами NE2 и OG остатков His92 и Ser99.
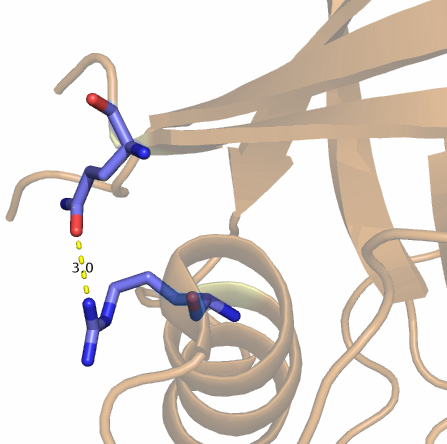
Рис. 4. Водородная связь между атомами ОE1 и NH1 остатков Gln163 и Arg37.
| Связь | Положение | Расстояние между атомами (Å) | Встречаемость в моделях ЯМР (%) | |||
| РСА | ЯМР | |||||
| минимум | медиана | максимум | ||||
| Asn35:O и Leu39:N | остов белка в α-спирали | 3.0 | 2.9 | 3.3 | 3.5 | 100 |
| His92:NE2 и Ser99:OG | боковые радикалы в ядре белка | 3.0 | 2.7 | 2.8 | 3.5 | 100 |
| Gln163:ОE1 и Arg37:NH1 | боковые радикалы на поверхности белка | 3.0 | 2.7 | 4.9 | 6.4 | 30 |
Не смотря на то, что внешне структуры, полученные методами ЯМР и РСА, выглядят весьма похожими, в растворе белок более подвижен, поэтому расстояния между некоторыми остатками могут отличаться. Наибольная стабильность наблюдается внутри элемента вторичной структуры, в частности α-спирали, аналогично для боковых радикалов аминокислотных остатков внутри ядра белка. Поверхностные петли отличаются меньшей стабильностью.