

Глицин-оксидаза (рис. 1) относится к классу оксидоредуктаз и принимает участие в пути биосинтеза тиамина (витамин B1). Этот белок состоит из двух субъединиц, с каждой из которых нековалентно связан флавинадениндинуклеотид (рис. 2). Данный белок с идентификатором UniprotKB "GLYOX_GEOKA" был выделен из бактерии Geobacillus kaustophilus штамма HTA426 (тип Firmicutes), которая, в свою очередь, была обнаружена в глубоководных осадках Марианского желоба (Takami et al., 2004).
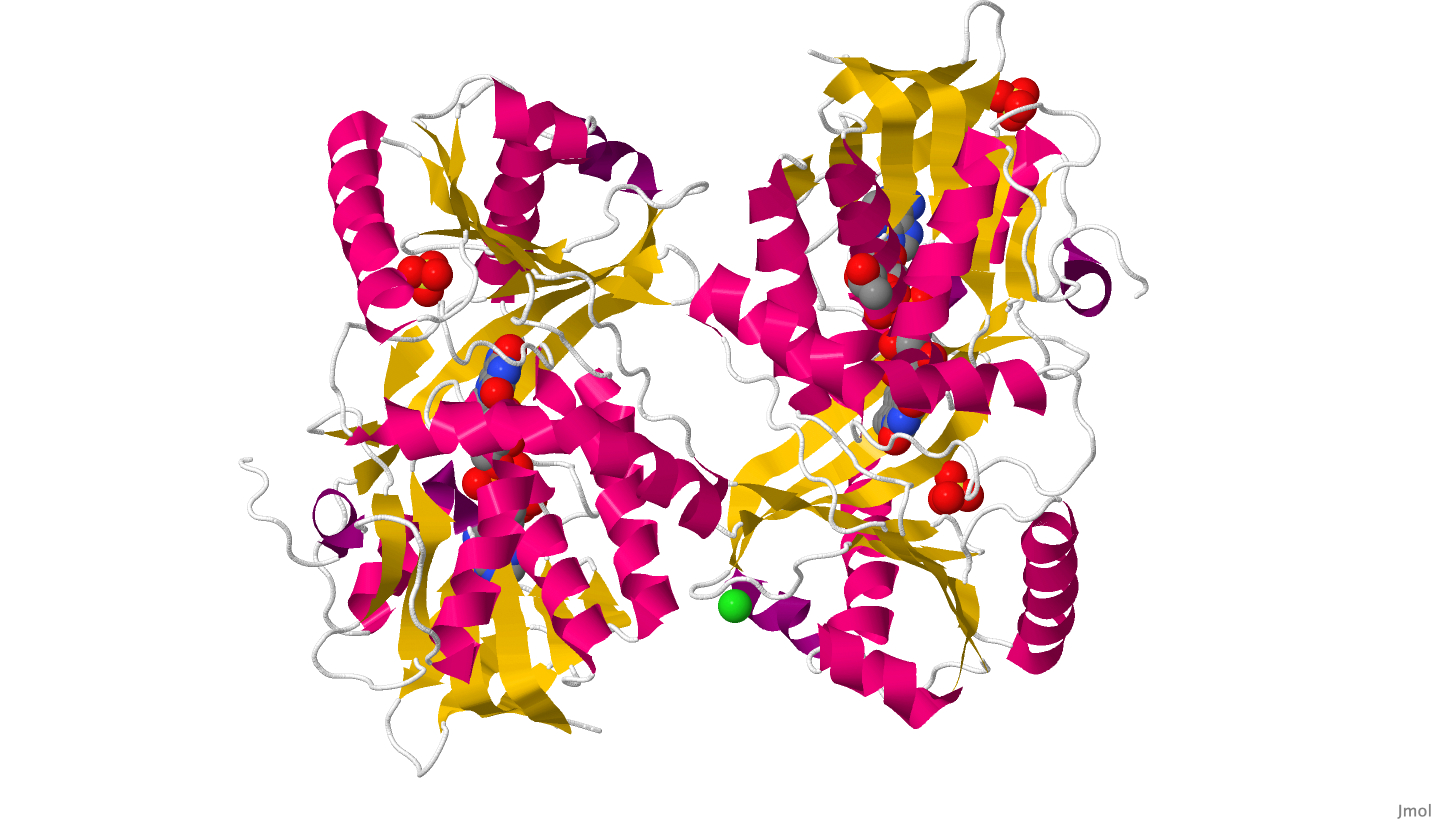
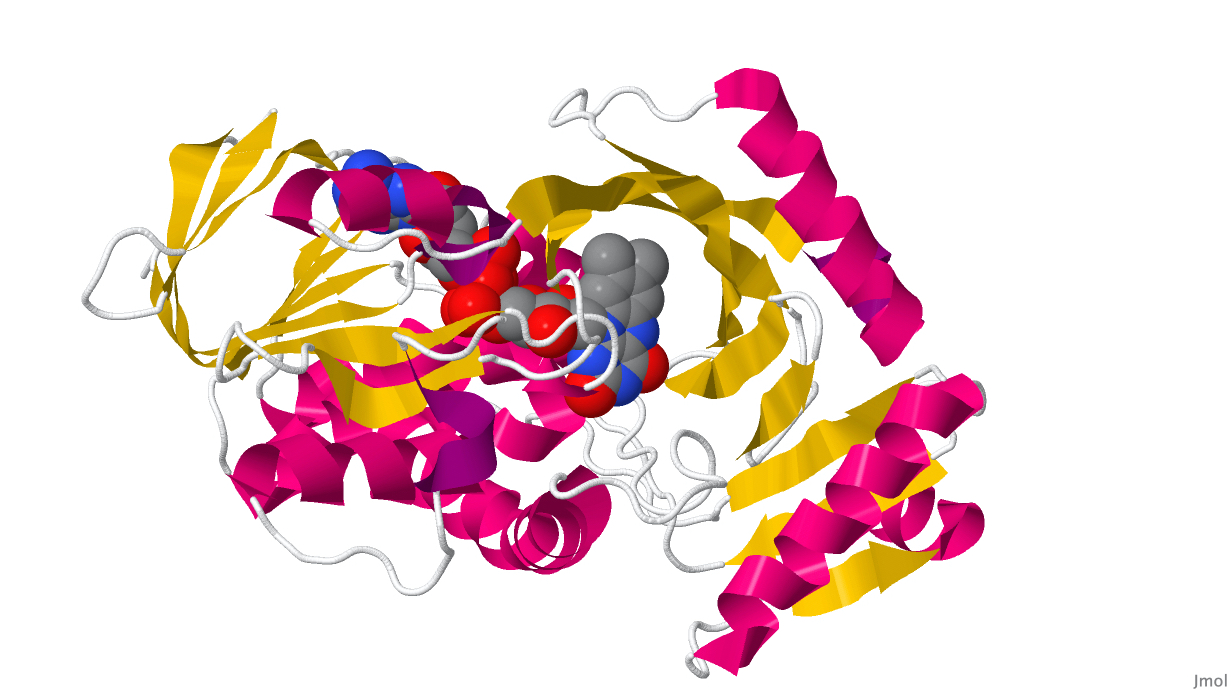
Интересно, что некоторые оксидоредуктазы у прокариот, субстратом которых являются аминокислоты, дают бактериям устойчивость к антибиотикам, например – D-специфичная дегидрогеназа альфа-кетокислот (UniprotID: VANH_ENTFC), выделенная из бактерии Enterococcus faecium. Запрос в расширенном поиске UniProtKB:
NOT mnemonic:GLYOX_GEOKA annotation:(type:function d-alanine) NOT taxonomy:eukaryota keyword:oxidoreductase
(ищет оксидоредкутазы прокариот, связанные с D-аланином, отсекая наш исследуемый белок).
Среди представителей этого семейства бактерий (Bacillaceae) глицин-оксидаза является единственной оксидоредуктазой, участвующей в биосинтезе тиамина, что впрочем не является удивительным. Запрос в расширенном поиске UniProtKB:
NOT mnemonic:GLYOX_GEOKA NOT organism:"geobacillus kaustophilus" keyword:oxidoreductase keyword:"thiamine biosynthesis" taxonomy:bacillaceae
(ищет оксидоредуктазы не из нашей бактерии, но из этого семейства, участвующие в биосинтезе тиамина).
ФАД-зависимые реакции окислительного дезаминирования катализируются оксидоредуктазами (как и все окислительно-восстановительные реакции). За пределами типа Firmicutes встречаются три фермента, катализирующих такие реакции (UniProtID: THIOG_SYNY3, THIOG_NOSS1, THIOG_TRIV2). Запрос в расширенном поиске UniProtKB:
NOT mnemonic:GLYOX_GEOKA keyword:oxidoreductase annotation:(type:function "fad-dependent oxidative deamination") NOT taxonomy:firmicutes
(ищет оксидоредуктазы не из нашей бактерии, катализирующие ФАД-зависимые реакции окислительного дезаминирования).
| Таблица 1. Краткая информация о белке из базы UniprotKB. | ||
| UniProt ID | GLYOX_GEOKA | |
| UniProt AC | Q5L2C2 | |
| Рекомендуемое имя (RecName) | Glycine oxidase | |
| Идентификатор нуклеотидной записи EMBL | BA000043 | |
| Идентификатор PDB | 4YSH | |
| Длина в а.о. (SQ) | 377 | |
| Молекулярная масса в дальтонах | 39913 | |
| 3D-структура | Известна из рентгеноструктурного анализа | |
Для рассмотрения представленности функциональных групп белков в протеомах бактерии Geobacillus kaustophilus и бактерии из того же семейства, являющейся и модельным объктом – Bacillus subtilis, я использовал расширенный поиск в UniProtKB (соответствующие поисковые запросы приведены жирным шрифтом). Из-за различий в размере протеома между этими двумя организмами (3516 белков в протеоме с ID UP000001172, принадлежащем G. kaustophilus и 4260 белков в протеоме с ID UP000001570, принадлежащем B. subtilis) я дополнительно привожу представленность той или иной группы белков в процентах от общего числа белков. Всего я рассмотрел 3 группы белков: ферменты (белки, имеющие код фермента EC), трансмембранные белки и белки, для которых указана зависимость от температуры (и внутри них те, которые термостабильны).
В базе данных UniProtKB представлены 742 трансмембранных белка, принадлежащих протеому G. kaustophilus, что составляет 21,1% от всех белков. Запрос в расширенном поиске UniProtKB:
annotation:(type:transmem) AND organism:"Geobacillus kaustophilus (strain HTA426) [235909]" AND proteome:up000001172
В протеоме B. subtilis представлено 996 трансмембранных белков, что составляет 23,4% от всех белков. Запрос в расширенном поиске UniProtKB:
annotation:(type:transmem) AND organism:"Bacillus subtilis (strain 168) [224308]" AND proteome:up000001570
Видимо, представленность трансмембранных белков не сильно меняется в зависимости от организма: мы можем видеть это и в случае этих двух близких бактерий, и шире. Например, у человека процентное содержание трансмембранных белков в протеоме составляет 27% (Almen et al., 2009).
Ферментами (при поиске – белками, которым присвоен код в международной классификации ферментов EC) в протеоме G. kaustophilus являются 865 белков (24,6% от белков в протеоме). Запрос в расширенном поиске UniProtKB:
ec:* AND organism:"G. kaustophilus (strain HTA426) [235909]" AND proteome:up000001172
В протеоме B. subtilis присутсвуют заметно больше ферментов – 1529 (35,9%). Я думаю, что такая разница обсуловлена большей степенью изученности B. subtilis как очень популярного модельного объекта. Запрос в расширенном поиске UniProtKB:
ec:* AND organism:"Bacillus subtilis (strain 168) [224308]" AND proteome:up000001570
Наиболее интересно, на мой взгляд, рассмотреть присутствие в протеоме исследуемых бактерий температуро-зависимых белков, для которых это специально указано (понятно, что все белки каким-либо образом зависят от температуры), и термостабильных белков. Для G. kaustophilus обнаружена адаптация к высоким температурам (термофильность), но на уровне преобладания некоторых аминокислотных замен по сравнению с мезофильными бактериями (Takami et al., 2004). У B. subtilis обнаружены наоборот – приспособления к переживанию низких температур (эта бактерия обитает в почве) (Beranova et al., 2010). Однако, в записях белков в протеомах этих бактерий нашлось крайне мало указаний на соответствующие характеристики. В целом термозависимых (тип "temperature dependence") белков у G. kaustophilus и B. subtilis нашлось 2 (0,057%) и 50 (1,174%) соответственно. Запросы в расширенном поиске UniProtKB для G. kaustophilus и B. subtilis соответственно:
annotation:(type:"temperature dependence") AND organism:"Geobacillus kaustophilus (strain HTA426) [235909]" AND proteome:up000001172
annotation:(type:"temperature dependence") AND organism:"Bacillus subtilis (strain 168) [224308]" AND proteome:up000001570
Среди этих белков я провёл дополнительный поиск со словом "thermostable", но и он не показал каких-либо осмысленных результатов (1 и 5 белков для G. kaustophilus и B. subtilis соответственно). Возможно, это связано с невозможностью объять все белки всех организмов, из-за чего не во всех записях содержится информация о термостабильности и прочих вспомогательных характеристиках (этот тезис отчасти доказывается по литературным данным присутствием в геноме G. kaustophilus белка – обратной гиразы, которая свойственна термофильным организмам, но этот белок отсутствует в рассмотренном протеоме и в целом в базе при поиске для этого вида бактерий). Запросы в расширенном поиске UniProtKB для G. kaustophilus и B. subtilis соответственно:
annotation:(type:"temperature dependence" thermostable) AND organism:"Geobacillus kaustophilus (strain HTA426) [235909]" AND proteome:up000001172
annotation:(type:"temperature dependence" thermostable) AND organism:"Bacillus subtilis (strain 168) [224308]" AND proteome:up000001570
Перейдём к рассмотрению распространённости нашего белка. Изучаемая глицин-оксидаза представлена в трех кластерах UniProt, сведения о которых приведены в таблице 2. В целом, можно отметить, что в кластер UniRef50 объединяются белки (все отноящиеся к классу оксидоредуктаз) бактерий, входящих в один порядок Bacillales, но не семейство, хотя представители семейства Bacillaceae, к которому относится и G. kaustophilus, преобладают среди хозяинов белков, представленных в кластере. Среди этих белков, как уже было сказано, все относятся к классу оксидоредуктаз, но не все являются глицин-оксидазами, хотя последние преобладают. Отсюда можно сделать вывод, что глицин-редуктазы имеют сходные последовательности и распространены в рамках порядка, то есть достаточно широко. Это кажется вполне логичным, т.к. этот белок не участвует в каких-то специфичных метаболических путях и имеет довольно широкий спектр субстратов (Martinez-Martinez et al., 2007). Список субстратов глицин-оксидазы заметно различается даже между представителями одного семейства – G. kaustophilus и B. subtilis (Job et al., 2001).
| Таблица 2. Информация о кластерах UniProt, в которые входит рассматриваемый белок. | ||
| Идентификатор кластера | Число белков в кластере | Статус последовательности в кластере |
| UniRef100_Q5L2C2 | 10 | seed, representative |
| UniRef90_Q5L2C2 | 34 | seed, representative |
| UniRef50_Q5L2C2 | 88 | representative |