В этом семестре, который неумолимо подходит к концу, мы увлекались не только биоинформатикой, но и другим, не менее интересным предметом - физиологией человека и животных. Этот предмет научил нас думать так, как это делает природа (произвольно, непроизвольно и думает ли вообще - вопрос, более относящийся к проблемам философии - мы же прагматичны и пытаемся просто охарактеризовать эту сложную систему). Проишествие, приведшее меня к знаменательному выбору трансмембранного белка, имело место на зачете по этому чудесному предмету (старые добрые традиции написания цепляющего вступления, являющегося предзнаменованием начала хорошего повествования, но вопрос, придерживаюсь ли я их?). Поначалу наше приключение представляло из себя не что иное, как ленивую прогулку по родным окраинам дорогого тебе города. Каково было удивление бредущего, когда он зашел слишком далеко - далеко от своего поля знания и погрузился в запутанные лабиринты неизведанных вопросов, на которое путешественнику нужно было найти все ответы (для получения своего зачета)! А ведь именно такие поиски, такие риски по-настоящему западают в сердце искателя.
Поэтому, в продолжение нашего непрестанного постижения механизмов и законов функционирования нашего огромного мира, чьи загадки кроются в мелочах, которые, как это бывает, даже самый пристальный взгляд не углядит, я выбрал белок Kv1.2 (Potassium voltage-gated channel subfamily A member 2) (K+ потенциалчувствительный ионный канал).
Калиевые каналы — одни из самых сложных потенциалзависимых ионных каналов. Количество из функций велико: регуляция выброса нейромедиаторов, ритм биения сердечной мышцы, регулирование возбудимости нейронов, сокращение мускулатуры, регуляция клеточного объема... Они контролируют быстрый селективный ток К+ во время потенциала действия и пассивный ток К+ для восстановления потенциала покоя.
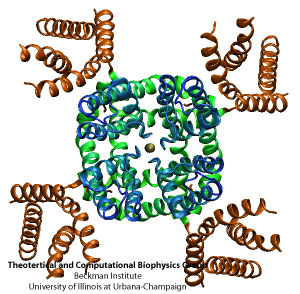
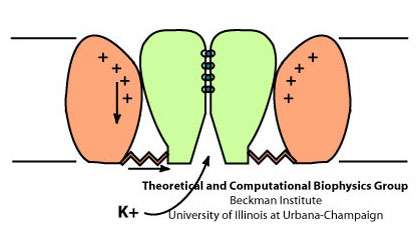
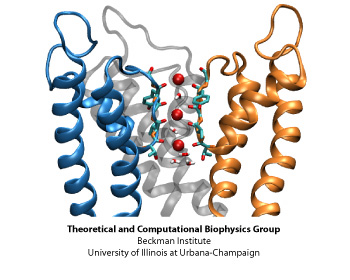
Структура Kv каналов тетрамерна (рисунок 1) и каждый мономер состоит из двух структурно и функционально независимых доменов: порового домена проводимости ионов и потенциалчувствительного домена (рисунок 2). Сенсорные домены расположены на переферии белка и содержат 4 трансмембранных сегмента (S1-S4). В S4 сегменте на каждой третей аминокислотной позиции расположен положительно заряженный остаток (это обеспечивает чувствительность к изменению потенциала). Селективной частью порового домена является последовательность TVGYG (рисунок 3), высоко консервативная среди различных видов. Путь для иона выстлан атомами кислорода остатков.

Для начала была взята последовательность P63142 (KCNA2_RAT) и проведен анализ в TMHMM. Выдача:
# sp|P63142|KCNA2_RAT Length: 499 # sp|P63142|KCNA2_RAT Number of predicted TMHs: 5 # sp|P63142|KCNA2_RAT Exp number of AAs in TMHs: 131.45368 # sp|P63142|KCNA2_RAT Exp number, first 60 AAs: 0 # sp|P63142|KCNA2_RAT Total prob of N-in: 0.70924 sp|P63142|KCNA2_RAT TMHMM2.0 outside 1 159 sp|P63142|KCNA2_RAT TMHMM2.0 TMhelix 160 182 sp|P63142|KCNA2_RAT TMHMM2.0 inside 183 221 sp|P63142|KCNA2_RAT TMHMM2.0 TMhelix 222 244 sp|P63142|KCNA2_RAT TMHMM2.0 outside 245 247 sp|P63142|KCNA2_RAT TMHMM2.0 TMhelix 248 270 sp|P63142|KCNA2_RAT TMHMM2.0 inside 271 327 sp|P63142|KCNA2_RAT TMHMM2.0 TMhelix 328 350 sp|P63142|KCNA2_RAT TMHMM2.0 outside 351 388 sp|P63142|KCNA2_RAT TMHMM2.0 TMhelix 389 411 sp|P63142|KCNA2_RAT TMHMM2.0 inside 412 499
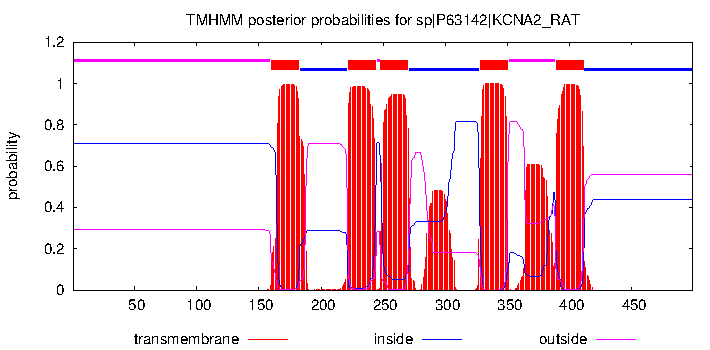
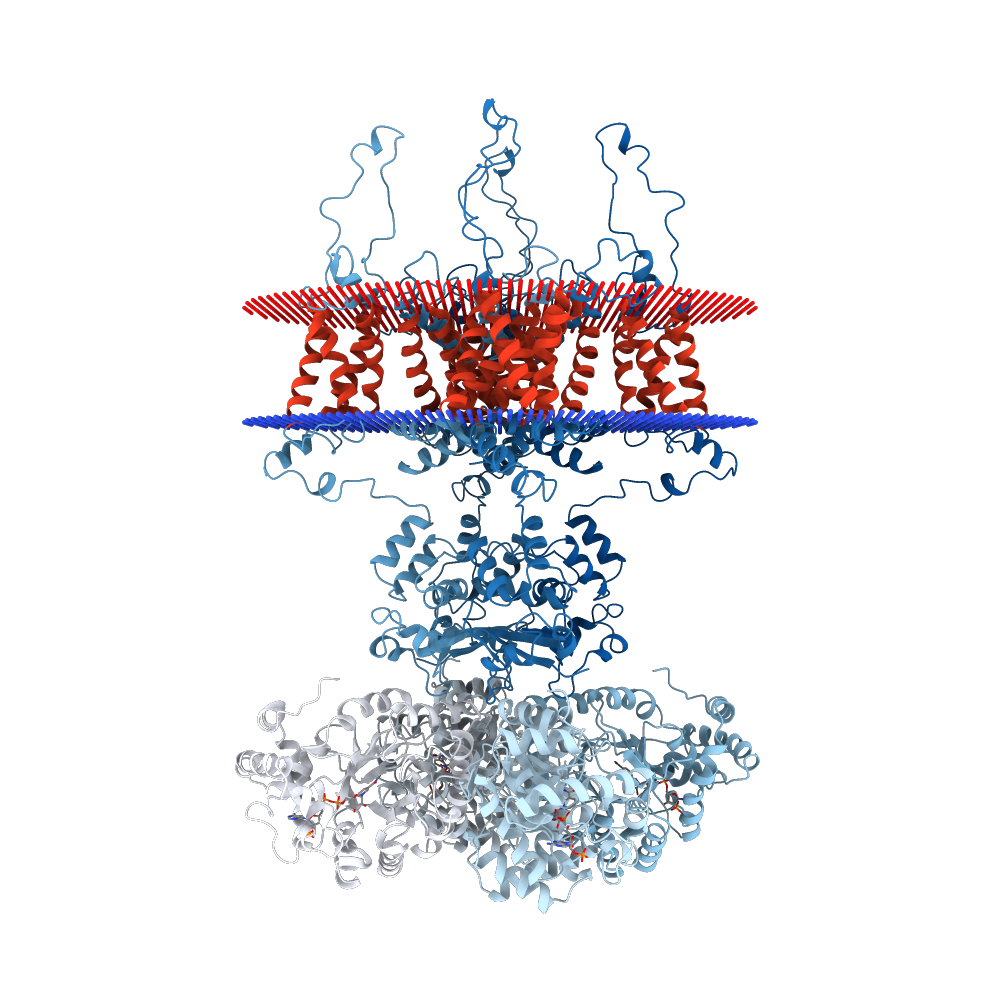

Можно сказать, что результат выдачи TMHMM соответствует наблюдениям. Но мне кажется, что программа перепутала внутренний и внешний регионы (т. е. развернула перпендикулярную к мембране ось белка на 180 градусов). Также возможно, что alpha helix на конце должна быть внутри клетки.
Вернуться на страницу семестра