Семестр 7, автор – Грызунов Никита (nikit00000s)
Практикум 1. Pymol
Введение
Центральная нервная система (ЦНС) млекопитающих имеет сложное устройство на многих уровнях организации живой материи: на тканевом, клеточном и, наконец, на молекулярном. Одним из свойств такой сложной системы, состоящей из огромного количества компонентов, является ее изменчивость в ответ на совокупность тех или иных раздражителей, запоминание [1].
Синаптическая пластичность может регулироваться на пресинаптической мембране, варьируя количество выпущенного нейромедиатора, либо на постсинаптической мембране, изменяя количество и свойства рецепторных белков мембраны. Последний путь, как было показано, является основным механизмом, стоящим за синаптической пластичностью [1, 2].
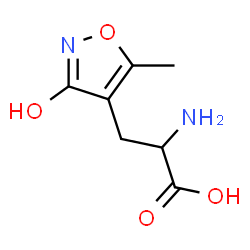
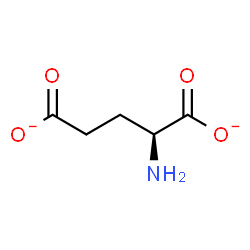
Рецепторы AMPA (рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты, иначе - AMPAR), принадлежащие молекулярному уровню организации ЦНС, также имеют сложные организацию и функционирование. Основным биологическим агонистом этого рецептора является глутамат (рис 1).
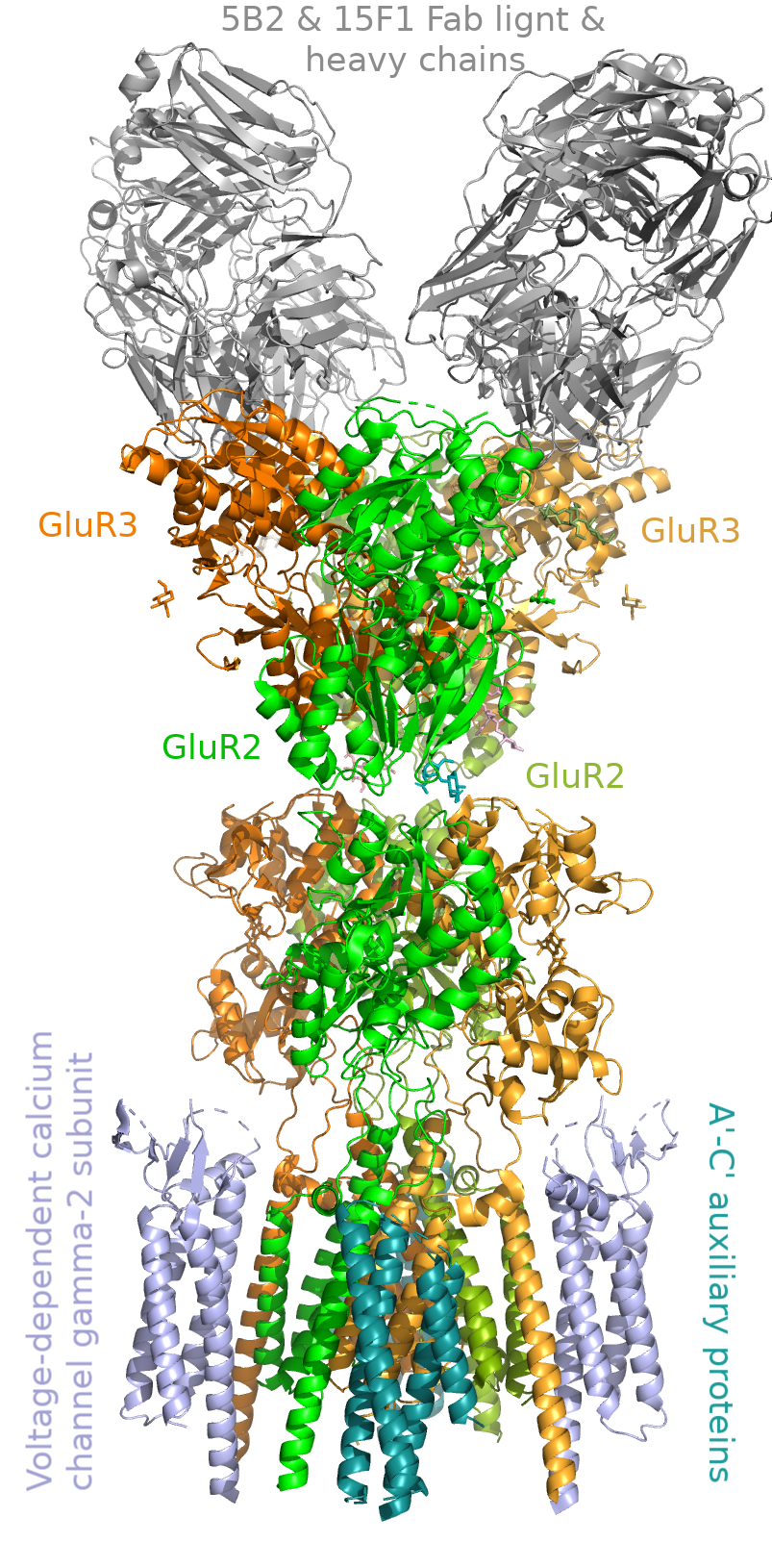
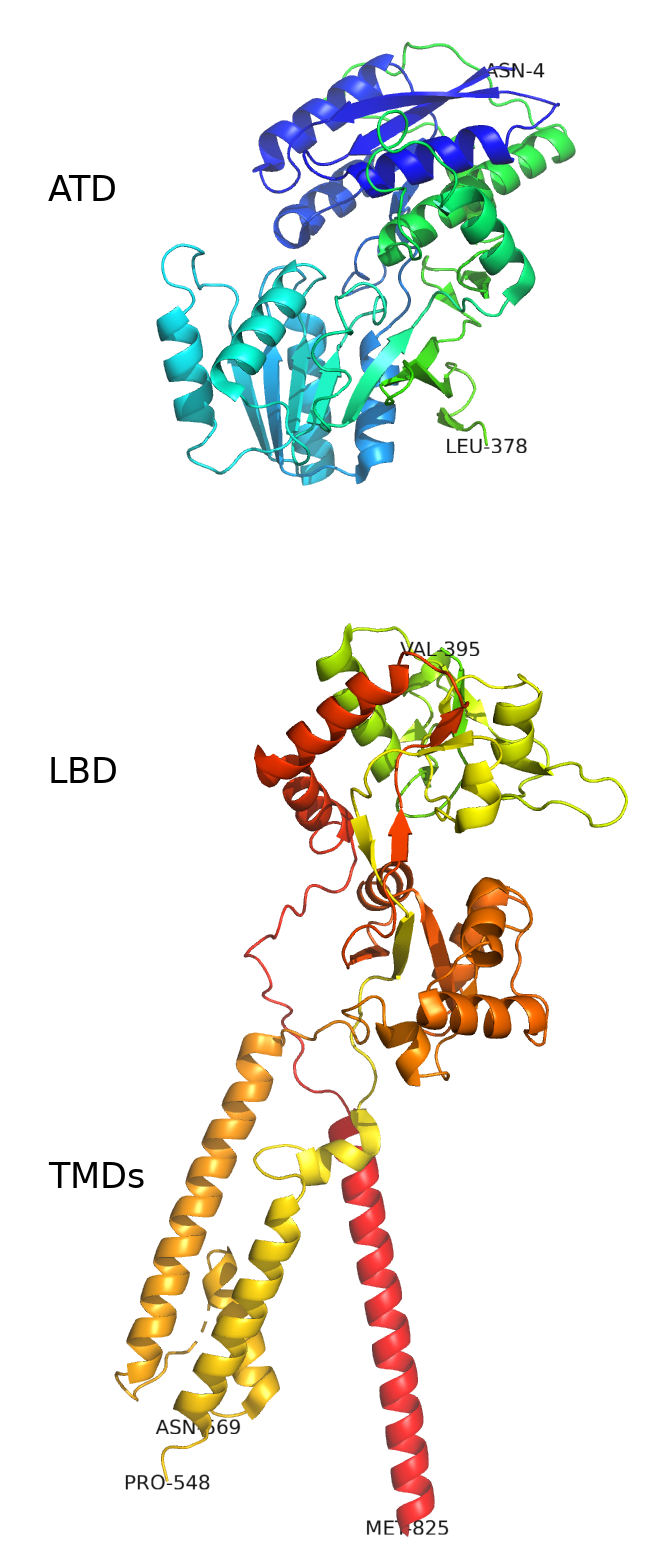
AMPAR является одним из главных участников быстрой синаптической передачи у млекопитающих и вовлечены в процесс синаптической пластичности. Этот рецептор является тетрамером (рис. 2), представленным из различных комбинаций четырех субъединиц: GluR1, GluR2, GluR3, GluR4. У всех четырех субъединиц имеются большой внеклеточный N-концевой домен, лиганд-связывающий домен, внутриклеточный C-концевой домен, а также 4 гидрофобных домена (M1-4), ассоциированных с мембраной. Кроме того, с AMPAR взаимодействуют некоторые регуляторные белки [3, 4].
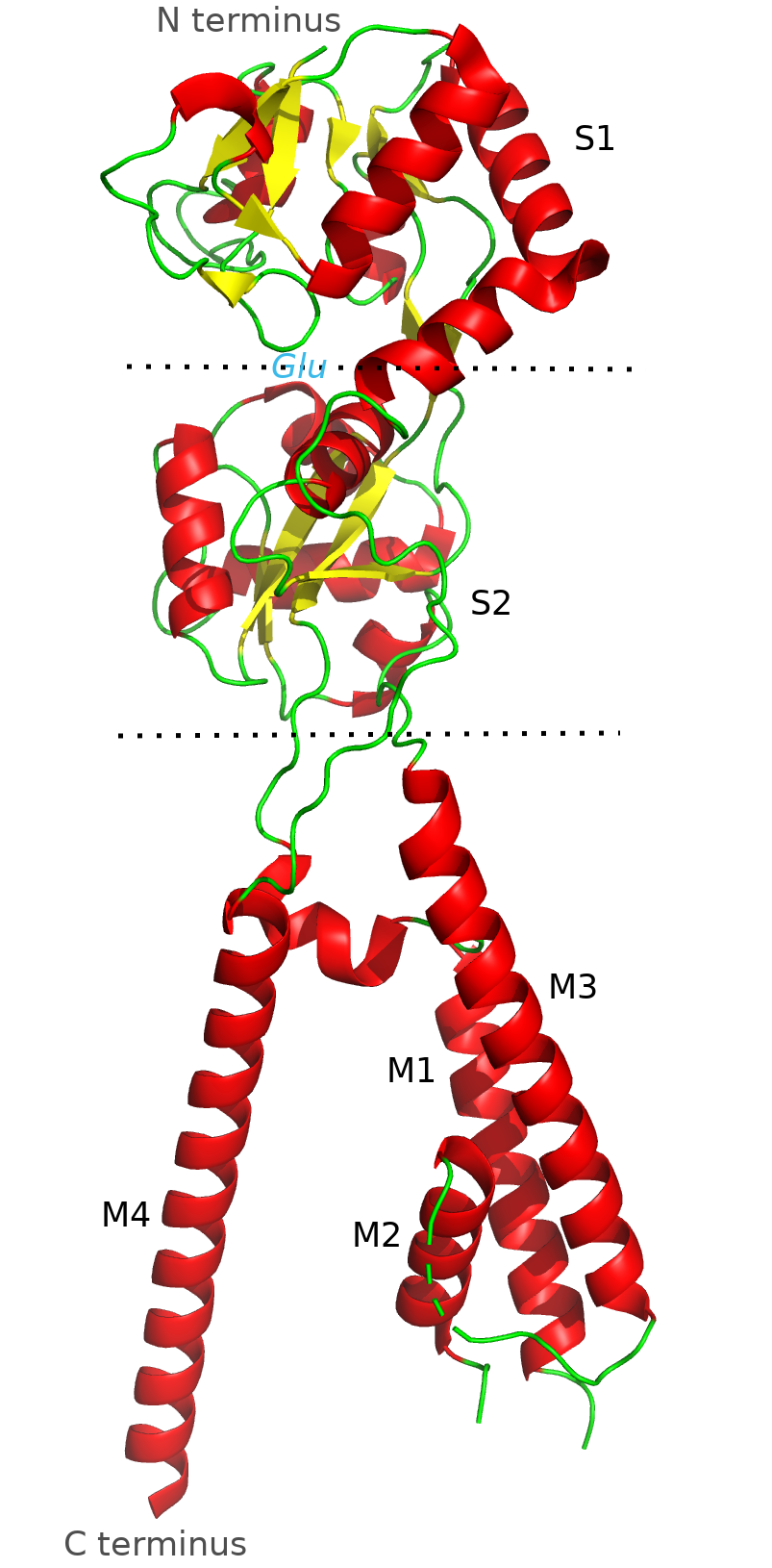
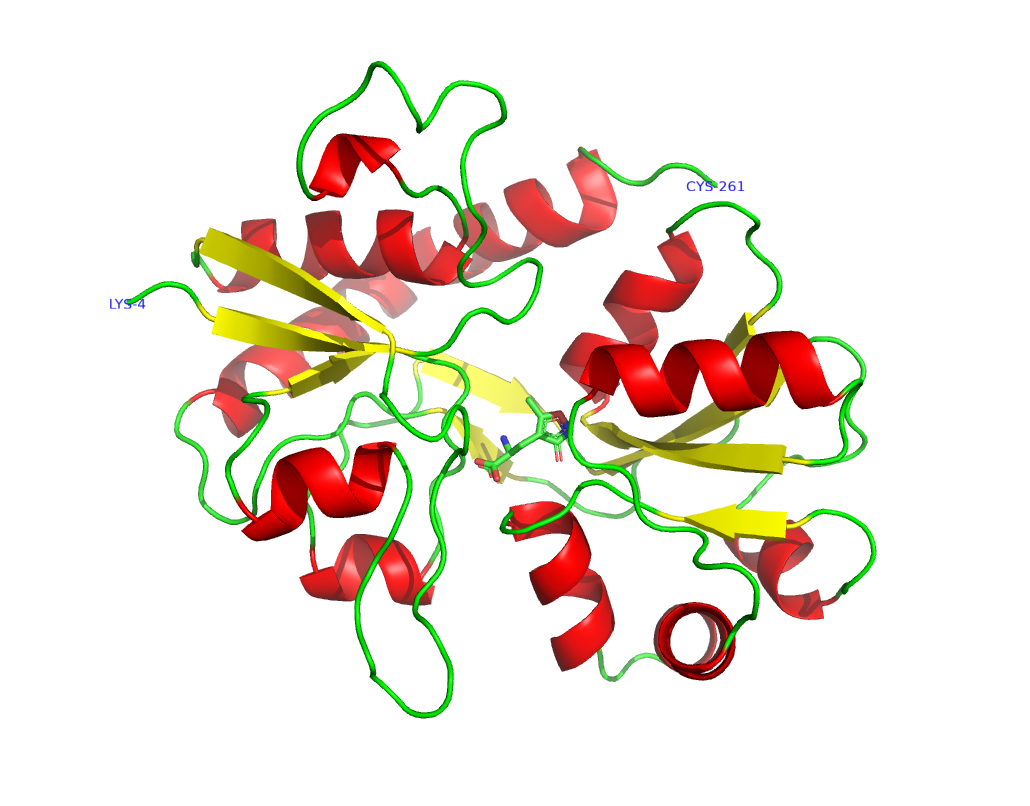
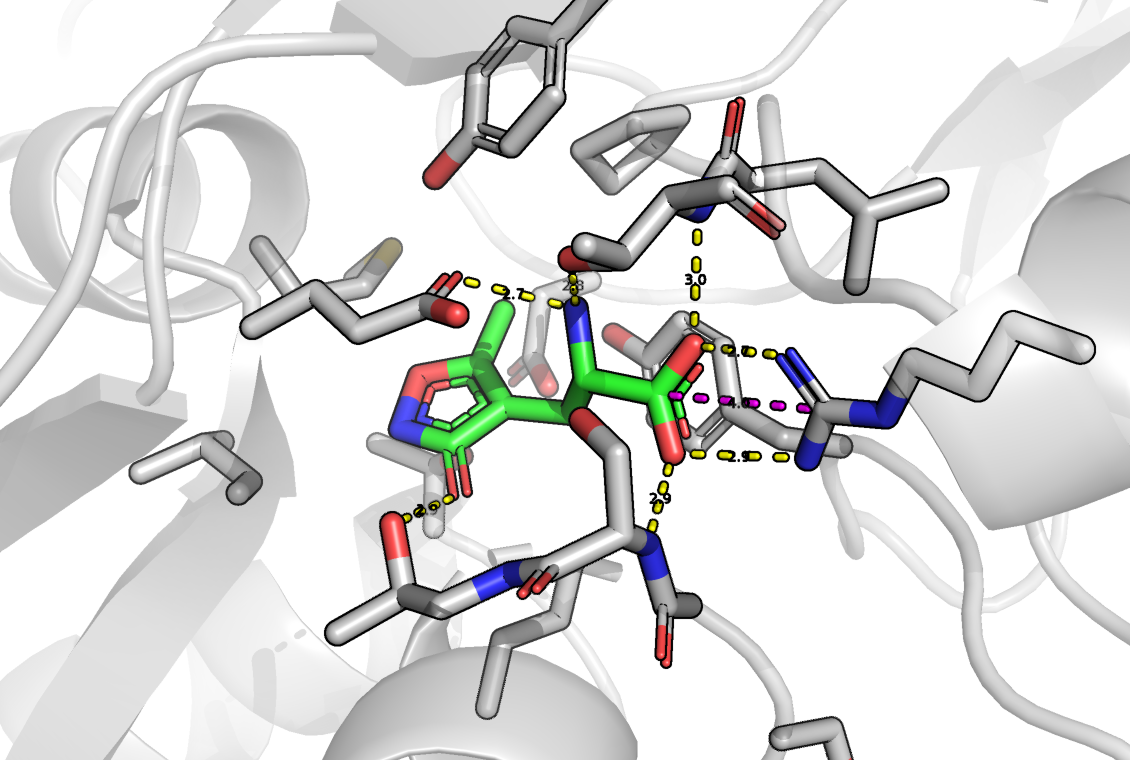
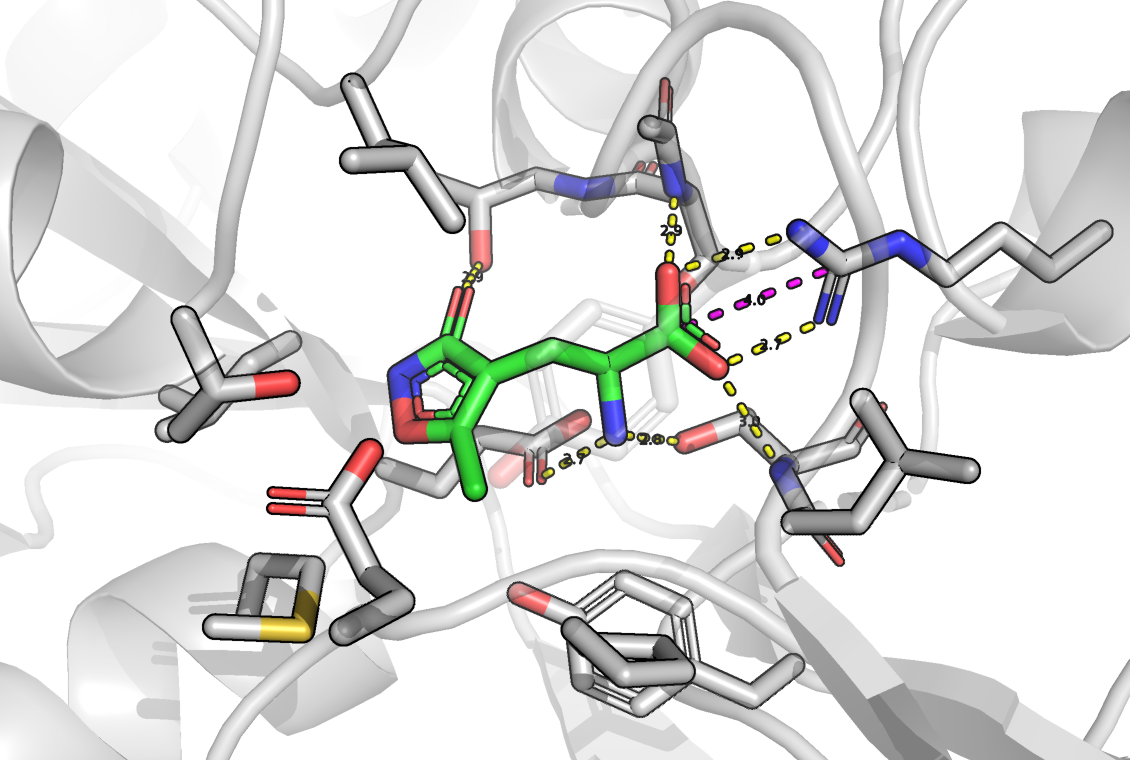
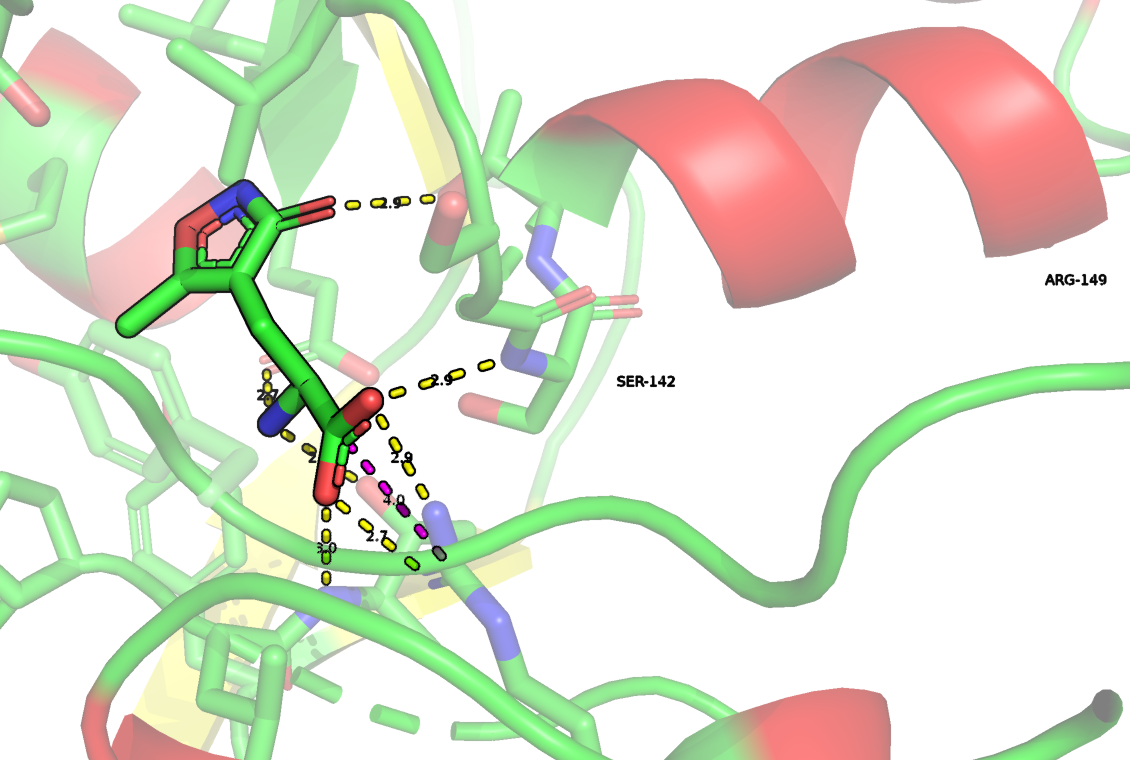
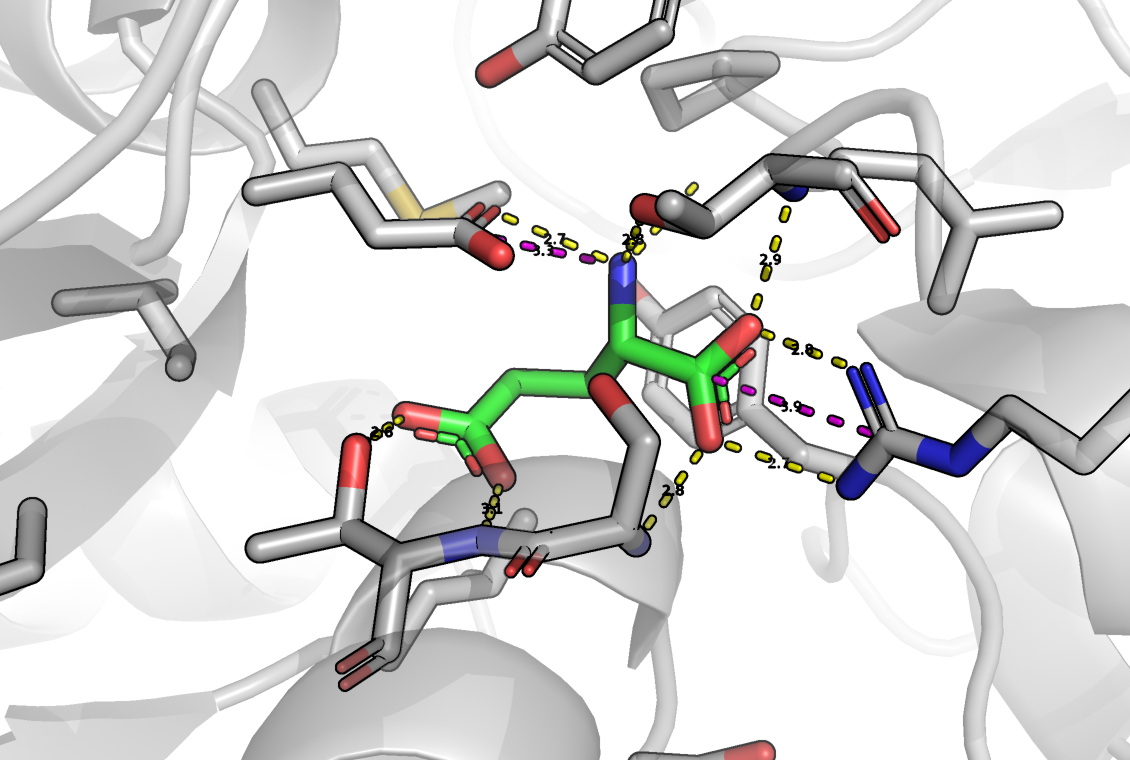
Я предполагаю, что аминогруппа AMPA является в большей степени протонированной, чем нет, так как при 25 градусах Цельсия pKa аминогруппы заключена между 9 и 11. Кроме того эта молекула очень похожа на глутамат (отличаются, только радикалы), а аминогруппа глутамата при физиологических условиях больше протонирована. Кроме того, AMPA в таком случае будет являться цвиттер-ионом, что будет дополнительно стабилизировать данное состояние.
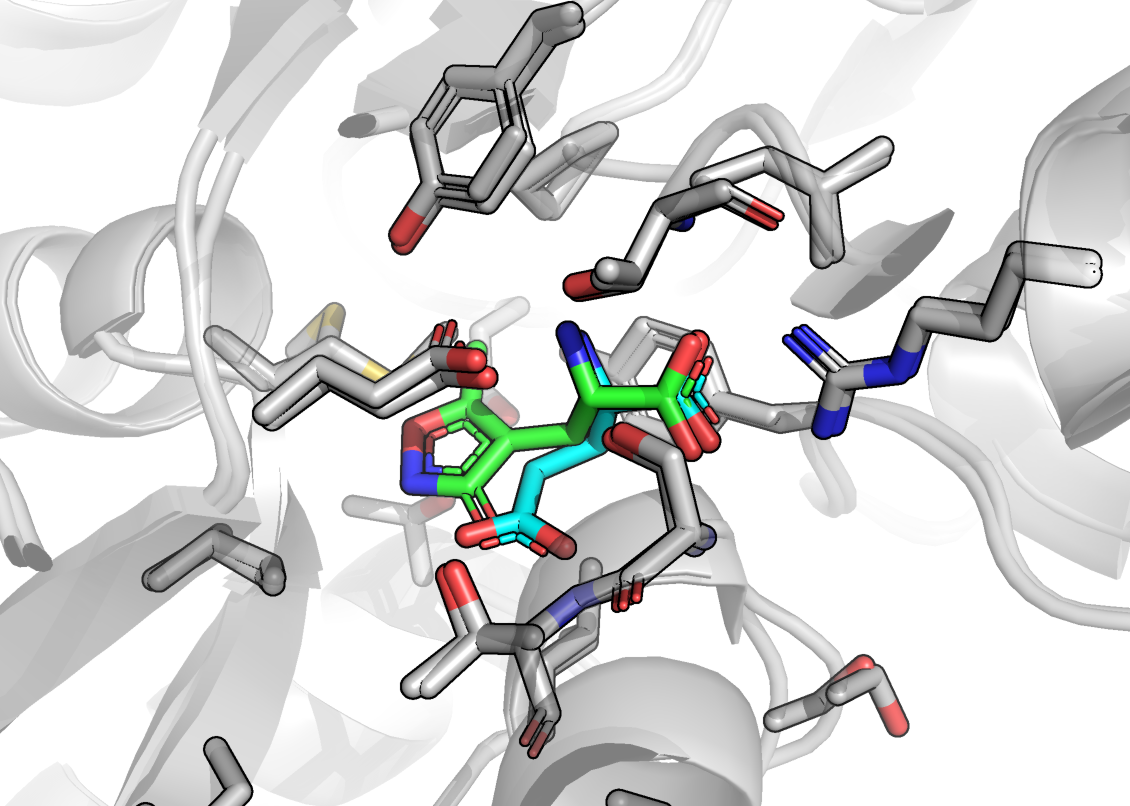
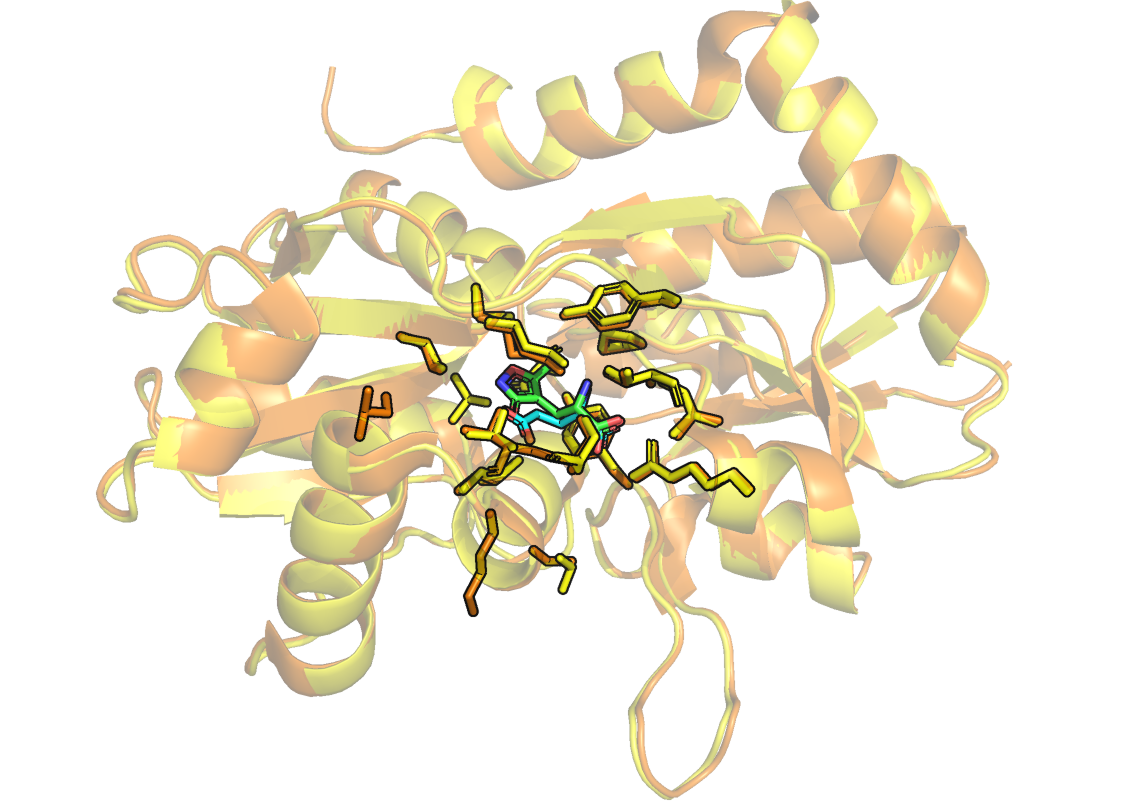
UPD: AMPAR с глутаматом
Список литературы
-
Helmut W. Kessels, Roberto Malinow.
(2009)
Synaptic AMPA Receptor Plasticity and Behavior.
Neuron, 61(3), 340-350 -
Richard L. Huganir, Roger A. Nicoll.
(2013)
AMPARs and Synaptic Plasticity: The Last 25 Years.
Neuron, 80(3), 704-717 -
John T.R. Isaac, Michael C. Ashby, Chris J. McBain.
(2007)
The Role of the GluR2 Subunit in AMPA Receptor Function and Synaptic Plasticity.
Neuron, 54(6), 859-871 -
Wright Amanda, Vissel Bryce.
(2012)
The essential role of AMPA receptor GluR2 subunit RNA editing in the normal and diseased brain.
Frontiers in Molecular Neuroscience, 5