Практикум 1
Задание 1
Мне были даны два PDB ID, 3K34 и 6Q9T, принадлежащие одному белку — человеческой карбангидразе. Карбангидраза — это фермент, катализирующий гидратацию углекислого газа и его превращение в угольную кислоту, а также обратную реакцию. Нестабильная угольная кислота позже разлагается на бикарбонат-ион и протон.
Таким образом, этот фермент регулирует pH крови, закисление крови же снижает связывание кислорода гемоглобином.
На рис. 1 и 2 можно видеть исследуемые структуры, в которых из кофакторов я оставила только ионы цинка. Видно, что в общих чертах структуры похожи. В структуре 6Q9T отсутствует петля (рис. 1, правый верхний угол), причем там нет именно соответствующих аминокислотных остатков (цепь обрывается и возобновляется). У обеих исследуемых структур не разрешена структура для их N-конца, но у 3K34 не хватает двух первых остатков, а у 6Q9T — первых 10. Это можно видеть в правых нижних углах обоих изображений.
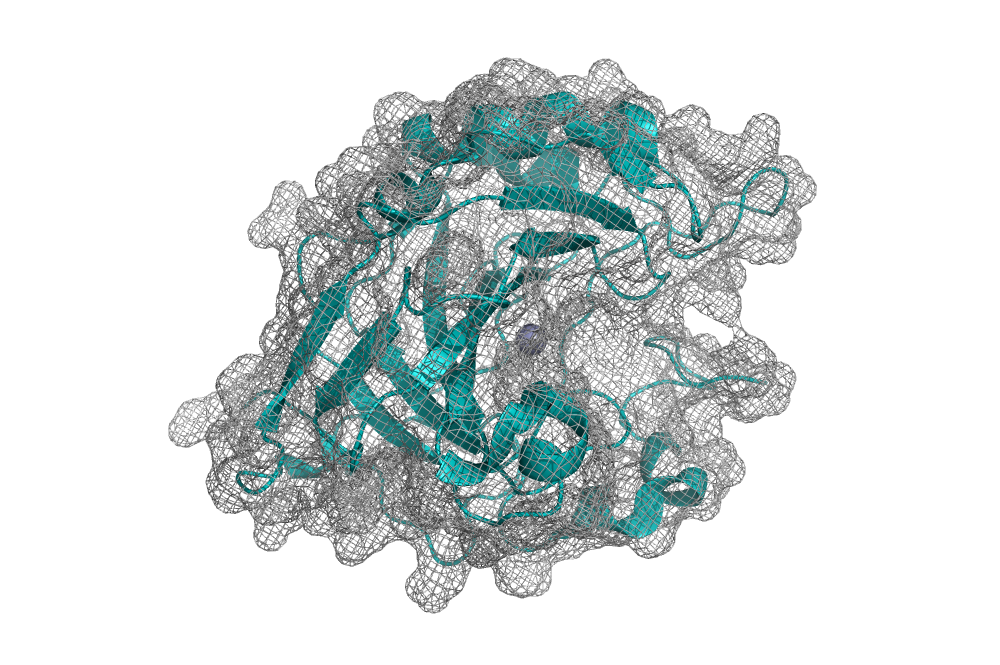
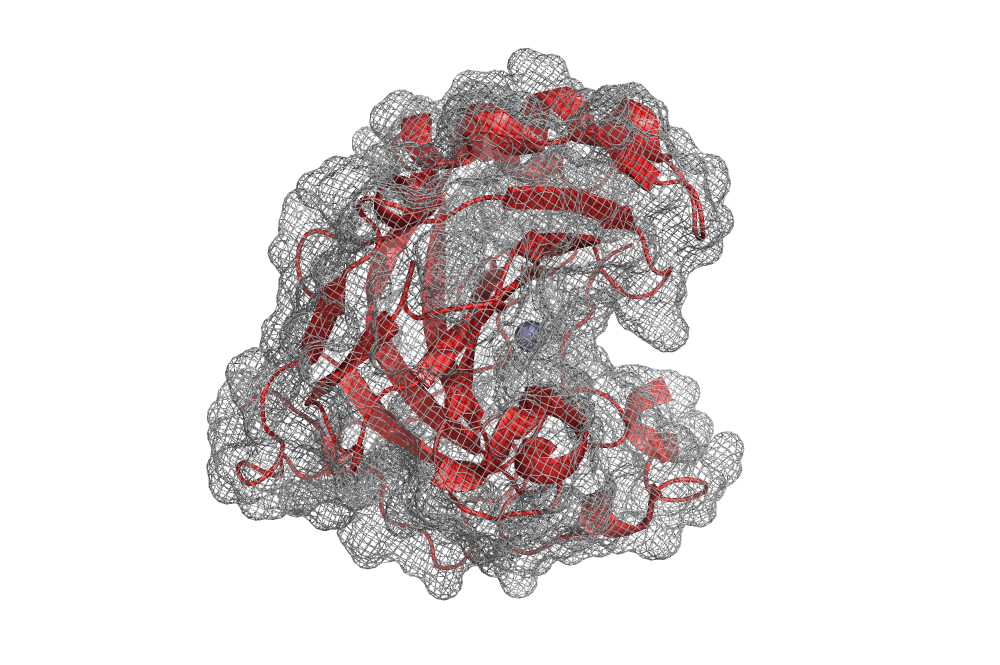
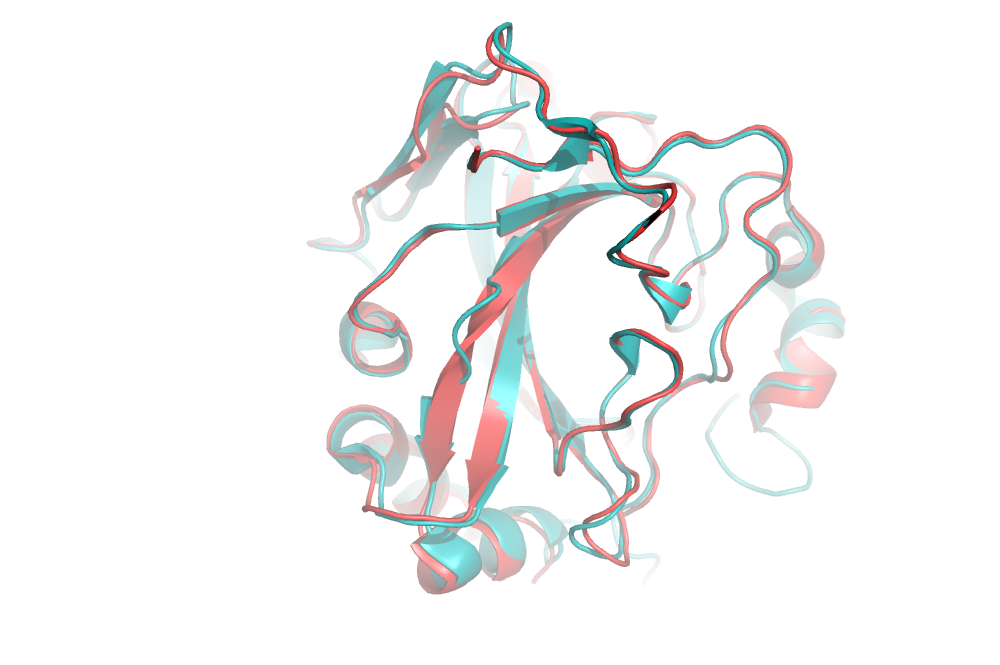
Это не единственное, чем отличаются две структуры. На выравнивании на рис. 3 видно, что в структуре 6Q9T цепь внутри β-листа разворачивается на 180° (так вообще может быть?...). В структуре 3K34 этот учаток просто «выпетливается» из β-листа.
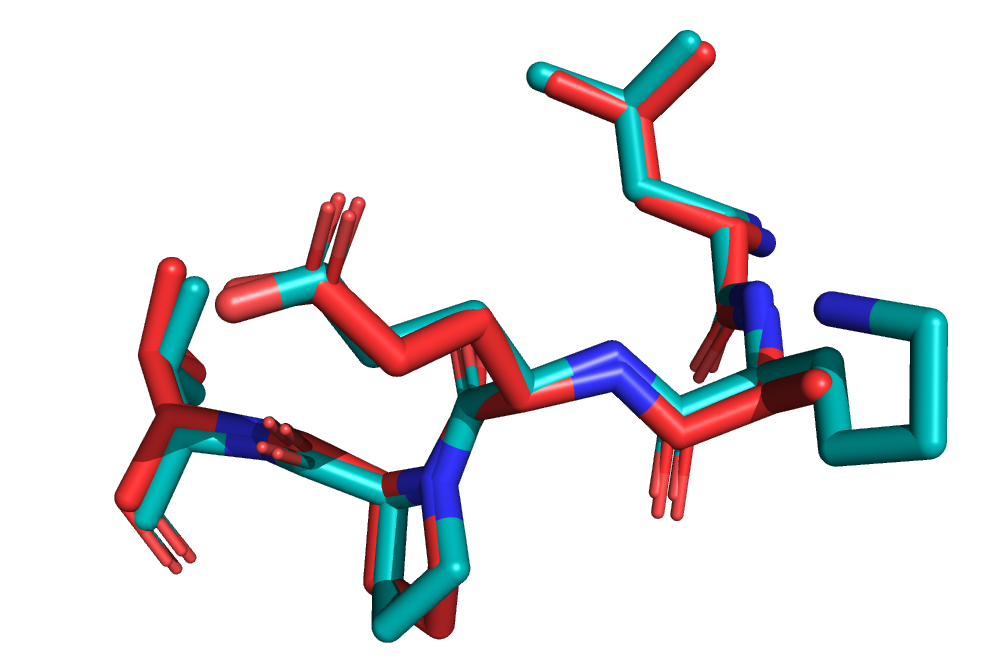
Давайте посмотрим на этот участок внимательнее, сначала на совпадение предсказанных структур, после и на электронную плотность.
На рис. 4 можно видеть, что полученные структуры в общих чертах совпадают, «на глаз» практически все углы совпадают, только гистидин повернут немного по-другому.
Еще одно отличие этих структур — отсутствие четырех атомов у лизина в 6Q9T.
Посмотрим на электронную плотность остовов этих структур в том же фрагменте. На рис. 5 и 6 можно видеть электронные плотности для структур 3K34 и 6Q9T с уровнем подрезки 2 и carve=1.5.
Видно, что разрешение электронной плотности у двух структур сильно разное. На том же уровне подрезки для структуры 3K34 практически все атомы выглядят как шарики Электронная плотность 6Q9T лежит вокруг остова, но разделение на атомы в ней только угадывается.
В общем, мы увидели, что структура 6Q9T сильно хуже, чем 3K34. Сравним с данными из PDB (табл. 1).
| Признак | 3K34 | 6Q9T |
|---|---|---|
| Разрешение, Å | 0,9 | 2,68 |
| R-value (free, depositor) | 0,16 | 0,26 |
| Clashscore | 14 | 5 |
| Ramachandran outliers | 0 | 0 |
| Sidechain outliers | 4,5% | 0 |
| RSRZ outliers | 2,3% | 1,3% |
Видим, что у 3K34 действительно выше разрешение. Также у него меньше R-value (free), рассчитанный depositor. По каким-то причинам рассчитанное DCC R-value не приведено. К сожалению, у этой структуры есть недостатки — относительно высокий clashscore и более высокие значения sidechain & RSRZ outliers.
Задание 2
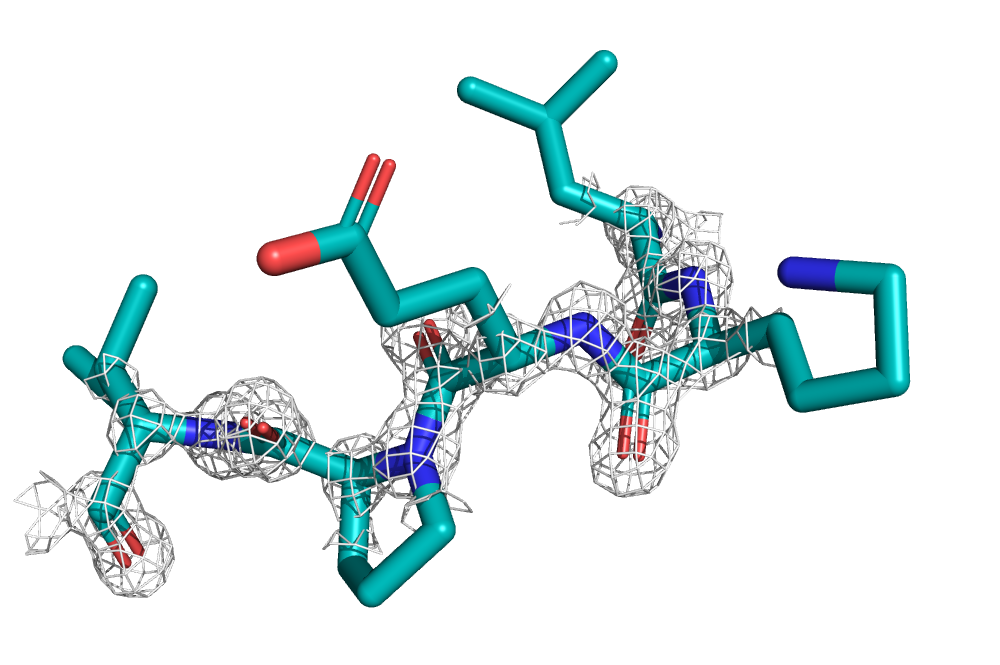
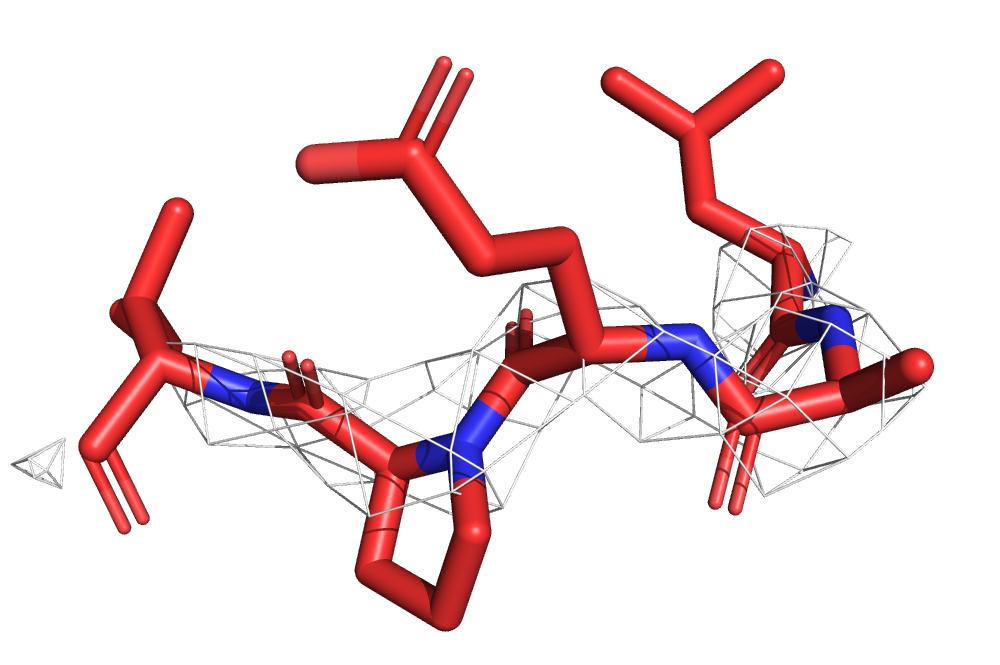
Мне был дан PDB ID 2PIU, принадлежащий лиганд-связывающему домену человеческого андрогенного рецептора. На рис. 7 можно видеть структуру остова этого белка, а также электронная плотность, вычисленная с carve=1.5 и уровнями подрезки 1, 2 и 3.
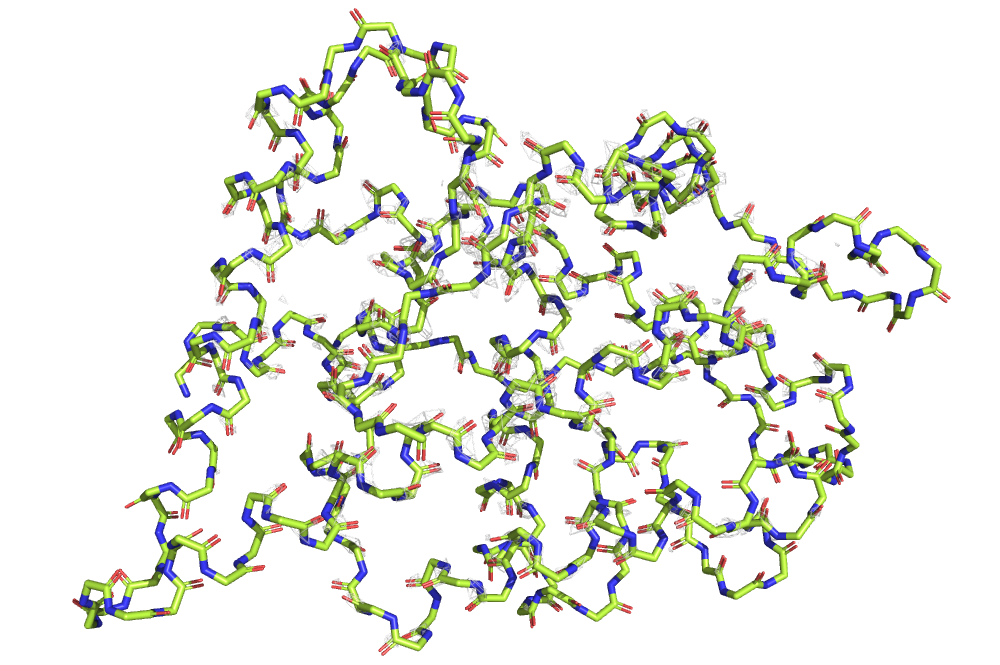
Можно видеть, как с увеличением уровня подрезки электронная плотность исчезает в первую очередь с петель, выступающих из белка, а на элементах вторичной структуры (в данном случае только на α-спиралях), напротив, остается дольше всего.
Дольше всего электронная плотность остается на атомах кислорода и азота, видимо, поскольку они более электроотрицательны.
Задание 3
В этом и следующем задании я работала с PDB ID 7BE3, структурой человеческого галектина-3, белка, связывающего β-галактозиды. В этой структуре он связан с LacdiNAc — дисахаридом GalNAcβ1→4GlcNAc.
Моей задачей было изучить два альтернативных положения остатка аргинина под номером 144, показать, что их стабилизирует и сделать выводы об их стабильности.
На рис. 8 можно видеть исследуемые положения и предположительные водородные связи, которые их стабилизируют.
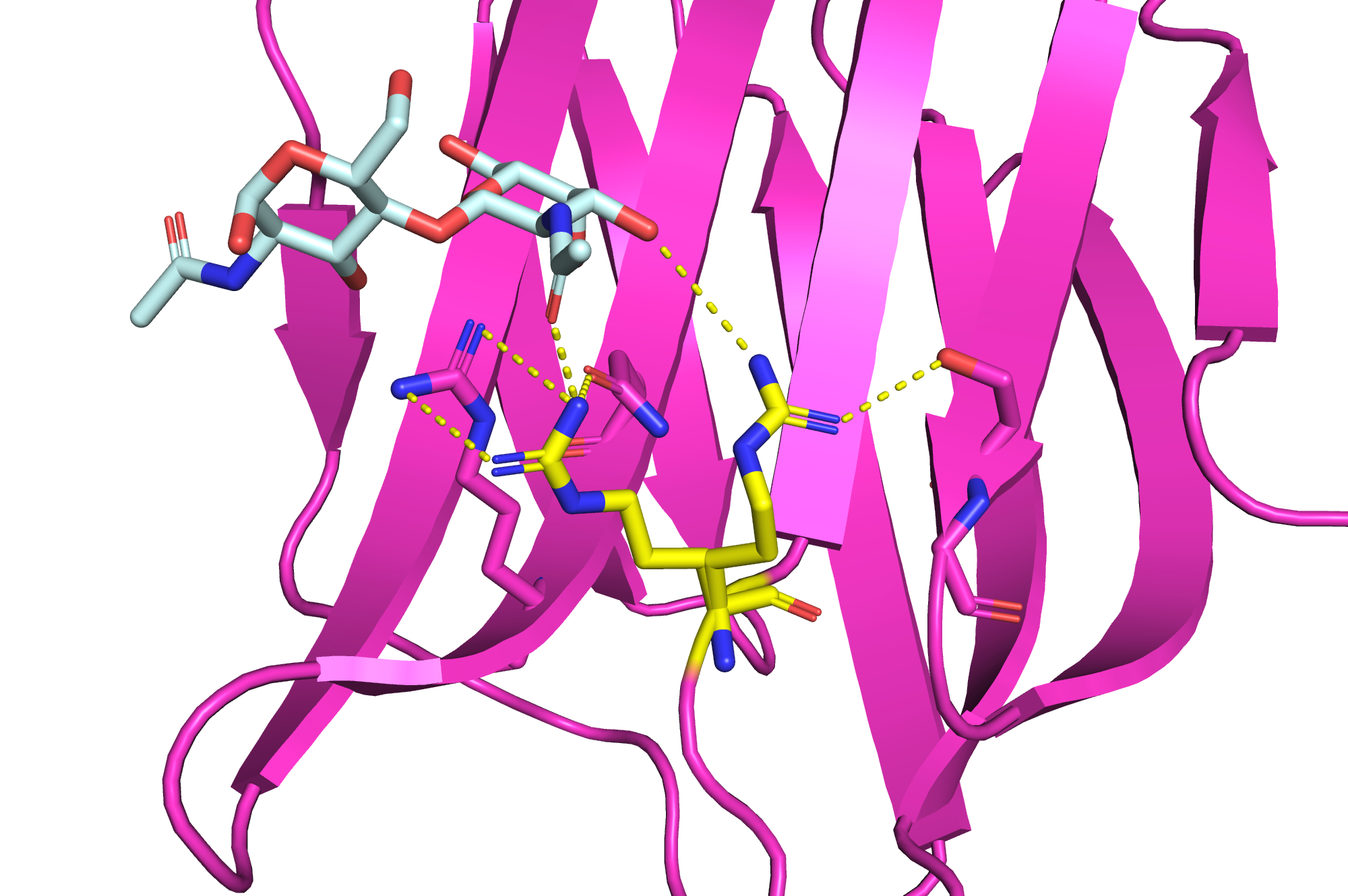
Я предполагаю, что исследуемый остаток не заряжен, по крайней мере когда он находится в положении A, поскольку он находится недалеко от другого аргинина (3,9 Å). Я предполагаю, что эти два аргинина могут образовывать две водородные связи. Также я полагаю, что в положении A исследуемый остаток может образовывать водородные связи с остатком аспарагина и с лигандом (как показано на рис. 8).
В положении B же у остатка гораздо меньше опций: только лиганд и один остаток серина. Из этого я сделала вывод, что положение A должно быть стабильнее.
И действительно, заселенность у остатка в положении A равна 0,56, а в положении B — 0,44. Разница есть, хотя она и небольшая.
Задание 4
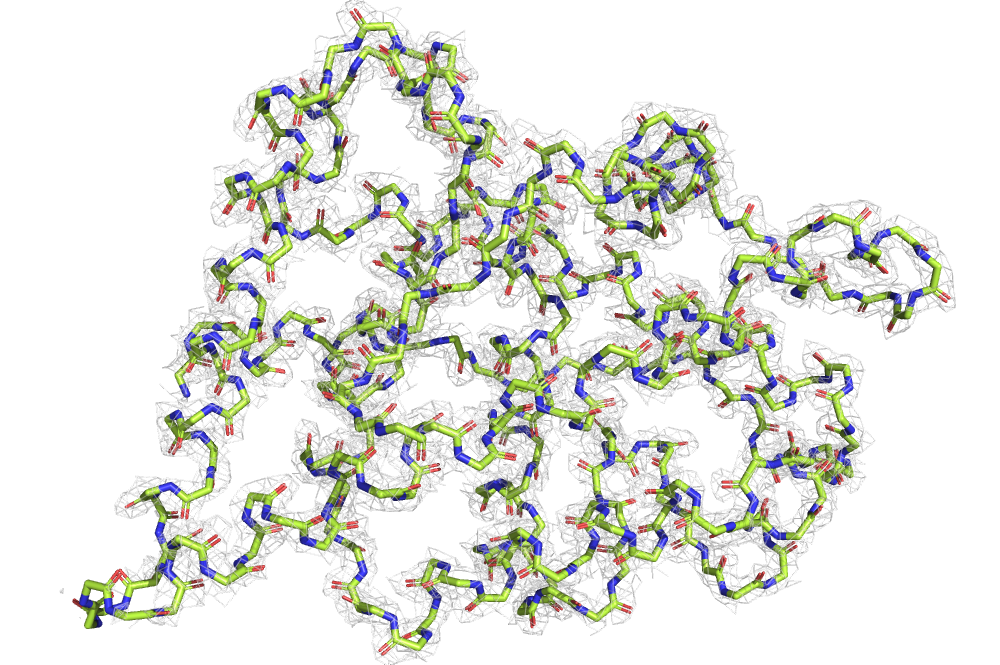
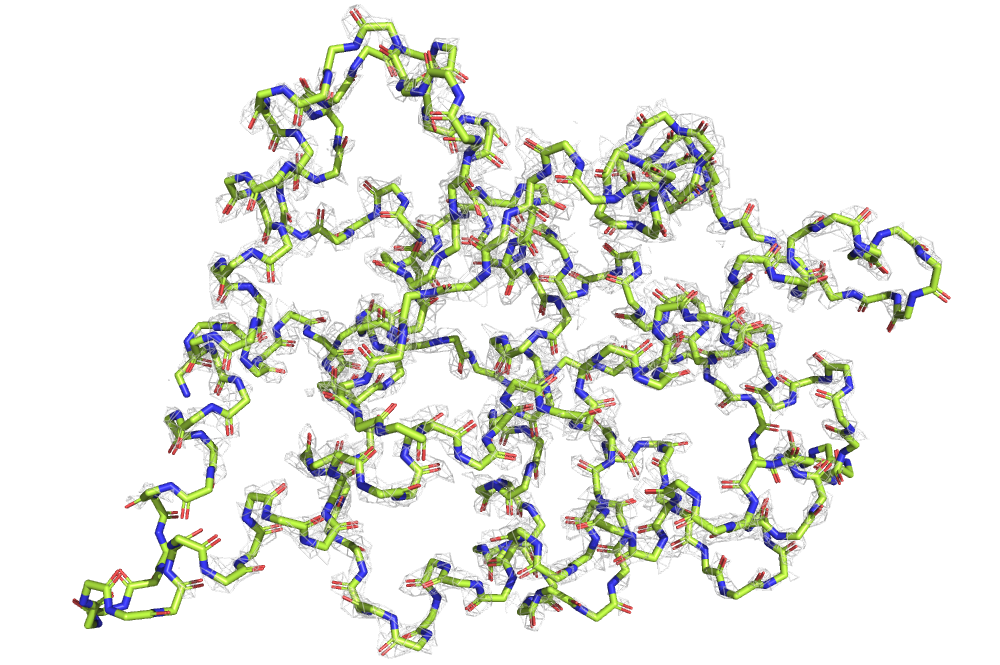
В этом задании я продолжила работать со структурой 7BE3. На рис. 9 и 10 можно видеть его остов и его структуру целиком, раскращенные в зависимости от B-фактора. Можно видеть, что обе структуры имеют более высокий B-фактор по краям. Видимо, размытая электронная плотность в данном случае означает неопределенность положения каких-либо атомов в кристалле, т. е. свободно «болтающуюся» структуру.
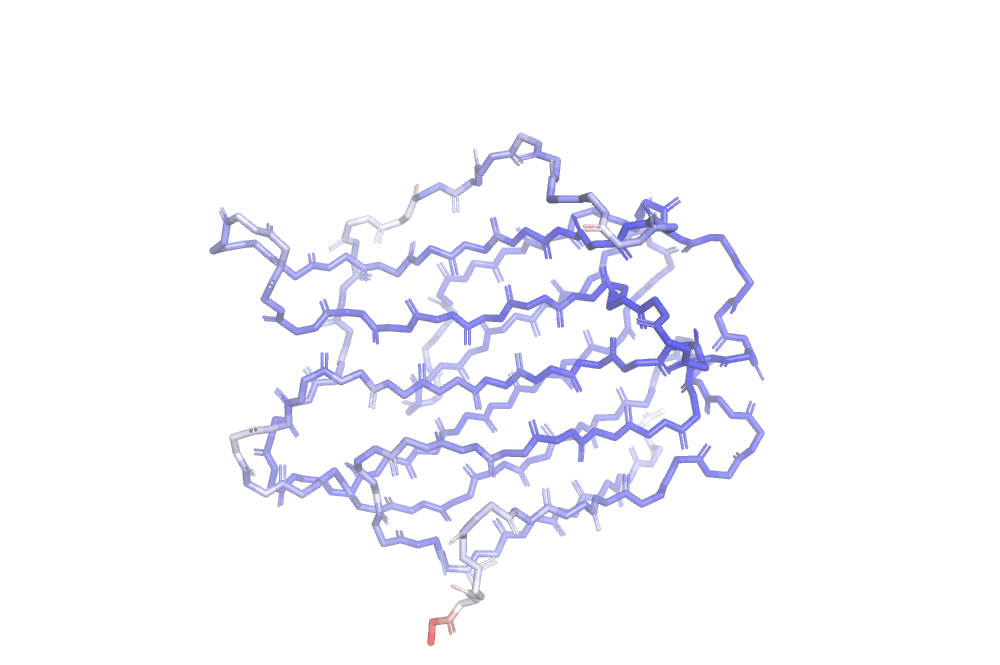
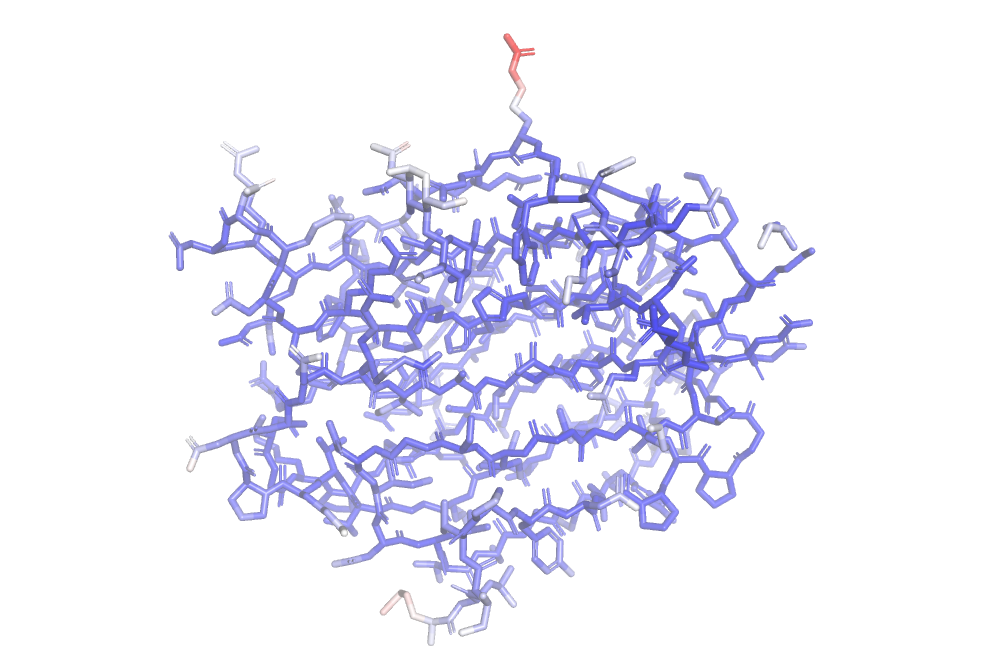
В этом задании я продолжила работать со структурой 7BE3. На рис. 9 и 10 можно видеть его остов и его структуру целиком, раскращенные в зависимости от B-фактора. Можно видеть, что обе структуры имеют более высокий B-фактор по краям. Видимо, размытая электронная плотность в данном случае означает неопределенность положения каких-либо атомов в кристалле, т. е. свободно «болтающуюся» структуру.
Посмотрим внимательнее на остаток аргинина, который высовывается из структуры белка сверху на рис. 10. Его электронная плотность показана на рис. 11 (уровень подрезки 1).
Видно, что чем выше у атома B-фактор, тем меньше на нем электронной плотности. Это происходит, видимо, потому, что с увеличением B-фактора электронная плотность размазывается, и z-score в 1 и более уже не достигается.
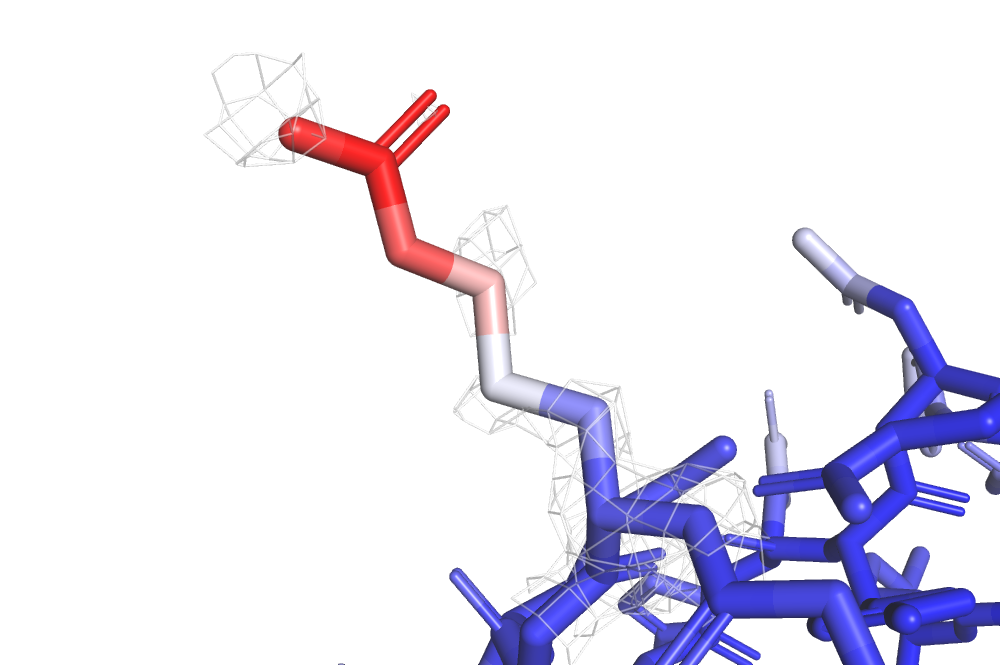
Мы видим «пятно» электронной плотности вокруг одного из азотов на конце этого аргинина, видимо, поскольку в кристалле он протонирован и оттягивает на себя электронную плотность.