
В файле pdb для 4J3C нашли характеристики в поле CRYST1:
CRYST1 96.085 152.082 38.995 90.00 90.00 90.00 P 21 21 2 8
Первые три числа - длины направляющих векторов кристалла (в ангстремах), потом - углы между ними (все три прямые), кристаллографическая группа (P 21 21 2) и число молекул в ячейке (8).
Восстанавливали содержимое ячейки из PDB файла и ряда соседних ячеек.
Для восстановления соседних образов ассиметрической единицы в PyMOL служит команда symexp. Чтобы отобразить для 4J3C все образы, находящиеся не далее чем на 5 Å от молекулы, выполнили команду:
symexp sym, 4J3C, 4J3C, 5,
где sym - "префикс", с него будут начинаться названия новых объектов, созданных командой, затем имя объекта, для которого строятся образы асимметрической единицы, третий аргумент – множество атомов, в окрестности которых восстанавливаются соседние образы, а последний - порог расстояния, ближе которого атомы считаются соседними.
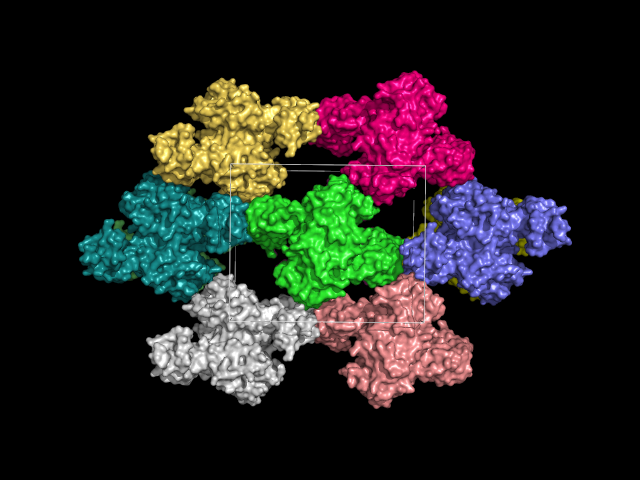
Рис. 1. Восстановленные образы. Окрашивание по стандартной расцветке - auto, by obj. Структура, для которой восстанавливали образы асимметрической единицы, показана зеленым цветом, на изображении скрыта структура, находящаяся перед ней.
Считали, что водородные связи могут образовываться между остатками полярных аминокислот на расстоянии 3.5 Å. На таком расстоянии нашлось много контактов, многие оказались симметричными, поэтому в дальнейшем рассматривали три области контактов цепи А 4J3C с соседними объектами. На рисунке 2 показаны эти области контактов, которые были построены вокруг цепи А.
symexp sym, 4J3C, chain a, 5
Для подмножеств полярных аминокислотных остатков 4J3C и восстановленных образов нашли все возможные контакты на расстоянии 3.5 Å.
Рис. 2. Зеленым показана асиметрическая ячейка, восстановленные образы показаны розовым, белым и голубым, контакты показаны ярко-желтым пунктиром (далее применяются такие же обозначения, если не указано другое).
Рассматривали отдельные области контактов с каждым из трех восстановленных образов.
Рис. 3. Контакты между аминокислотными остатками соседних структур. Атомы, отличные от углерода, окрашены в стандартные цвета: красный - атомы кислорода, синий - атомы азота (здесь и далее, если не указано другое). Водородные связи между положительно-заряженным аргинином и отричательно-заряженной глутаминовой кислотой, а также между аргинином и треонином с частичным отрицательным зарядом.
Рис. 4. Контакты между аминокислотными остатками соседних структур. Показаны связи между положительно- и отрицательно-заряженными остатками (также со смещенным зарядом).
Пересмотрели данные контакты с помощью поиска водородных связей.
Данный белок удалось кристаллизовать, так как в нем существует много взаимодействий, определяющих стабильность кристалл: много контактов между молекулами и много настоящих водородных связей, возможно, играют роль и другие взаимодействия. Я считаю что контакты между белками не отражают взаимодействия при ди- или олигомеризации.
Выбрали 3hdd, в этой структуре белковая цепь располагается довольно странно -
"на краю" ДНК.
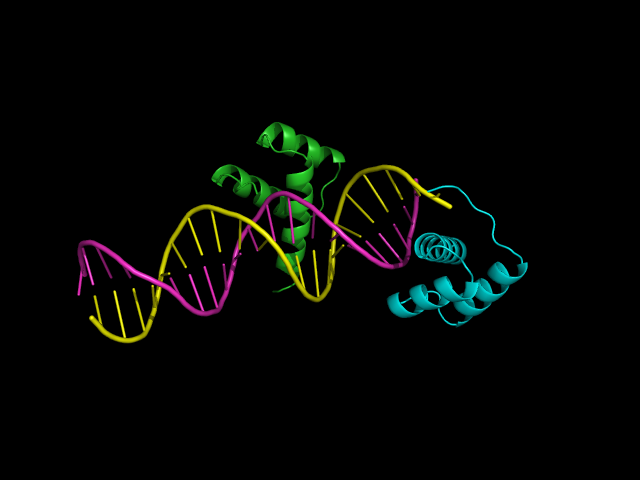
Рисунок 5. Структура комплекса 3hdd, окрашена по цепям, голубым окрашена белковая цепь, срапсолагающаяся странно - на краю.
Восстановили ячейки, соседние с этой "странностью" (рис. 7).

Рисунок 6. Восстановленные соседние ячейки, цветом показана исходная.
По картинке можно предположить, что цепь ДНК продолжается, и необычно (на первый взгляд) расположенная белковая цепь находится не на краю. Искали контакты между белковыми цепями.
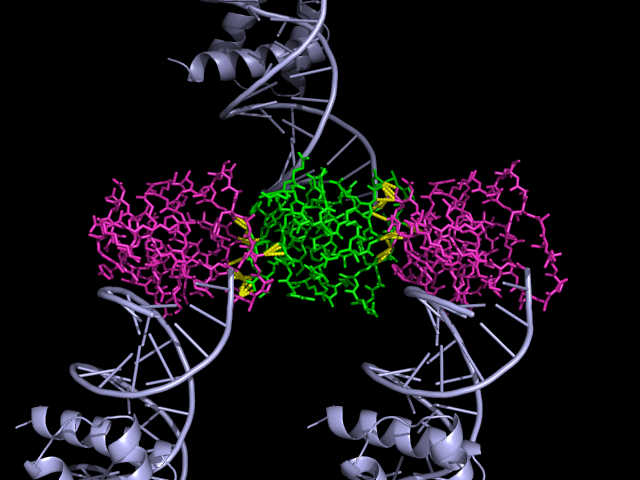
Рисунок 7. Здесь изменилась окраска, зеленым показана цепь, которая находится "на краю". Желтым показаны контакты с другими цепями.

Рисунок 8. То же, что на рисунке 7, без цепей ДНК.
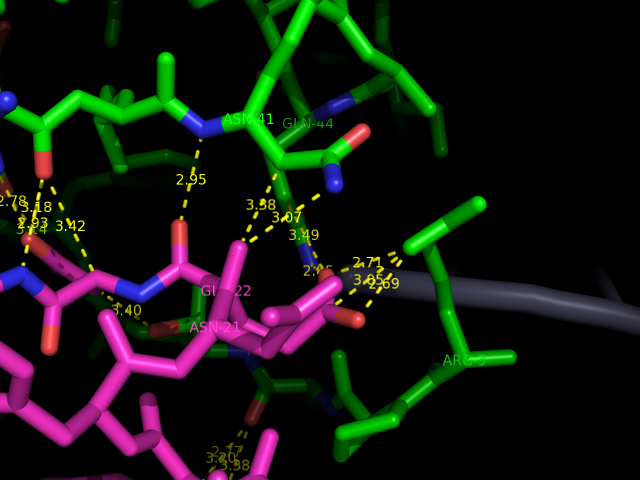
Рисунок 9. Показаны очень тесные (меньше 3,5 Å) контакты между белковыми цепями.
Еще есть контакты с нуклеотидами, странность объясняется.