Исследование ДНК-белковых взаимодействий в структуре комплекса белка seqA и гемиметилированной ДНК
- Краткое описание структуры в файле 1LRR.pdb В файле приведены координаты атомов следующих молекул:
- Функции белка, структура которого представлена в файле 1LRR.pdb Белок ингибирует инициацию репликации. Отвечает за секвестрацию (процесс, блокирующий вторичную инициацию). Может блокировать аллостерический переход ДНК-А в активную форму. Связывается с гемиметилированным oriC (участок, где начинается репликация), чтобы предотвратить преждевременную реинициацию только что реплицированных участков хромосом.
- Исследование структуры ДНК При помощи программ find_pair и analyze было определено, что ДНК представлена в B-форме (в файле 1LRR_old.out динуклеотиды классифицируются по сходству с той или иной формой ДНК).
- Исследование природы ДНК-белковых контактов Для исследования ДНК-белковых контактов в RasMol был составлен скрипт mydna.def.
- Получение популярной схемы ДНК-белковых контактов с помощью nucplot При помощи программы nucplot была получена схема ДНК-белковых контактов. Правда, мы получили изображение для цепей B и C, но, поскольку цепи B/C и E/F идентичны, по этой схеме мы можем судить и о ДНК-белковых контактах исследуемых цепей E и F:
- Возможный распознающий контакт Наиболее вероятным кандидатом на роль распознающего остатка является, на мой взгляд, Asn150, поскольку он связывается с тимином, который, в свою очередь, связан с гемиметилированным аденином. Этот контакт наиболее специфичен, поэтому он вполне может быть распознающим:
- Характеристика ДНК-связывающего домена P0AFY8 Белок P0AFY8, предствленный в исследуемом файле 1LRR.pdb, имеет небольшой размер и состоит из единственного домена seqA, который и выполняет функцию связывания с ДНК:
1) 2 фрагмента ДНК:
5'-D(*CP*AP*CP*CP*GP*AP*TP*CP*GP*AP*CP*T)-3' (2 цепи: B и E);
5'-D(*AP*GP*TP*CP*GP*(6MA)P*TP*CP*GP*GP*TP*G)-3' (тоже 2 цепи: С и F);
2) фрагмент белка seqA с 51 по 181 аминокислотный остаток, содержит 2 цепи: А и D.
Эти структуры были выделены из кишечной палочки Escherichia coli.
Для исследования была выбрана цепь D белка и цепи E и F, представляющие ДНК со следующей последовательностью:
цепь Х [1] 5' - caccgacgact - 3' [12]
|||||||||||
цепь Y [12] 3' - gtggctgctga - 5' [1],
, где 1 и 12 - номера первого и последнего нуклеотида.При определении торсионных углов рассматривались нуклеотиды №№2-11 (внутренние). При этом рассматривались нуклеотиды обеих цепей ДНК. В некоторых случаях приходилось прибавлять (или отнимать) к значению угла 360 градусов, чтобы избежать искажения результатов. Затем были посчитаны средние значения углов и вычислены отклонения от среднего значения для каждого нуклеотида. Самыми "кривыми", то есть с наибольшими отклонениями от среднего, оказались C7, G8, A9 из цепи Е и T2, C5, G10 из цепи F (G10 вообще оказался самым "кривым"). Все данные и расчеты по торсионным углам приведены в таблице tangles.xlc
Посмотрим, как расположены наиболее деформированные нуклеотиды относительно белка:
Как видим, некоторые деформированные нуклеотиды действительно приурочены к местам контакта с белком. В то же время в ДНК имеются недеформированные участки, расположенные еще ближе к белку, чем многие из этих нуклеотидов. Таким образом, можно сделать вывод, что связывание с белком приводит к деформации ДНК лишь в малой степени.
Таблица. Контакты разного типа в комплексе 1LRR.pdb
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 1 | 13 | 14 |
| остатками фосфорной кислоты | 10 | 15 | 25 |
| остатками азотистых оснований со стороны большой бороздки | 0 | 0 | 0 |
| остатками азотистых оснований со стороны малой бороздки | 2 | 5 | 7 |
Из данных, указанных в таблице, видно, что контактов с фосфатом и дезоксирибозой гораздо больше, чем с азотистыми основаниями. Скорее всего, это обусловлено геометрией молекул (атомы рибозы и фосфата находятся ближе к белку, так как расположены кнаружи от оснований). Кроме того, неполярных контактов больше, чем полярных (всё-таки в белке преобладают неполярные атомы (в основном атомы углерода); кроме того, в качестве критерия отбора неполярных взаимодействий мы указали не 3,5 А, как для полярных, а 4,5 А - большее число атомов может быть охвачено).
Контактов с азотистыми основаниями совсем немного, и все эти взаимодействия происходят между белком и атомами малой бороздки. Это тоже можно объяснить геометрией молекулы ДНК: большая бороздка уже и глубже, а малая - шире, атомы оснований расположены ближе к поверхности, следовательно, атомам белка легче с ними контактировать.
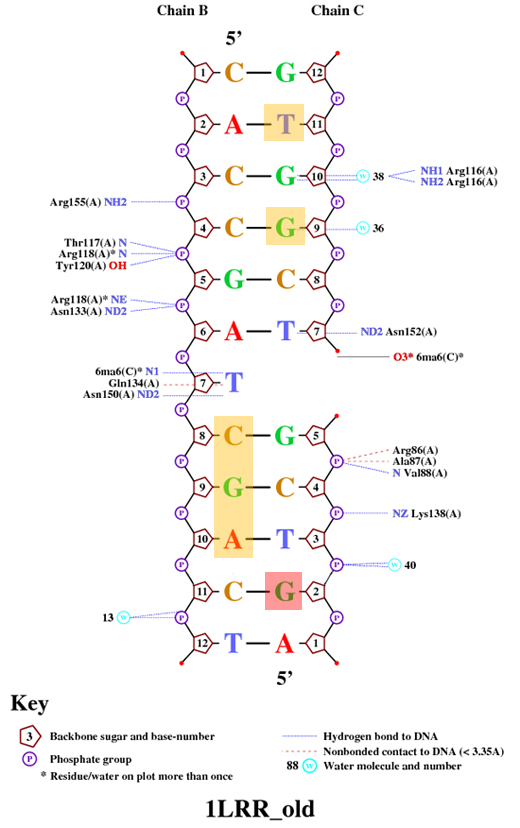
Нумерация оснований отличается от их нумерации в п. III, т.к. при рассмотрении торсионных углов были пропущены T7 цепи Е (на схеме В) и комплементарный ему гемиметилированный аденин цепи F (на схеме С, сам нуклеотид на схеме вообще пропущен), а также нумерация оснований в п. III велась в направлении 3' - 5'.
Азотистые основания, соответствующие нуклеотидам, которые по значению торсионных углов оказались наиболее деформированными, отмечены на схеме оранжевым. Самым деформированным по результатам п. III оказался нуклеотид, отмеченный красным.
Оказывается, ни один из деформированных нуклеотидов не связан с белком. Это подтверждает, что деформация не зависит непосредственно от связи ДНК-белок.
Далее нумерация нуклеотидов соответствует схеме nucplot.
С другой стороны, из схемы видно, что деформированные T11 и G9 цепи С (F) соседствуют с G10, который образует сразу две связи с белком. Возможно, это соседство и привело к деформации.
Тем не менее, самый деформированный нуклеотид G2 не соседствует с нуклеотидами, связанными с белком. Это подтверждает, что вероятность деформации при ДНК-белковом контакте невелика.
Связывание SeqA с гемиметилированными последовательностями GATC играет важную роль в негативной модуляции хромосомальной инициации на oriC, а также в сегрегации хромосом у E.coli. Тетрамеры SeqA способны аггрегироваться или полимеризоваться, причем этот процесс обратимый и зависит от концентрации. Помимо контроля репликации ДНК, SeqA также может являться особым фактором транскрипции. С-конец связывается с ДНК, а именно с метилированными и гемиметилированными ее частями, на oriC. Структура C-терминального домена состоит из семи альфа-цепей и трехцепочечного бета-слоя.
Назад