Сравнение РСА и ЯМР
Модели
Для работы был выбран онкогенный белок человека ганкирин (human oncogenic protein gankyrin). Белок состоит из одной цепи, длина которой составляет 226 аминокислотных остатка.
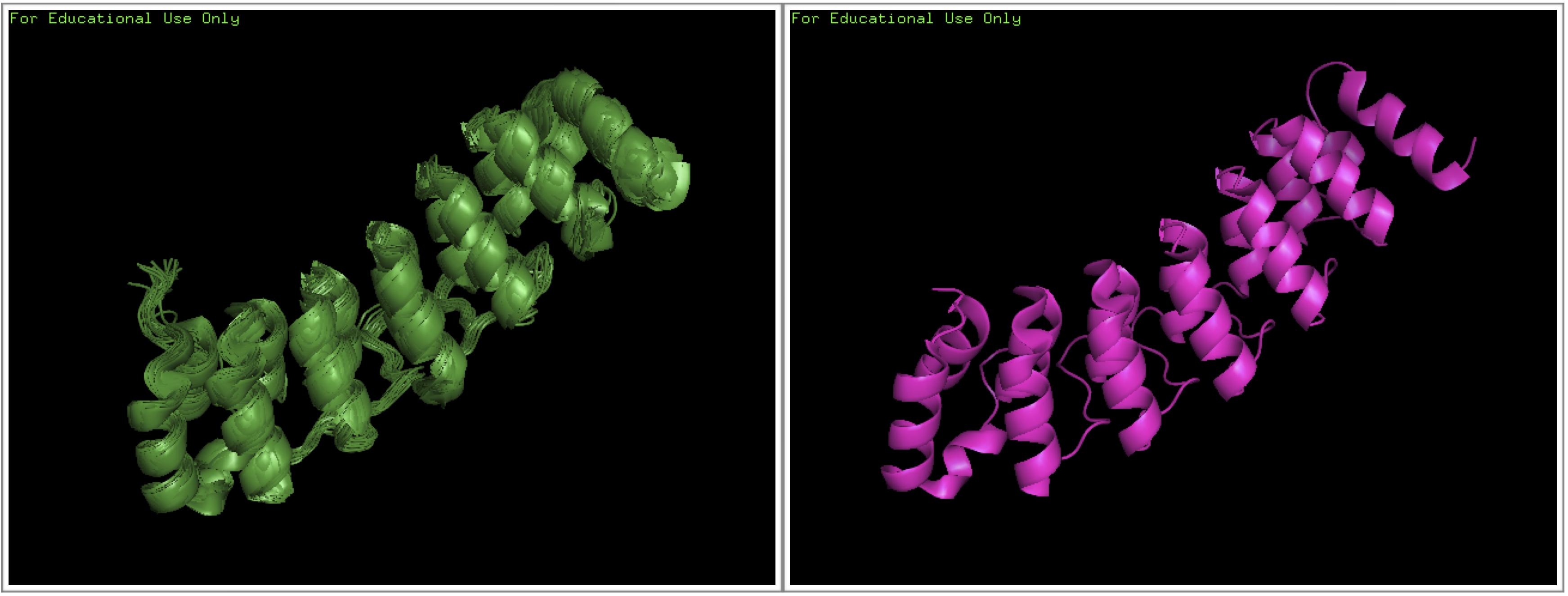
На рис. 1 показаны ЯМР и РСА структуры для белка ганкирина. Видно, что модели ЯМР структуры между собой довольно хорошо коррелируют. Заметные расхождения наблюдаются в области одной из альфа-спиралей, а также в изгибах.
Зеленым цветом представлена ЯМР модель 1TR4, розовым цветом РСА модель 1UOH.
На рис. 2 показано совмещение структуры, полученной с помощью РСА со структурой, полученной методом ЯМР посредством Jmol.
Слева зеленым цветом представлена ЯМР модель 1TR4, справа розовым цветом РСА модель 1UOH.
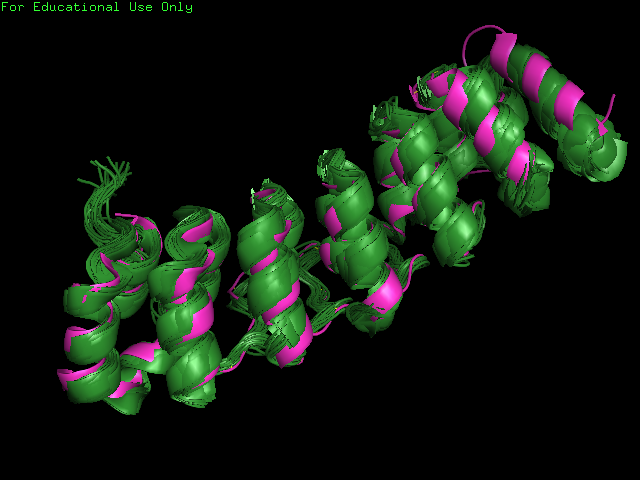
Заметим, что и на совмещенной структуре самыми подвижными элементами является одна из альфа-спиралей и изгибы, причем спираль даже в большйе степени.
Водородные связи в РСА структуре 1UOH
Выберем 3 водородные связи для анализа:
- Остовную в альфа-спирали - LEU-125 и ILE-121
- Водородную связь боковых цепей в ядре белка - ALA-148 и ARG-184
- Водородную связь в петлях, выходящих на поверхность глобулы - ALA-72 и GLN-104
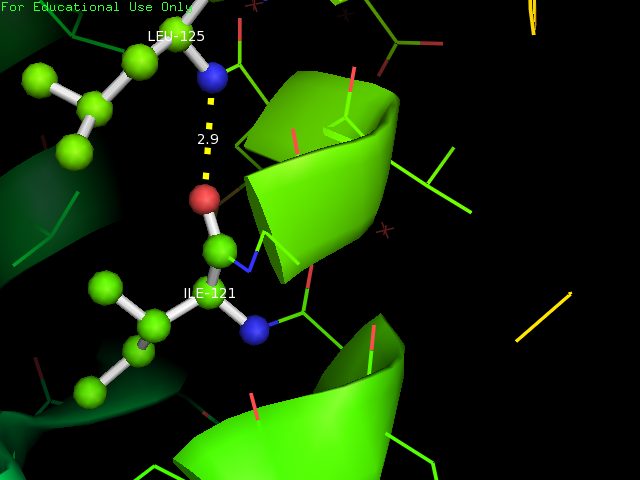
Водородная связь образуется между остатками LEU-125 и ILE-121, которые представлены в шарнирной модели. Длина связи составляет 2.9 Å. Красными звездочками показаны молекулы воды.
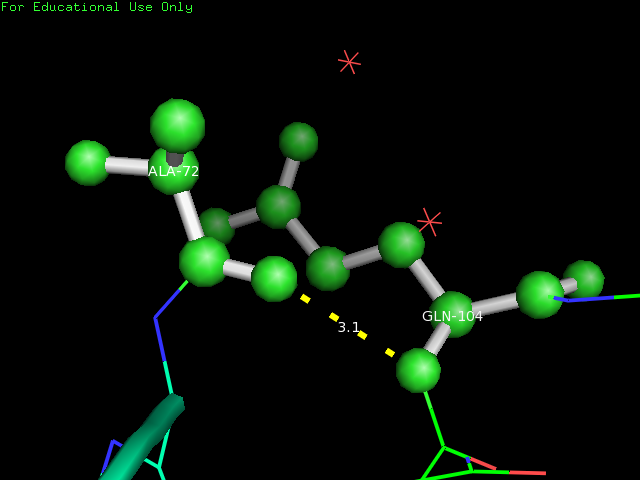
Водородная связь образуется между остатками ALA-72 и GLN-104, которые представлены в шарнирной модели. Длина связи составляет 3.1 Å.
Водородная связь образуется между остатками ALA-148 и ARG-184 , которые представлены в шарнирной модели. Длина связи составляет 2.8 и 3.4 Å.
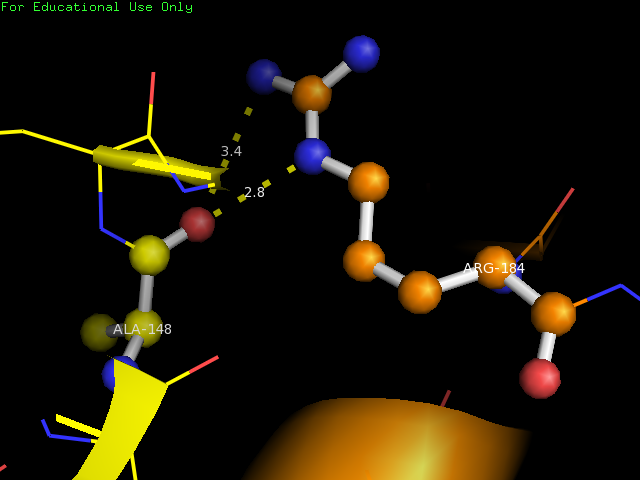
Представители данных 3 типов водородной связи, на самом деле, были выбраны из большого количества связей, которые присутствуют в этом белке. Очень много водородных связей образуется с боковыми цепями остатков и молекулами воды, которые закристаллизовались вместе с белком.
Остовная водородная связь в альфа-спирали, изображенная на рис.3 поддерживает структуру спирали. Водородная связь в петялях на рис.4, в основном образуется через молекулы воды (не показано на рисунке). Водородные связи в боковых цепях, изображенные на рис.5 скорее всего стабилизируют структуру белка в целом, то есть не дают соседним альфа-спиралям "развалиться" друг от друга.
Водородные связи в ЯМР структуре 1TR4
Выбранные водородные связи были проанализированы в ЯМР структуре.
Водородная связь образуется между остатками LEU-125 и ILE-121.
Водородная связь образуется между остатками ALA-72 и GLN-104, длина связи составляет 2.2 Å. Видно, что по сравнению с РСА, данная связь образуется только в 1 случае из 20.

| Таблица 1. Подробные сведения о проанализированных водородных связях | |||||||
|---|---|---|---|---|---|---|---|
| Расположение |
Донор | Акцептор | Длина (РСА) |
Количесвто моделей ЯМР, образующих связь (и доля) |
Наименьшая длина связи среди ЯМР моделей |
Наиболшая длина связи среди ЯМР моделей |
Медианная длина связи в моделях ЯМР |
| Остов α-спираль Ядро глобулы |
Leu125 | Ile121 | 2.9 Å | 19 (95 %) |
1.9 Å | 2.5 Å | 2.2 Å |
| Остов Петля Поверхность глобулы |
Gln104 | Ala72 | 3.1 Å | 1 (0.05 %) |
2.2 | 2.2 | 2.2 |
| Боковая цепь α-спираль Поверхность глобулы |
Arg184 | Ala148 | 2.8Å | 0 (0%) |
- | - | - |
Выводы
Как и ожидалось, в ЯМР наибольшее количество моделей образуют водородную связь в остове альфа-спирали. Это логично, так как эта связь образует альфа-спираль и вторичные структуры явялются достаточно стабильными. Выбранной водородной связи боковых цепей в ядре белка в моделях ЯМР не оказалось, это можно объяснить тем, что аргинин обладает достаточно подвижной боковой группой и она, возможно, образует связь с другим остатком в структурах ЯМР. Выбранная водородная связь в петлях, выходящих на поверхность глобулы нашлась всего лишь в одной модели ЯМР. Структура петель может значительно варьировать, поэтому ничего удивительного в таком малом количестве нет.
