DSSP/Stride
С помощью сервиса Stride была получена информация о вторичной структуре белка 2nx9 и сохранена в файл 2nx9_Stride.txt
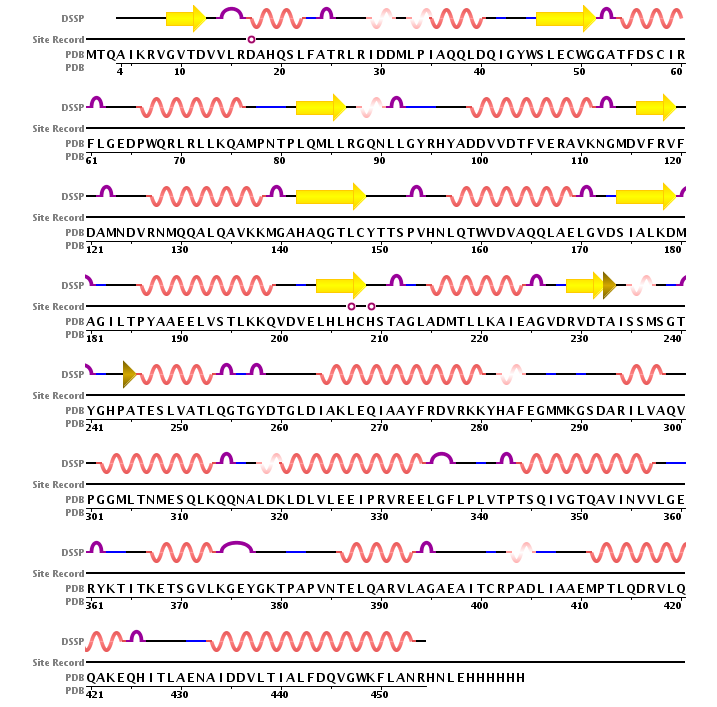
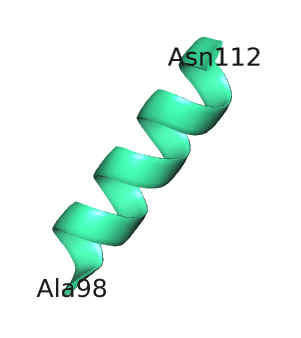
В таблице 1 приведена вторичная структура цепи А белка 2nx9, предсказанная алгоритмами DSSP и Stride. В таблице 2 приведены изображения 8-ой α-спирали и β-барреля данной цепи, полученные в PyMol.
α-спираль была "недопредсказана" алгоритмами DSSP и Stride (99-111 а.о. и 99-112 а.о. соответственно), по сравнению с PyMol (98-112 а.о.). "Недопредсказание" одного остатка Ala98 на N-конце α-спирали, вероятно, связано с тем, что этот остаток имеет большое значение угла ψ и находится на карте Рамачандрана в области, характерной для β-структуры. Для этого остатка алгоритмом Stride была предсказана coil-форма. "Недопредсказание" одного остатка Asn112 алгоритмом DSSP на С-конце α-спирали связано с тем, что данный алгоритм предсказал участие этого остатка в образовании поворота.
Все 8 β-тяжей β-барреля были предсказаны одинаково обоими алгоритмами DSSP и Stride.
| Таблица 1. Вторичная структура цепи А белка 2nx9 |
| Предсказание алгоритмом DSSP |
 |
| Предсказание алгоритмом Stride |
 |
| Таблица 2. Элементы вторичной структуры цепи А белка 2nx9 | |
| 8-ая α-спираль | β-баррель |
 |
 |
SheeP
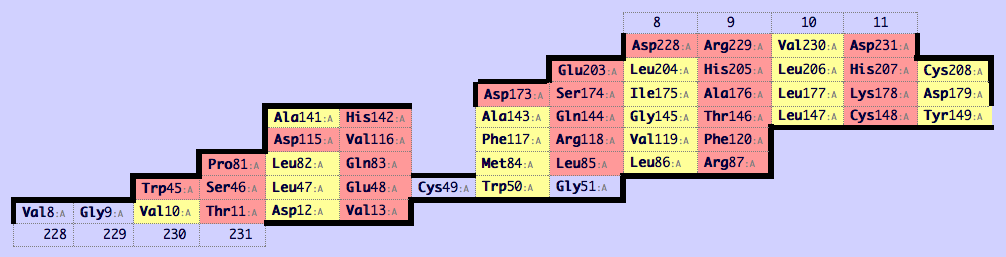
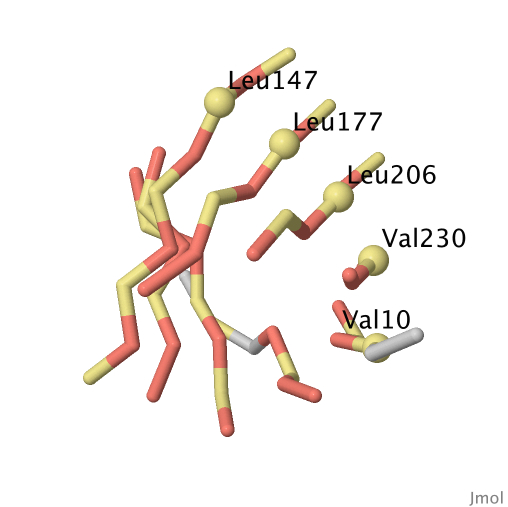
С помощью сервиса SheeP была получена карта (рисунок 1) и изображение пространственной структуры (рисунок 2) β-барреля цепи А белка 2nx9. На карте β-барреля (рисунок 1) можно заметить, что жёлтые столбцы состоят преимущественно из гидрофобных остатков, а красные столбцы состоят преимущественно из гидрофильных остатков. Жёлтые столбцы соответствуют "хребтам" β-барреля, образованным повёрнутыми наружу остатками, а красные столбцы соответствуют "хребтам" β-барреля, образованным повёрнутыми внутрь остатками (рисунок 3).