Странности в PDB файлах
5rxn
Структура 5rxn из PDB является моделью низкомолекулярного железосодержащего белка рубредоксина. Данная структура заменила устаревшую структуру 2rxn в 1985 году и имеет разрешение 1.20 Å. Несмотря на то, что структура 5rxn является уточнённой, она содержит некоторую странность: остаток треонина в необычной конформации.
Структура 5rxn содержит всего три остатка треонина: Thr5, Thr7 и Thr28. Остатки треонина Thr7 и Thr28 имеют 2S,3R-конформацию (L-threonine), характерную для протеиногенных аминокислот, в то время как Thr5 имеет 2S,3S-конформацию (L-allo-threonine) (Рисунок 1), редко встречающуюся в природе. Такая редкая конформация Thr5 в данной структуре может быть обусловлена неправильной интерпретацией функции распределения электронной плотности атомов HB, OG1 и CG2. Температурные факторы данных атомов равны 27.00, 19.30 и 25.30, соответственно, что говорит об очень низких пиках функции распределения электронной плотности. Положения данных атомов важны для определения конформации треонина.
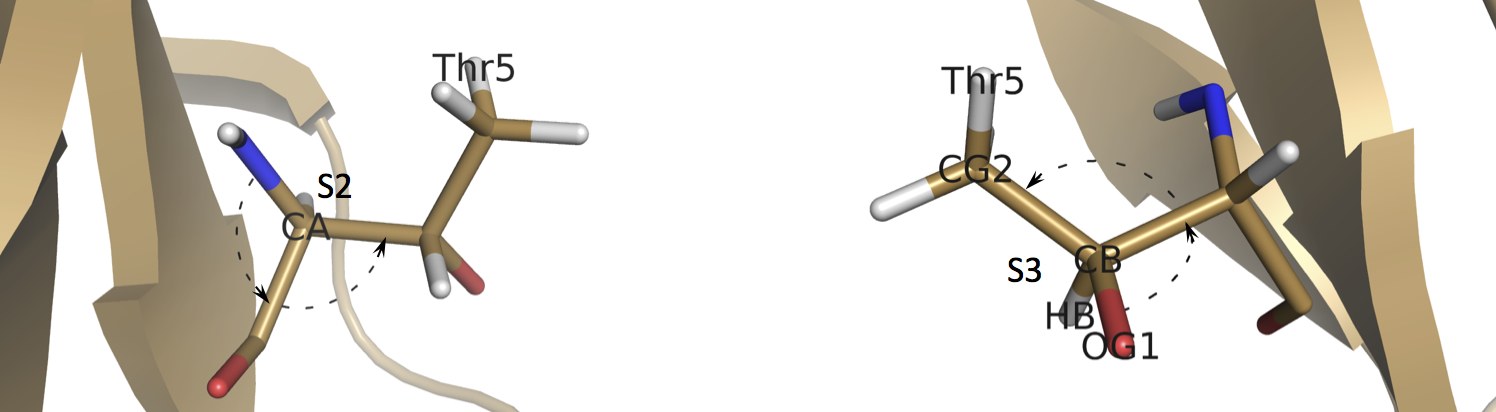
По причине наличия у треонина двух асимметричных атомов углерода, возможно существование и двух других минорных конформаций треонина: 2R,3S (D-threonine) и 2R,3R (D-allo-threonine). Изолейцин также имеет два асимметричных атома углерода и может существовать в виде четырёх стереоизомеров.
1gt0
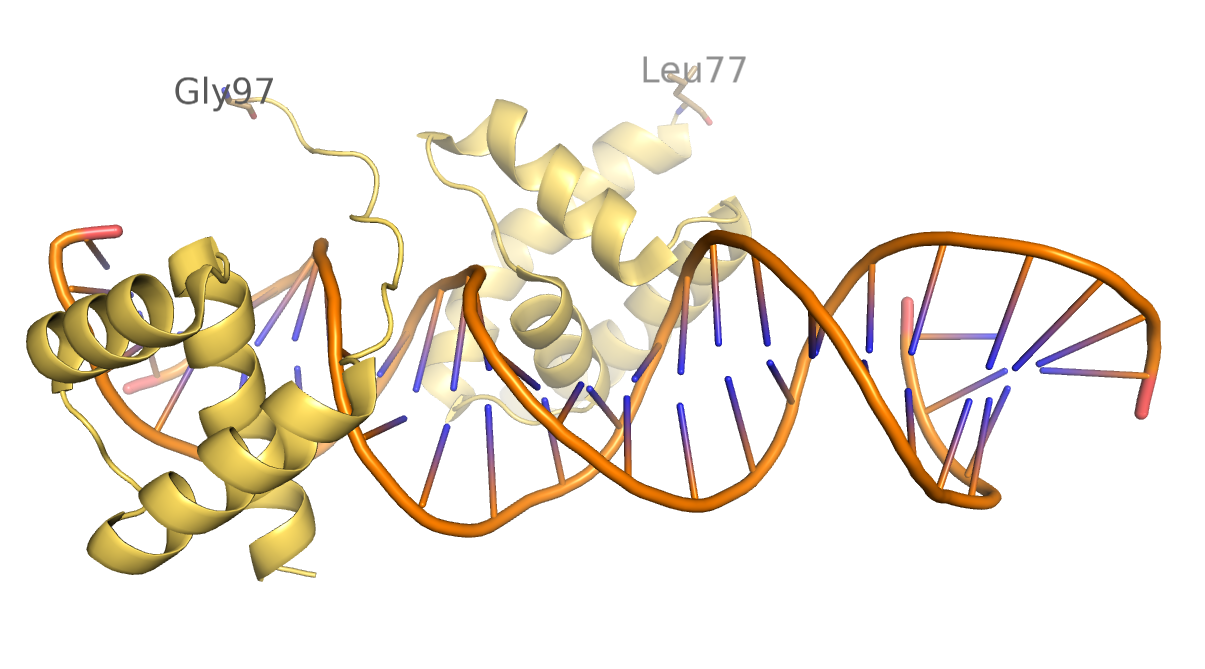
Структура 1gt0 из PDB является моделью ДНК-белкового комплекса. Данная структура была расшифрована в 2003 году и имеет разрешение 2.60 Å. В данной структуре белковая цепь не содержит аминокислотные остатки с 78 по 96 (Рисунок 2). Эта странность связана с тем, что электронная плотность данных аминокислотных остатков оказалась размыта, вследствие того, что они по разному закристаллизовалась у разных молекул кристалла. По-видимому, эта петля подвижна.
2b5a
Структура 2b5a из PDB представляет собой модель двух димерных биомолекул белка C. Белок С является регулятором Bcll-системы рестрикции-модификации. Цепь С данной структуры содержит остаток глутамина Gln21, большинство атомов которого имеют коэффициент заполнения равный 0.5. При визуализации Gln21 выглядит "раздвоенным" (Рисунок 3). Однако в трёх остальных цепях данной структуры остатки глутамина Gln21 не "раздвоены" (Рисунок 4) и их атомы имеют коэффициент заполнения, равный 1.0.
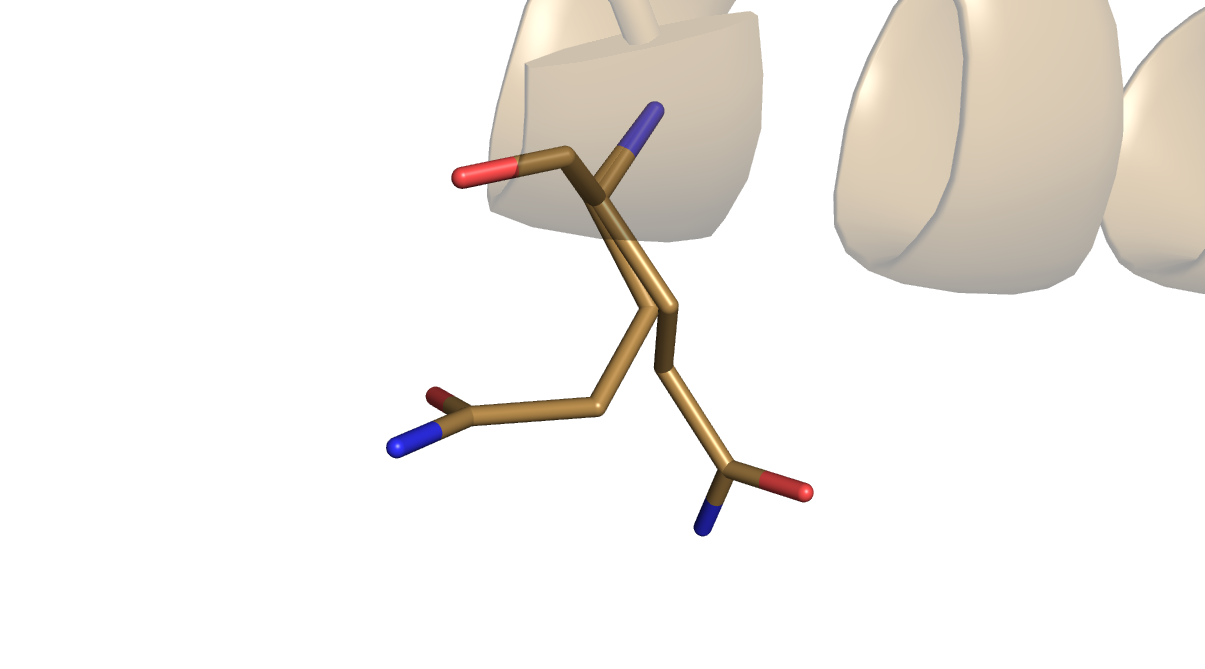
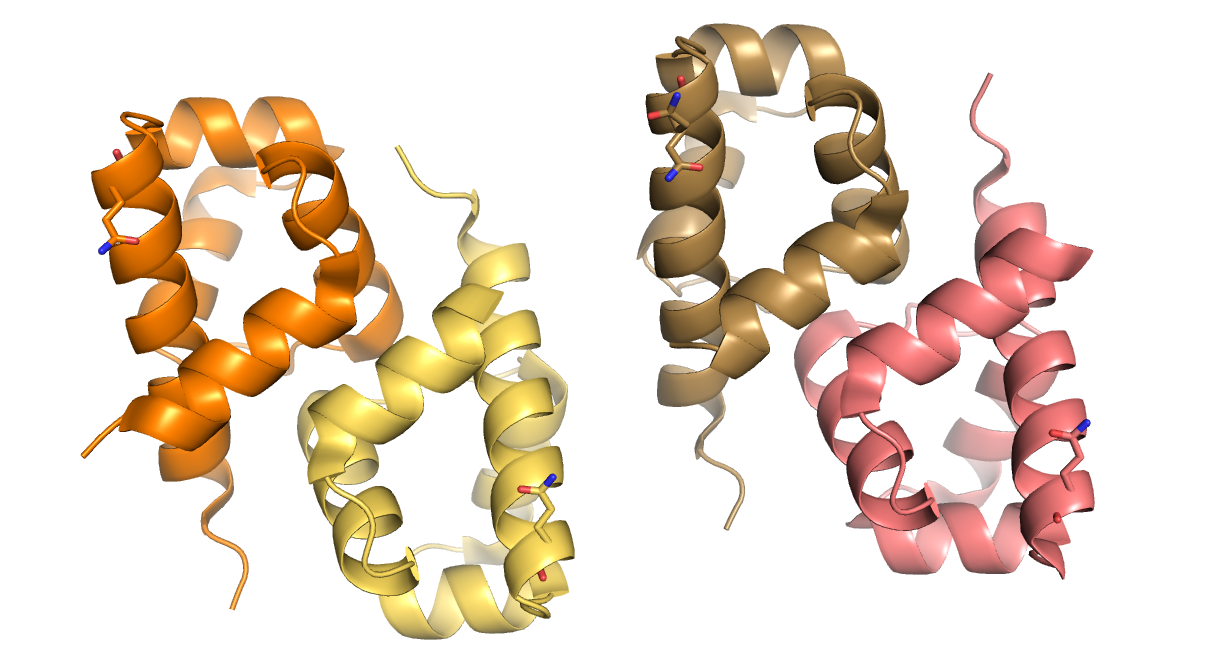
1dlp
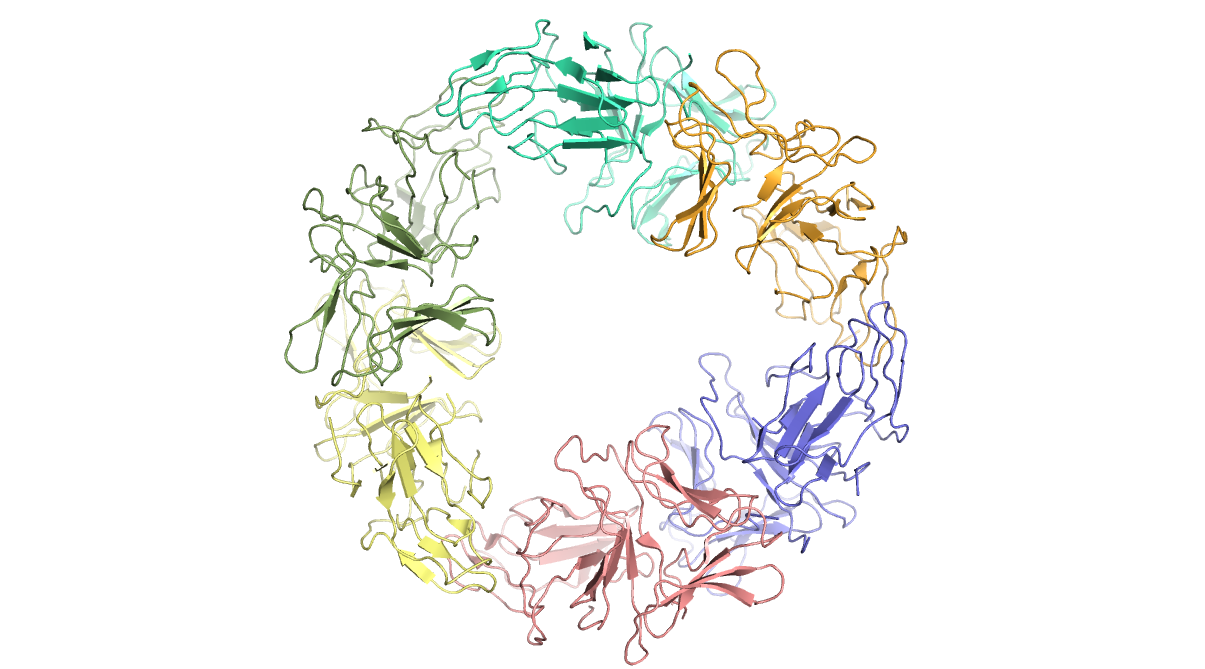
Структура 1dlp из PDB представляет собой модель гексамерного белка (Рисунок 5).
Данная структура была расшифрована в 2000 году и имеет разрешение 3.30 Å.
В PDB-файле данной структуры было найдено множество странных аминокислотных остатков:
• Asn136 нормально прописан только в цепи С,
в то время как в цепи А атомы аспарагина CG, OD1, ND2 имеют нулевые коэффициенты заполнения,
а в цепях B, D, E, F атомы CG, OD1, ND2 вообще не прописаны.
• У Tyr129C прописаны только атомы N,CA,C,O,CB.
• У Lys179D прописаны только атомы N,CA,C,O,CB.
В цепях В и F Lys179 вообще нет.
• В цепях B, C, F у Arg167 прописан только углеродный скелет.
В цепях A, E у Arg167 просисан ещё атом CB.
В цепи D у Arg167 просисаны ещё атомы CB, CG, CD.
Таким образом, ни в одной цепи нет "полного" Arg167.
Такое большое количество ошибок в данной структуре может быть связано с низким качеством экспериментальных данных,
по которым трудно восстановить функцию распределения электронной плотности и расшифровать структуру.
Сравнение структур 2alr и 2i16
Структуры 2alr и 2i16 из PDB являются моделями белка альдозо-редуктазы (Рисунок 6). Структура 2alr заменила устаревшую структуру 1alr в 1996 году и имеет разрешение 2.48 Å при полноте данных 92%. Структура 2i16 была расшифрована в 2006 году и имеет разрешение 0.81 Å при полноте данных 95.8%.
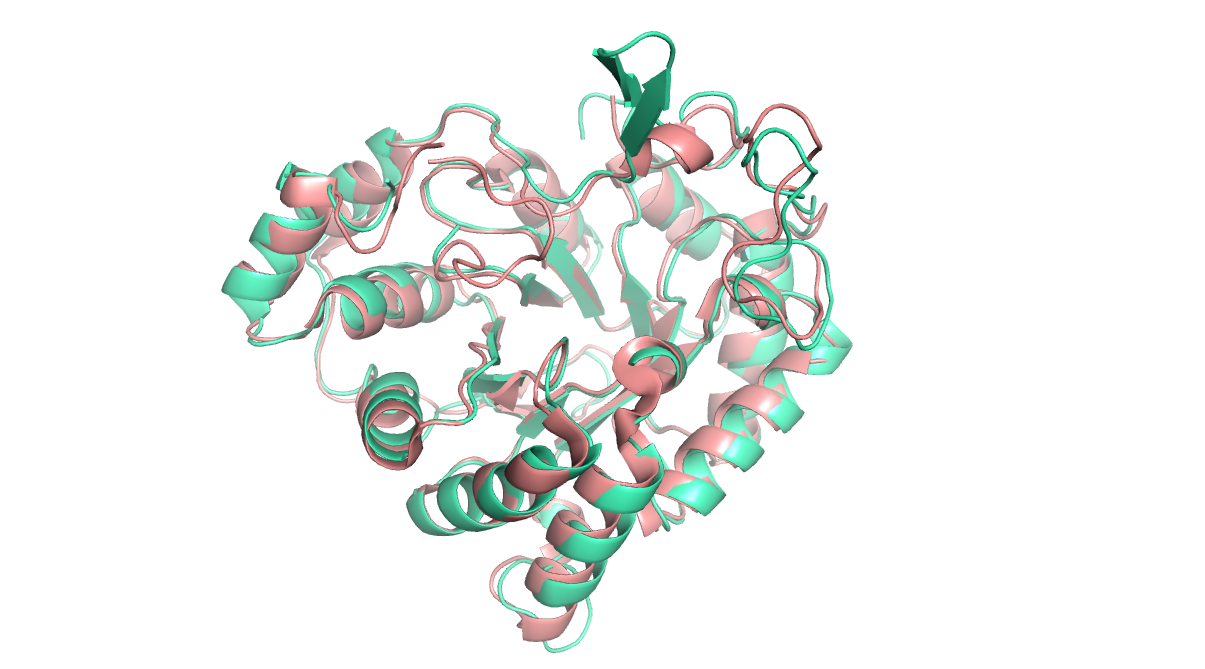
Структура 2i16 имеет атомное разрешение и содержит информацию о связанных с белком молекулах воды и об анизотропных температурных факторах атомов. Структура 2alr имеет среднее разрешение и такой информации не содержит. Поэтому было произведено сравнение коэффициентов заполнения и изотропных температурных факторов только для белковых атомов данных структур.
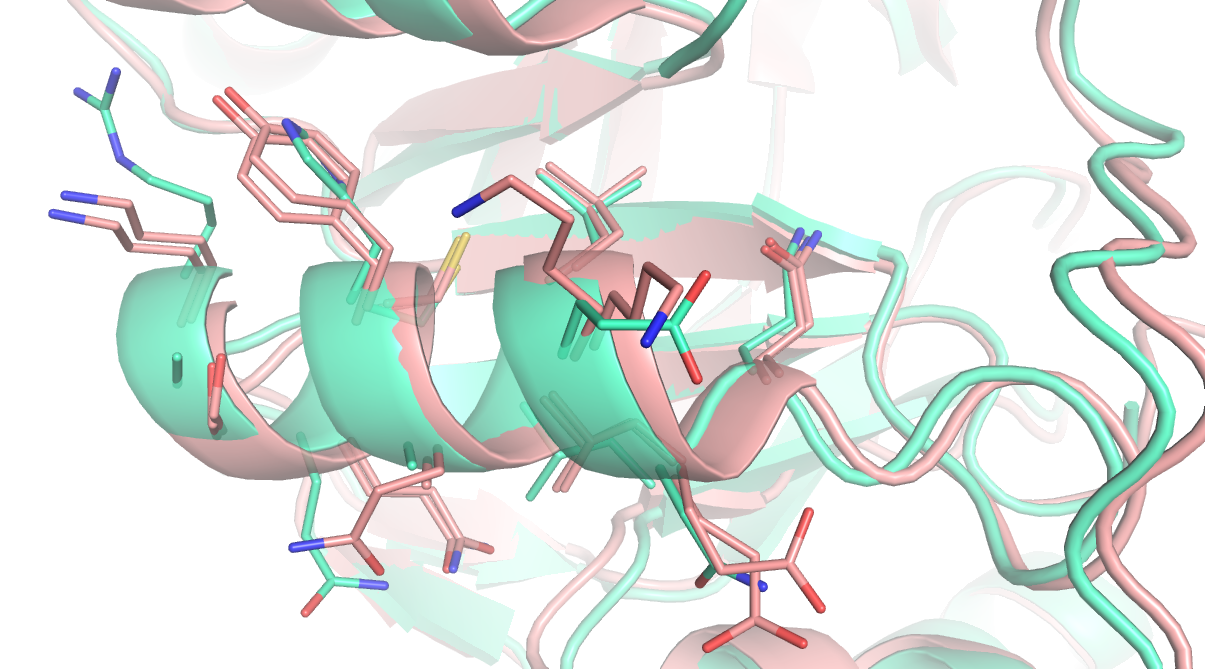
С помощью скрипта в каждой структуре было подсчитано число аминокислотных остатков, атомы которых имеют коэффициент заполнения, меньший 1.00. В структуре среднего разрешения 2alr таких атомов не оказалось, все атомы имели коэффициент заполнения, равный 1.00 (всего структура содержит 324 аминокислотных остатка). В структуре атомного разрешения 2i16 было обнаружено 100 аминокислотных остатков, которые в разных молекулах по разному закристаллизовались, вследствие чего их атомы имеют коэффициенты заполнения, меньшие 1.00 (всего структура содержит 316 аминокислотных остатков). Такие аминокислотные остатки преимущественно принадлежат боковым цепям, и, по-видимому, более подвижны (Рисунок 7).
Затем с помощью скрипта в каждой структуре было подсчитано значение медианы изотропного температурного фактора. В структуре атомного разрешения 2i16 это значение оказалось равным 4.32 Å2, а в структуре среднего разрешения 2alr оно оказалось равным 7.63 Å2, что говорит о более низких пиках функции распределения электронной плотности в большинстве атомов структуры 2alr.