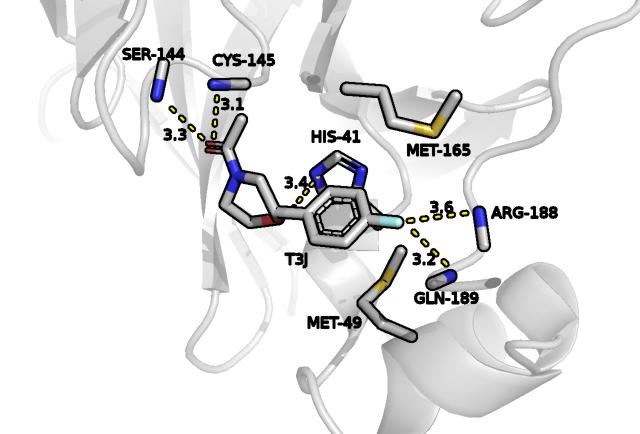

На рис.1 показаны возможные взаимодействия между атомами лиганда и аминокислотных остатков белка. Из них наиболее значимыми являются водородные связи, которые предположительно имеют место быть между фтором лиганда и остовными азотами ARG188 и GLN189, что показывает достаточное расстояние между этими акцепторным и донорными атомами, которое должно быть меньше приблизительно 3.5-3.6 ангстрем, впрочем ориентация второго азота видится не самой лучшей. На пару, участвующую в образовании такой связи, могут претендовать также атом кислорода шестичленного цикла лиганда и атом азота HIS41, здесь расстояние тоже удовлетворяет критерию. Наконец, третьим примером является группа атомов кислорода амидной группы лиганда в качестве акцептора и азота остова SER144 и CYS145 в качестве донора, у первого и расстояние, и ориентация кажутся вообще наиболее благоприятными. Во всех случаях мы не могли судить об угле водородной связи в силу отсутствия протонов в структуре. Вклад в позиционирование лиганда могут также вносить гидрофобные взаимодействия между ароматическим кольцом и радикалами MET165 и MET49. Стоит подчеркнуть, что субстрат также по размеру и форме неплохо садится в данное окружение.
Здесь была поставлена задача выявить, если они есть, различия в качестве карт электронной плотности одного белка, полученных в двух разных кристаллографических экспериментах, и оценить возможные истекающие различия в построении структурной модели белка, используя визуализацию в Pymol.
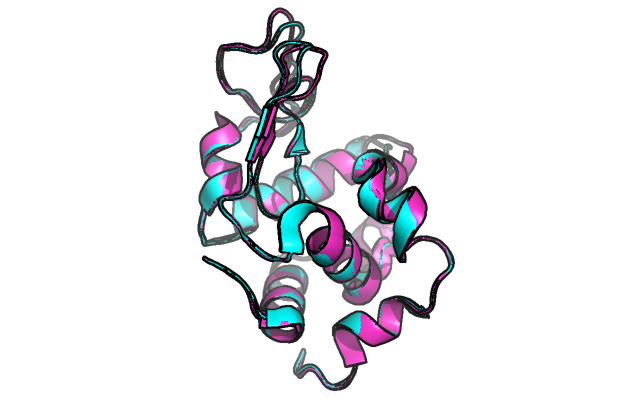
Были даны структуры с PDB ID 2VB1 и 4DDB. Обычная визуализация в Pymol в виде cartoon не выявила никаких существенных различий, то есть предсказание вторичной структуры практически совпадает за исключением положения петель, что объясняется их большой подвижностью:
Построение карты электронной плотности при помощи mesh вокруг остова остатков 69-76 дало следующие результаты:
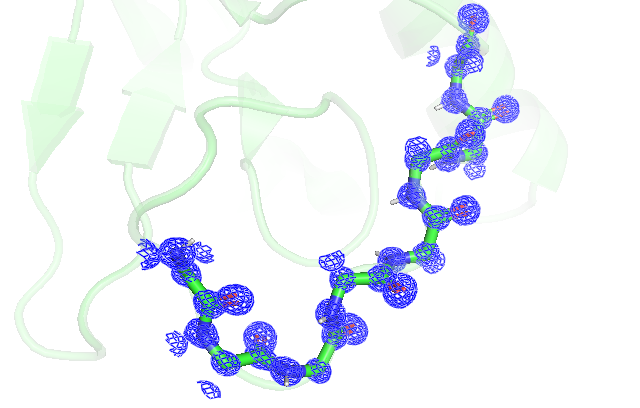
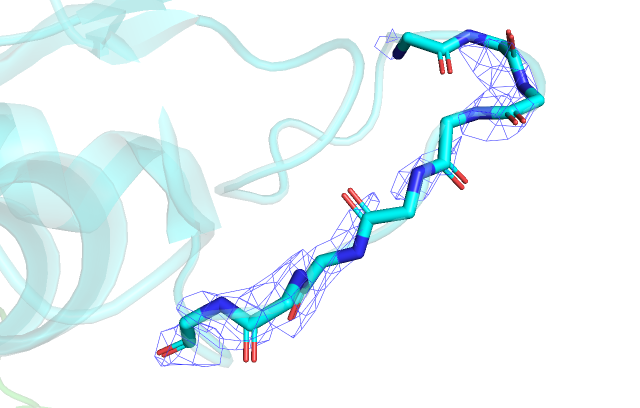
Как мы можем заметить из рис.3 и рис.4, карта электронной плотности для структуры 2VB1 является довольно полной, о чем свидетельствует наличие приписанных Pymol водородов и собранная вокруг атомов электронная плотность, которая даже немного отличается для атомов с разной электроотрицательностью в нужную сторону. В то же время для структуры 4DDB напротив, мы не то что водороды различить не можем, на том же уровне подрезки carve и z-score , что и для первой структуры, сама плотность выглядит очень размазанной и с пустотами, что сильно осложняет идентификацию атомов.
Данные из сайта PDB по разрешению структур 0.65 для 2VB1 и для 3.00 4DDB, что совпадает с приведенными рассуждениями. Подобное различие может свидетельствовать о разном проведении эксперимента в двух случаях, разной подготовке кристалла, разной установке для генерации излучения и разном анализе.



Как видно из трех верхних рисунков, с увеличением подрезки уменьшается объем сетки, что соответствует тому, что электроны "плотнее" окружают сами атомы элементов, причем плотность там больше, где электроотрицательность выше, что видно по более быстрому "исчезновению" при визуализации плотности вокруг атомов углерода по сравнению с атомами кислорода и азота, так, при подрезке 3 на рис.7 со всех углеродов пропадает электронная плотность, в то время как на кислородах она еще остается. При этом не стоит забывать о разной подвижности разных участков структуры, что тоже может вносить свой вклад в "размывание" электронов. Так на рис.6 при подрезке 2 уже пропадает плотность с С-конца остова, также для сравнения можно привести вторичную структуру этого белка в том же положении, из которой хорошо заметны петли, которые пропадают при подрезке 2 и 3 в большей степени:
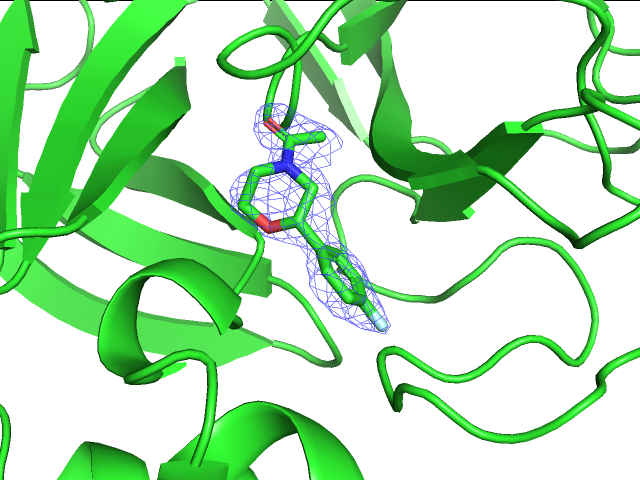
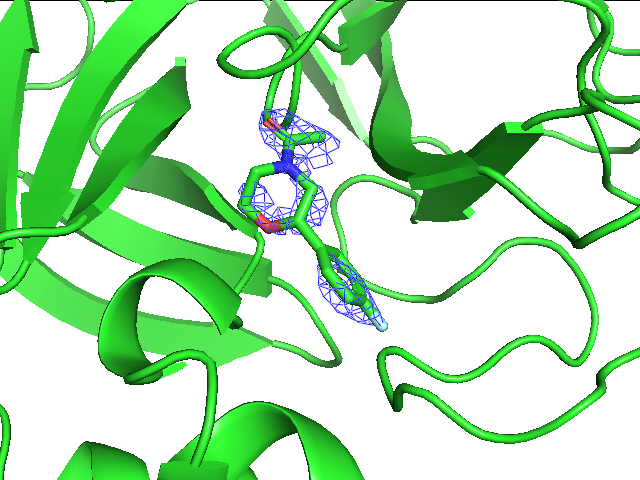
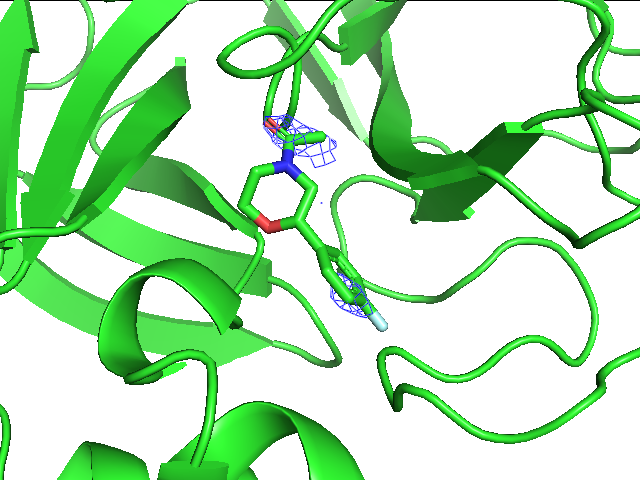
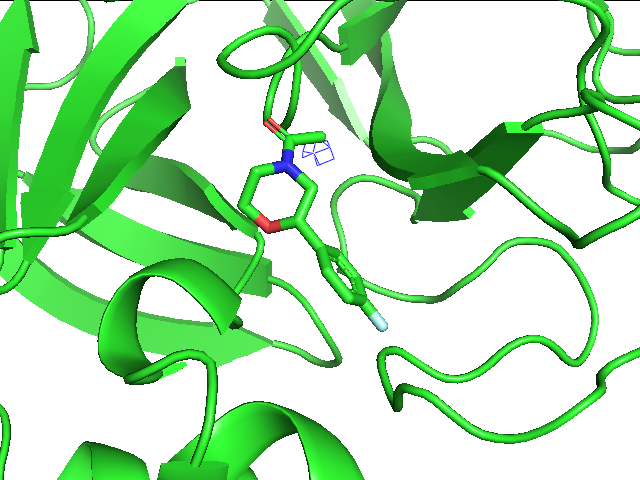
Из четырех рисунков выше можно заметить, что при переходе к уровню подрезки 1.5 пропадает плотность уже с небольшого количества атомов углерода, остается же она на углеродах ароматического кольца и во многом смещена к фтору, на котором тоже наблюдается, на азоте шестичленного цикла с соседними атомами и на амидной группе. Здесь очевидно уже, что плотность сосредоточена на более электроотрицательных атомах и группах атомов таких, как пи-система и амидогруппа. На уровнях подрезки 2 и 3 уже наблюдается почти полное отсутствие плотности, она остается только около фтора и кислорода амидной группы.
©Makarikova Olga 2020