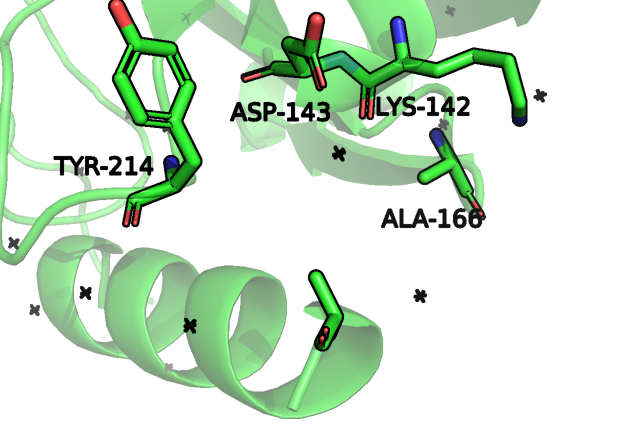

На рис.1 мы видим, что для непосредственного взаимодействия с ближайшими остатками белка, боковая цепь промутированного остатка пептида должна быть немаленькой, также наличие кислородов остова остатков аспартата и лизина, как и радикала первого остатка (аспартата), наводит на мысль о лизине и аргинине.
Промутируем и посмотрим на результат:
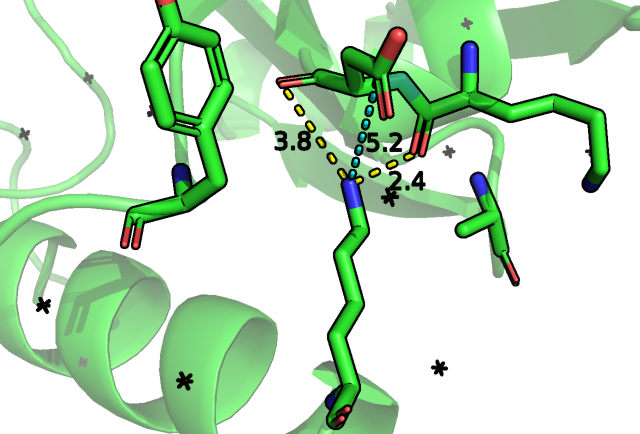
Среди возможных самым представленным оказался ротамер на рис.2 с вероятностью встретить его в PDB 33,6%, что сильно больше, чем для других ротамеров, напряженность 26,69 тоже оказалась одной из самых минимальных. Посмотрев глазами, мы можем сказать, что ожидаемый солевой мостик с боковым остатком аспартата вероятнее всего наблюдается именно для этого ротамера, хотя расстояние все же превышает 5 ангстрем, то же можно сказать про водородные связи с кислородами остова, где они составили 3,8 (немного превышает обговоренное 3,5) и 2,5 ангстрем. Можно предположить также гидрофобные взаимодействия между -CH2- группами лизина, тирозина и радикалом аланина.
Теперь посмотрим к чему приведет замена на аргинин, тоже способному к образованию водородных связей и солевых мостиков:
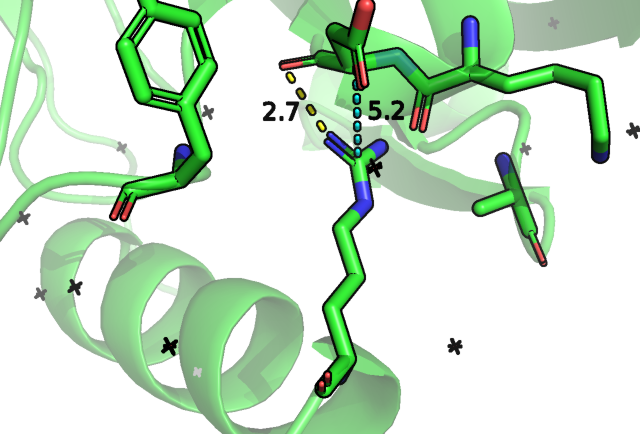
Если обратить внимание на мелькающую рядом с аминокислотными остатками антитела молекулу воды, которая, скорее всего, формирует водородные связи с боковой группой аспартата и кислородом остова лизина, можно предположить, что нам нужен остаток, который был бы донором или акцептором (но вероятнее, все же, донором, потому что по геометрии и наиболее вероятному протонированному состоянию аспарагиновой кислоты, которая экспонирована в раствор на поверхности белка, молекула воды двумя водородами смотрит на кислороды этих остатков) водродной связи для образования водяного мостика с молекулой белка, при этом, как мы можем судить по расстоянию до молекулы воды, это должен быть не очень длинный радикал. Посмотрим вначале на серин:
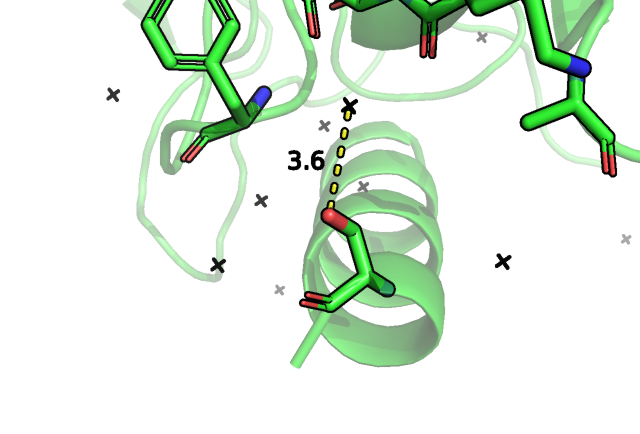
Рассмотрим вероятность замены на глутамин и аспарагин:
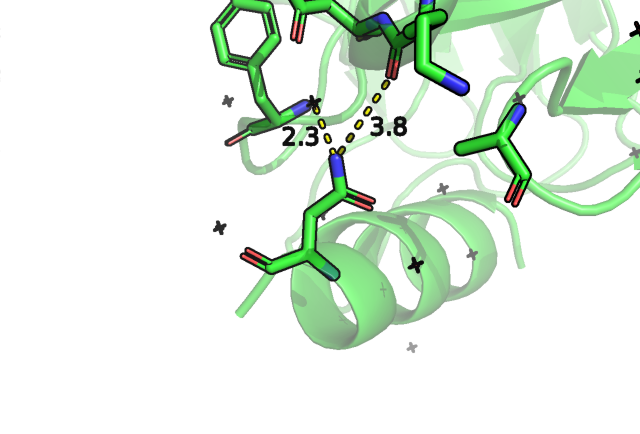
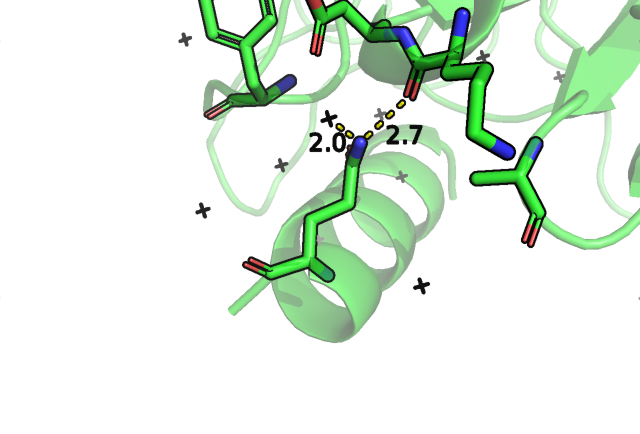
Здесь на рисунке 5 мы видим наиболее вероятные для образования водородной связи с водой ротамеры для аспарагина и глутамина, в первом случае это не самый представленный ротамер в PDB (9/10), но по углам и связям кажется самым благоприятным, хотя и возникает некоторый клэш с кислородом воды, но мы видим возможность двух водородных связей. Во втором варинате для глутамина был выбран ротамер, также способный к образованию двух водородных связей, но здесь снова наблюдаются клэши с водой и углы (далеко) не самые идеальные, правда, представлен он уже 3/10. Для гидрофобных остатков в данном случае окружение не самое благоприятное, и они сразу были исключены из рассмотрения, для совсем громоздких остатков, возможных участников водородной связи, таких, как тирозин и гистидин, наблюдались слишком большие стерические затруднения. Итого из всех рассмотренных вариантов самым благоприятным можно считать лизин, у которого наблюдаются две водородные связи и возможный солевой мостик, для которого при этом таких больших клэшей, как в случае аспарагина, глутамина и аргинина не наблюдается, где также можно выявить гидрофобные взаимодействия. По моему мнению, остаток Q/13 это лизин.
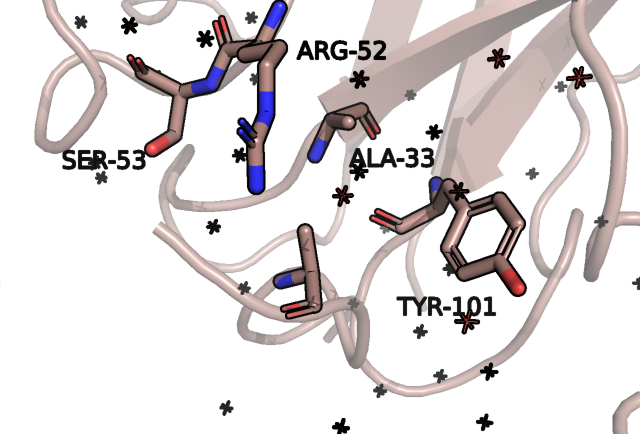
На рис.6 мы видим, что в этом случае в глаза бросается много вариантов, причем, гидрофобные остатки мы тоже сразу исключаем из-за окружения, первый - это остаток серина или треонина, который может вступать в водородные связи с остовами аланина и тирозина:
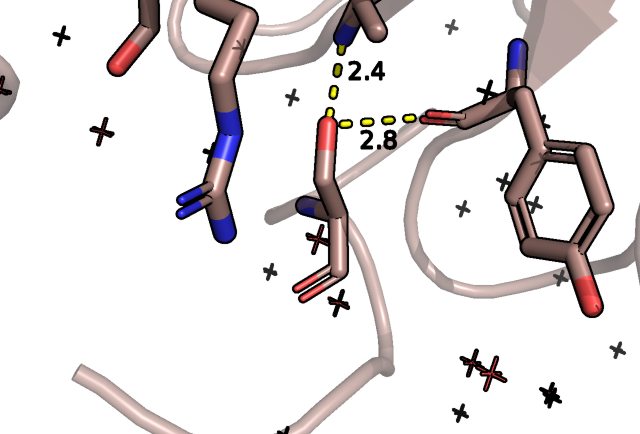
В случае серина нам подходит ротамер по представленности 2/3 с напряженностью 10,30, однако тут сразу бросается в глаза вакуум между этим остатком и остатками аргинина и тирозина, что будет наблюдаться и у треонина, поэтому его мы уже не рассматриваем и считаем такие варианты не самыми благоприятными.
Отталкиваясь от этого самого вакуума и наличия рядом с этим пространством аргинина и тирозина, мы ожидаем следующую картину: от тирозина это может быть стекинг, пи-катионные (но в нашем случае близость к положительно заряженному аргинину совсем не способствует такому раскладу) и пи-водородные взаимодействия, от аргинина это солевой мостик (но опять-таки близость к пи-системе не очень этому благоприятствует), водородные связи и взаимодействия с пи-системой. То есть у нас может быть гистидин и тирозин (стекинг плюс водородные взаимодействия), аспарагин и глутамин (водородные и пи-водородные взаимодействия). Начнем с глутамина и аспарагина:
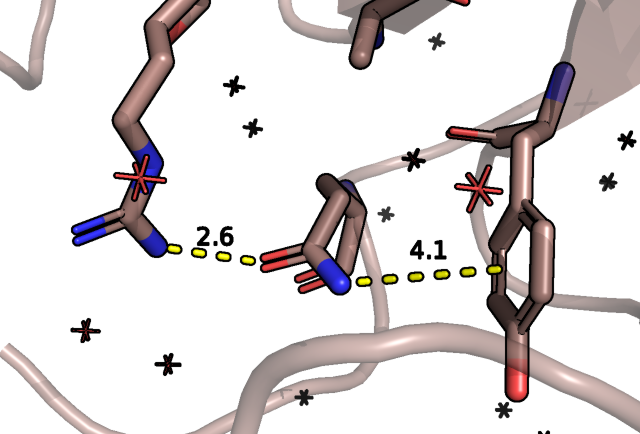
Для гистидина:
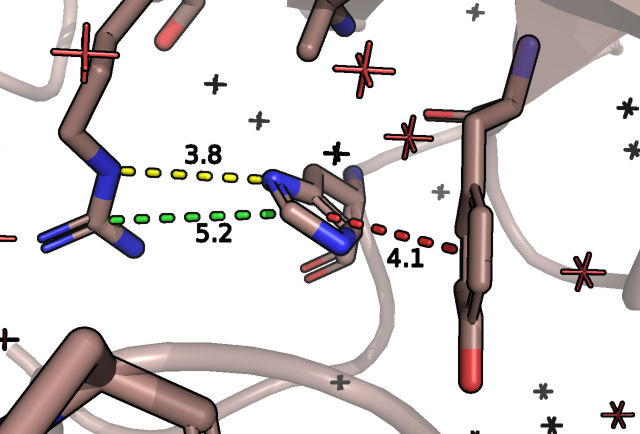
Рассмотрим вероятность замены на тирозин:
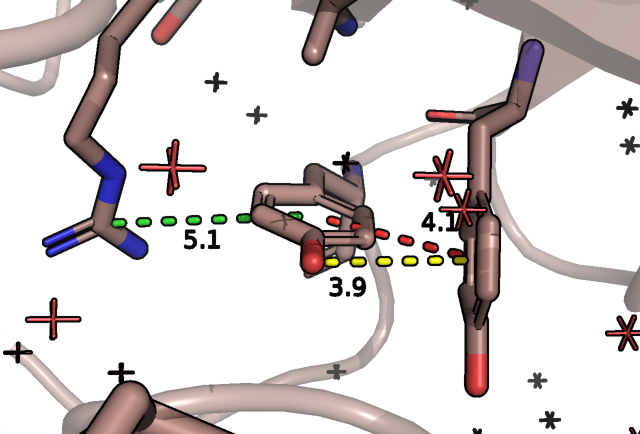
В этом случае самым вероятным мне показался ротамер с представленностью 4/4, однако с самой маленькой напряженностью, он в теории способен также образовывать пи-катионное взаимодействие с аргинином, т-стекинг с тирозином и (не самое вероятное) пи-водородные взаимодействия с этим же тирозином. Как итог можно сказать, что самым вероятным тут видится гистидин, потому что в отличие от аспарагина и глутамина не наблюдается такого большого пустого пространства, в отличие от тирозина больше потенциальных взаимодействий и меньше стерических затруднений, тут можно еще учесть, что остатки, напротив выбранных ротамеров и окаймляющие это пустое пространоство, являются гидрофобными (отсюда понятно отсутствие там воды), а кислород тирозина не очень вписывается в их окружение, так как смотрит прямо на них. По моему мнению, здесь был остаток гистидина.
Задание 1. PoseViewВ данном задании предлагалось использовать программу PoseView, чтобы сгенерировать 2D диаграмму взаимодействий для структуры из первого практикума, а именно, 5RER, которая представляет комплекс лиганда с ковидной протеазой. На выходе программы получилась следующая картинка:
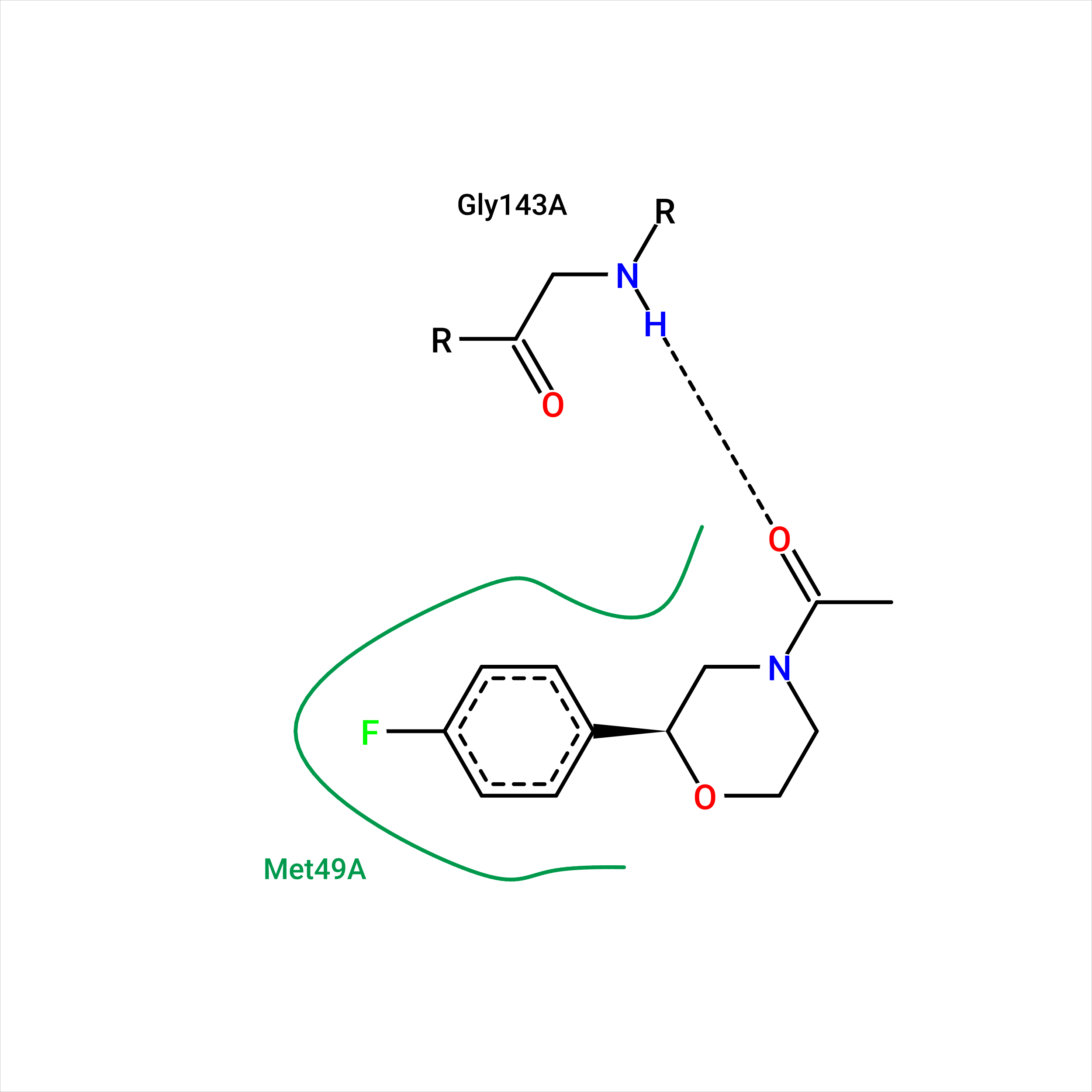
На рис.11 мы видим, что программа показала наличие водородных взаимодействий только с одним аминокислотным остатком, да еще и не с тем, с которыми когда-то их выделила я. Разберем выделенные мной тогда взаимодействия:
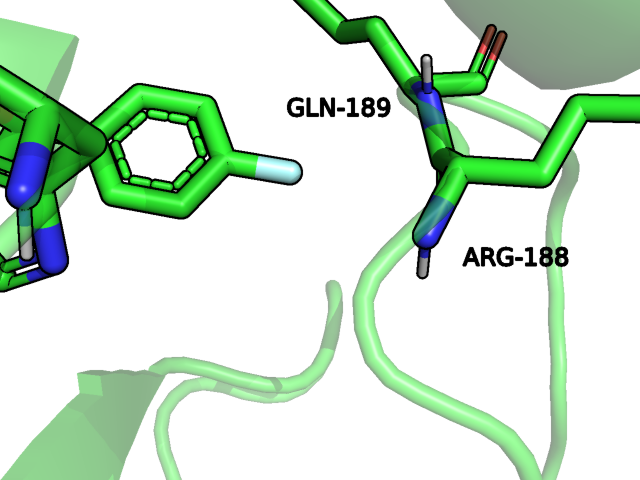
На рис.12 при восстановлении водородов с помощью Pymol, что для остова делается однозначно, мы видим, что донор водородной связи смотрит вообще не в сторону акцептора, поэтому сейчас я бы эту пару как кандидатов на взаимодействие не выбрала.
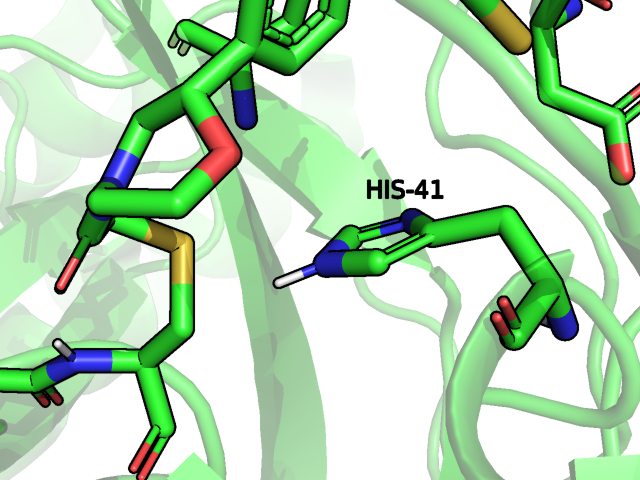
В случае с гистидином можно сказать то же самое, так как атом азота боковой группы гистидина для взаимодействия с атомом кислорода лиганда должен быть донором водорода, который находится в плоскости кольца, геометрия этого взаимодействия кажется слишком неблагоприятной. Для остовного азота серина наблюдается та же картина, однако в случае цистеина 145 на мой взгляд геометрия достаточно убедительная, но это уже вопрос обговоренных порогов по углу и расстоянию для водородной связи:
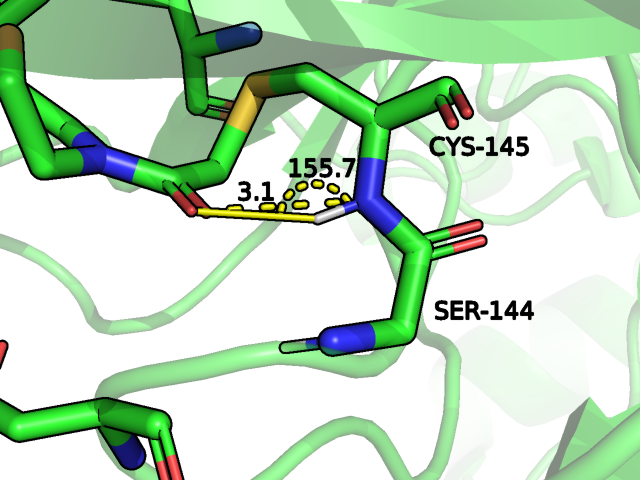
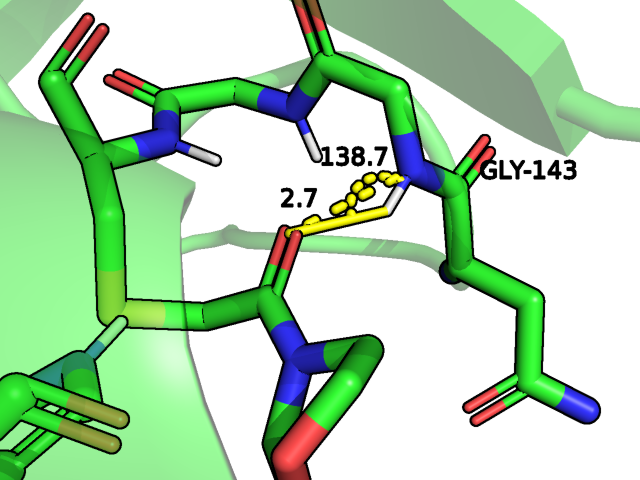
В случае найденного программой взаимодействия с остовом глицина 143 не совсем понятно почему программа выявила его, пропустив в таком случае уже упомянутый цистеин, так как расстояние от донора до акцептора здесь немногим меньше, а угол даже хуже:
Наконец, касательно гидрофобных взаимодействий и я, и программа на мой нынешний взгляд выявили не всех кандидатов:
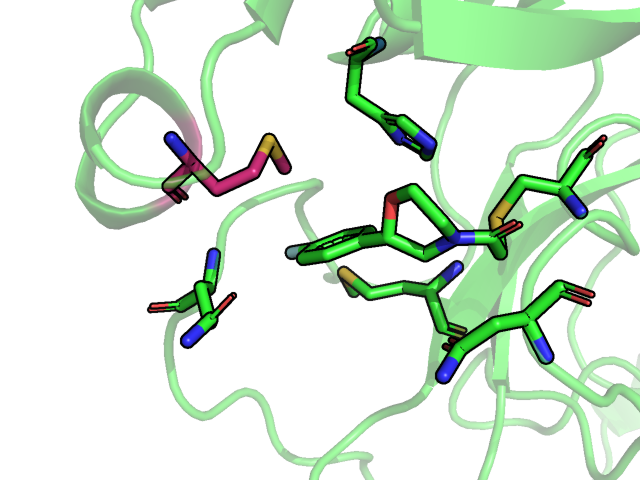
Программа относительно гидрофобики показала только один остаток метионина, в то время на мой взгляд здесь могут принимать участие следующие группы: радикалы метионинов, -CH2- группы глутамина, аспарагина, гистидина и цистеина.
©Makarikova Olga 2020