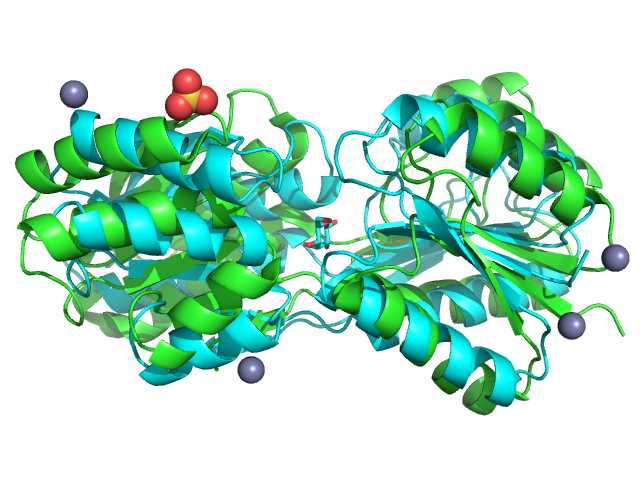

На рис.1 мы видим, что в случае структуры 1gud (открытая конформация согласно PDB) наблюдается отсутствие субстрата, в структуре же 1rpj он не только присутствует, но и сами петли, окаймляющие предполагаемый сайт связывания, где сидит сахар, кажутся более сближенными, по-видимому, формируя закрытую конформацию, благоприятную для дальнейшей работы белка.
Теперь воспользуемся командой get_area и посчитаем нужные площади:
Как можно заметить из Таблицы 1, значения поверхности, доступной растворителю, в обоих случаях оказались меньше таковых для молекулярной поверхности, что можно объяснить наличием каналов и карманов связывания белка, так как для "выпуклой поверхности" (большая часть глобулы) очевидно, что площадь SAS должна быть больше молекулярной, но, видимо, благодаря наличию и "вогнутых областей" (карманы и каналы), для которых, очевидно, все наоборот, площадь MS перевешивает. В нашем же случае этот карман оказался еще довольно большим, что увеличивает вклад в эту разницу площадей. При сравнении площадей поверхности для открытой и закрытой конформаций в обоих случаях видно уменьшение при переходе к закрытой форме, что может объясняться сближением атомов белка, при котором еще больше точек оказались исключены из рассмотрения при подсчете MSA, в случае же SASA аналогично молекулы растворителя уже не поместились в какие-то сближенные области пространства, вызванные изменением конформации.
Задание 2. Карманы, объем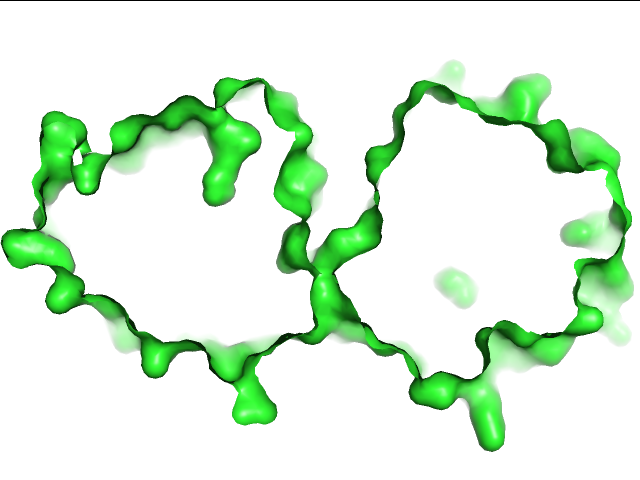

На рис.2 мы видим, что структура большого кармана посередине сильно изменяется при переходе к закрытой конфомации, а именно, он буквально закрывается, внутри же мы можем видеть молекулу субстрата. Теперь запустим fpocket и посмотрим выдачу.
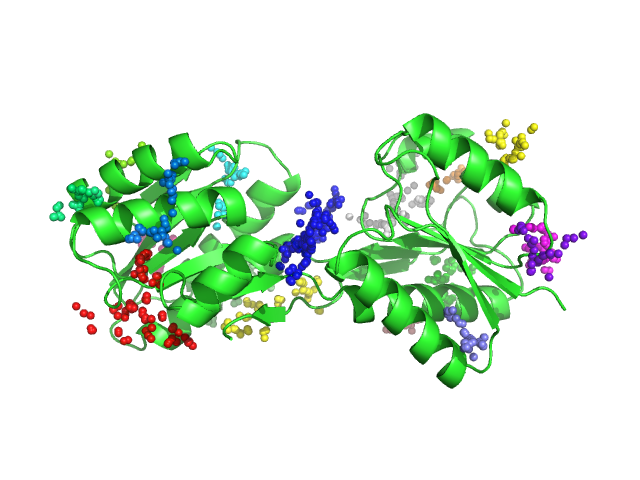
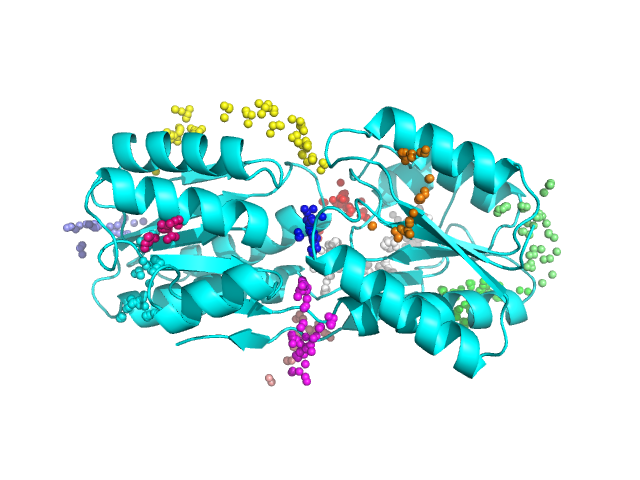
Как мы видим на рис.3 программа нашла много карманов, что подтверждает наши рассуждения о площади поверхности в Задании 1. Карман связывания, который мы определили глазами в обоих случаях, был найден программой, его я обозначила синим цветом. Объем же, Real volume (approximation), программа выдала следующий: 3845.4255 A^3 и 555.7493 A^3 для открытой и закрытой конформаций, соответственно, что согласуется с нашими наблюдениями. Отсюда можно сделать вывод, что программа fpocket, по крайней мере, в этом случае выдала осмысленный результат и в случае закрытой конформации площадь главного кармана связывания уменьшается.
Задание 3. ЭкспонированностьВ последнем задании было предложено воспользоваться программой mkdssp и получить с ее помощью значения экспонированности каждого остатка в двух структурах, которая измеряется программой как SASA (остатка)/10, после оценить влияние "закрытия" белка на эту величину для каждого остатка и обратить внимание на тот, значение экспонированности которого изменилось сильнее всего.
На выходе программы mkdssp были получены файлы 1gud.dssp и 1rpj.dssp, которые затем подавались на вход ProDy. Написав скрипт на Python и используя инструментарий ProDy (скрипт: exposure.ipynb), я получила следующее: больше всего экспонированность поменялась у остатка глутамата 42, причем, в меньшую сторону (с 972.0 до 270.0) для оценки через разность, при оценивании отношения экспонированности в первом и во втором случае этим остатком оказался аспарагин 145, экспонированность которого также уменьшилась (с 496.0 до 8.0). По моему мнению, здесь целесообразнее брать первый вариант, так как для отношения величин вес остатков с небольшой экспонированностью растет, причем, существенно, в нашем же случае нас интересуют изменения на поверхности белка, значит, кажется разумным смотреть именно на более экспонированные остатки, то есть ситуация, когда вклад остатков с маленькой экспонированностью растет, нам не очень подходит.
В итоге, для глутамата наблюдается следующая картина:
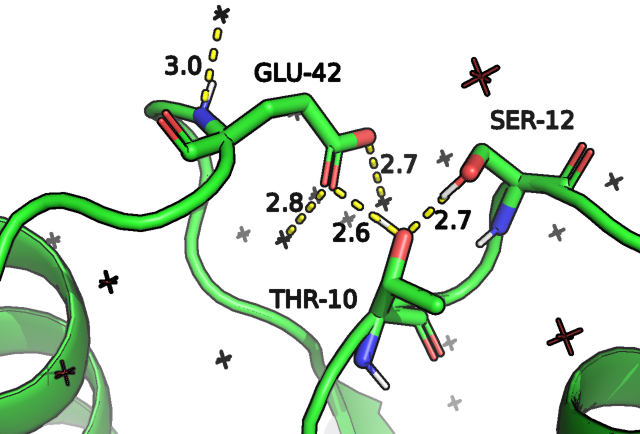
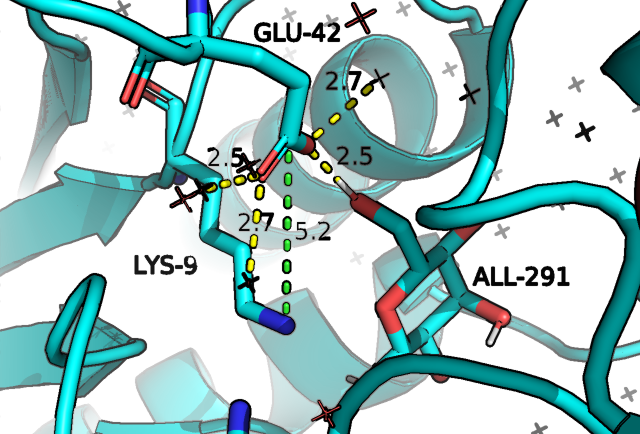
Как мы видим на рис.4, в случае открытой конформации у нас наблюдаются 4 водородные связи, три из которых - с молекулами воды сольватной оболочки, а взаимодействия между глутаматом, треонином и серином обуславливают текущую конформацию петель. В случае закрытой мы видим ,предположительно, 4 водородные связи и один солевой мостик, причем, одна из связей образована с молекулой субстрата, что может говорить о вовлеченности связанного сахара в "закрытие" белка, что согласуется с представлениями о том, что закрытая конформация - это конформация белка, формирующаяся после связывания субстрата и являющаяся благоприятной для дальнейшей работы макромолекулы. Мы видим также, что в сравнении с открытой закрытая конформация глутамата лучше стабилизирована (за счет наличия солевого мостика, который, вероятно, и удерживает петли).
В случае аспарагина 145 тоже хорошо видно движение петель и взаимодействия, стабилизирующие каждую конформацию:
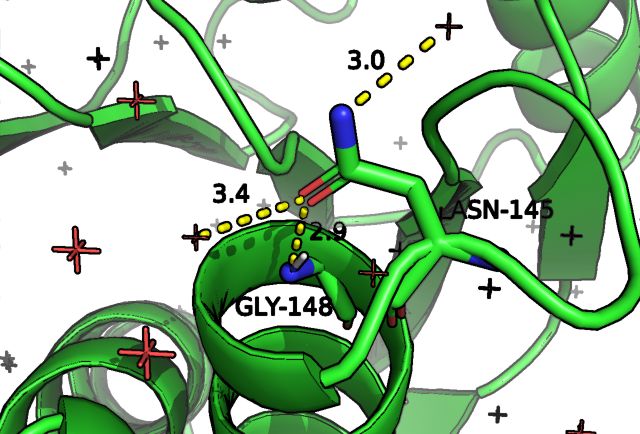
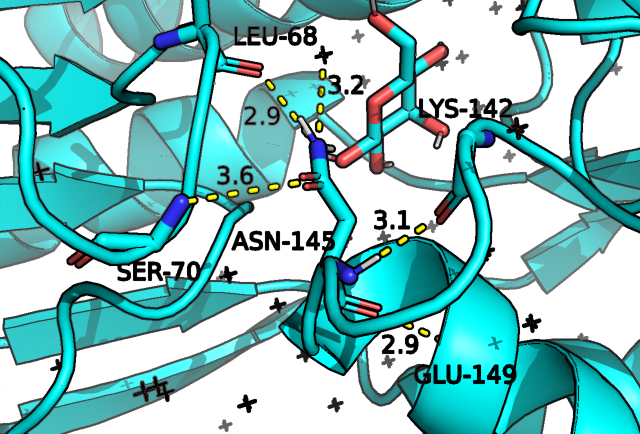
На рис.5 мы видим, что в случае открытой конформации наблюдается 3 водородные связи через боковую группу аспарагина, для закрытой мы видим аж 5 предполагаемых водородных взаимодействий, часть из которых сформирована в том числе остовом остатка.
В обоих случаях изменение экспонированности связано со сближением петель, а следовательно, с вытеснением потенциально вступающих в контакт молекул воды. В первом случае ярко видно возможное влияние связанного субстрата на изменение конформации белка.
©Makarikova Olga 2020